1 . 为探究铜与浓硫酸的反应,某兴趣小组进行了如下实验。
【实验1】铜与浓硫酸反应,实验装置如图所示:
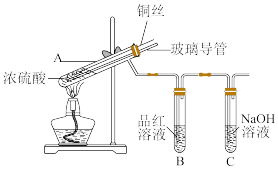
(1)装置A中发生反应的化学方程式为:_______ 。
(2)装置B中的现象为:_______ 。
(3)熄灭酒精灯后,B中的液体不会倒吸,其原因是:_______ 。
(4)拆除装置前,不打开胶塞,为了使装置中的残留气体完全被吸收,应当采取的操作是:_______ 。
【实验2】实验中发现试管内除了产生白色固体外,在铜丝表面还有黑色固体甲生成,甲中可能含有氧化铜、氧化亚铜、硫化铜、硫化亚铜。
查阅资料:
①氧化亚铜在酸性环境下会发生自身氧化还原反应生成 和铜单质,在空气中充分煅烧,可以转化为氧化铜。
和铜单质,在空气中充分煅烧,可以转化为氧化铜。
②硫化铜和硫化亚铜常温下都不溶于稀盐酸,在空气中充分煅烧,均转化为氧化铜和二氧化硫。为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如下实验:
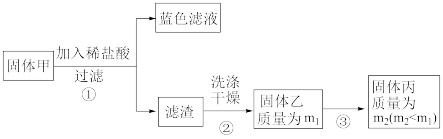
(5)确定乙是否煅烧完全的操作是:_______ 。
(6)煅烧过程中一定发生的化学反应方程式为:_______ 。
(7)由以上实验得出的结论是:甲中一定含有:_______ 。
【实验1】铜与浓硫酸反应,实验装置如图所示:

(1)装置A中发生反应的化学方程式为:
(2)装置B中的现象为:
(3)熄灭酒精灯后,B中的液体不会倒吸,其原因是:
(4)拆除装置前,不打开胶塞,为了使装置中的残留气体完全被吸收,应当采取的操作是:
【实验2】实验中发现试管内除了产生白色固体外,在铜丝表面还有黑色固体甲生成,甲中可能含有氧化铜、氧化亚铜、硫化铜、硫化亚铜。
查阅资料:
①氧化亚铜在酸性环境下会发生自身氧化还原反应生成
 和铜单质,在空气中充分煅烧,可以转化为氧化铜。
和铜单质,在空气中充分煅烧,可以转化为氧化铜。②硫化铜和硫化亚铜常温下都不溶于稀盐酸,在空气中充分煅烧,均转化为氧化铜和二氧化硫。为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如下实验:

(5)确定乙是否煅烧完全的操作是:
(6)煅烧过程中一定发生的化学反应方程式为:
(7)由以上实验得出的结论是:甲中一定含有:
您最近一年使用:0次
2 . 人类的农业生产离不开氮肥,几乎所有的氮肥都以氨为原料生产。某化学兴趣小组在实验室利用如图装置制备氨气并探究相关性质。
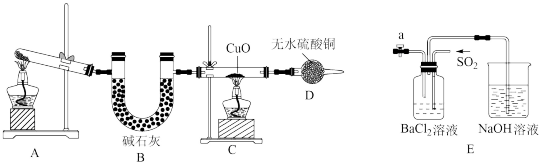
(1)该实验中A装置制备 的化学方程式是
的化学方程式是_______ 。
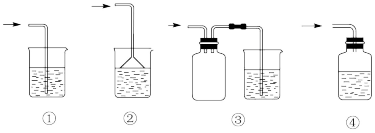
(2)D装置后接尾气吸收装置。下列能用来吸收尾气的装置是_______ (填装置序号)。
(3)若将D与a相连,在E中产生白色沉淀。其化学式为:_______ 。若向a处单独通入_______ (填下列气体字母编号),在E中也会产生白色沉淀。
A. B.
B. C.
C. D.
D.
(4)实验发现C中粉末完全变红,D中无水硫酸铜变蓝,还产生一种单质气体。
①若红色固体为单质,实验后将C中固体与浓硫酸混合加热,其化学方程式为:_______ ;若充分反应后红色固体有剩余,再加入下列的_______ (填字母)试剂,固体又可以继续溶解。
A.稀 B.
B. 溶液 C.
溶液 C. 溶液 D.
溶液 D. 溶液
溶液
②已知 也为红色固体,若反应前C中CuO质量为8g。反应后C中红色固体质量为6.8g,则C中发生的总反应化学方程式为:
也为红色固体,若反应前C中CuO质量为8g。反应后C中红色固体质量为6.8g,则C中发生的总反应化学方程式为:_______ 。

(1)该实验中A装置制备
 的化学方程式是
的化学方程式是(2)D装置后接尾气吸收装置。下列能用来吸收尾气的装置是

(3)若将D与a相连,在E中产生白色沉淀。其化学式为:
A.
 B.
B. C.
C. D.
D.
(4)实验发现C中粉末完全变红,D中无水硫酸铜变蓝,还产生一种单质气体。
①若红色固体为单质,实验后将C中固体与浓硫酸混合加热,其化学方程式为:
A.稀
 B.
B. 溶液 C.
溶液 C. 溶液 D.
溶液 D. 溶液
溶液②已知
 也为红色固体,若反应前C中CuO质量为8g。反应后C中红色固体质量为6.8g,则C中发生的总反应化学方程式为:
也为红色固体,若反应前C中CuO质量为8g。反应后C中红色固体质量为6.8g,则C中发生的总反应化学方程式为:
您最近一年使用:0次
2022-07-13更新
|
323次组卷
|
3卷引用:辽宁省抚顺市六校协作体2021-2022学年高一下学期期末考试化学试题
3 . 介孔 纳米晶可用作钠离子电池正极材料。一科研团队以某矿石(含55.2%
纳米晶可用作钠离子电池正极材料。一科研团队以某矿石(含55.2% 、32%
、32% ,其余为
,其余为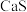 和
和 )为原料开发的一种合成介孔
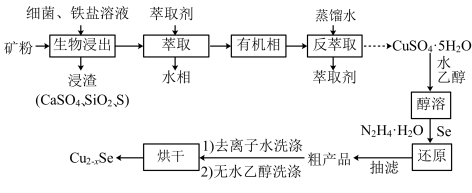
)为原料开发的一种合成介孔 的路线如图所出示。回答下列问题:
的路线如图所出示。回答下列问题:
(1)基态 原子价电子的轨道表示式为
原子价电子的轨道表示式为___________ 。
(2)“生物浸出”时, 与铁盐溶液反应的离子方程式为
与铁盐溶液反应的离子方程式为___________ 。此时铁盐___________ (填“作氧化剂”、“作还原剂”或“既不是氧化剂,也不是还原剂”)。
(3)将“浸渣”溶于 ,再过滤、蒸馏,可从“浸渣”中分离出
,再过滤、蒸馏,可从“浸渣”中分离出___________ (填化学式)。
(4)实验室“萃取”时,用到的主要仪器是___________ ,若萃取剂为苯,“萃取”后得到的“水相”位于___________ (填“上层”或“下层”)。
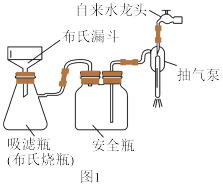
(5)利用如图1装置完成“抽滤”操作,抽滤的主要优点是过滤较快、固体较干燥,其中安全瓶的作用是___________ 。
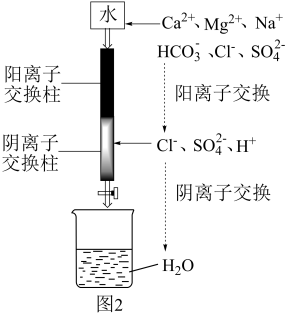
(6)利用如图2装置制备去离子水,水中所含的阴离子在阳离子交换柱中发生反应的离子方程式为___________ 。
(7)某工厂用10吨该矿石合成介孔 ,已知整个流程中
,已知整个流程中 的损耗率为10%,
的损耗率为10%,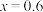 ,则最终可以得到
,则最终可以得到
___________ 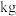 。
。
 纳米晶可用作钠离子电池正极材料。一科研团队以某矿石(含55.2%
纳米晶可用作钠离子电池正极材料。一科研团队以某矿石(含55.2% 、32%
、32% ,其余为
,其余为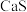 和
和 )为原料开发的一种合成介孔
)为原料开发的一种合成介孔 的路线如图所出示。回答下列问题:
的路线如图所出示。回答下列问题:
(1)基态
 原子价电子的轨道表示式为
原子价电子的轨道表示式为(2)“生物浸出”时,
 与铁盐溶液反应的离子方程式为
与铁盐溶液反应的离子方程式为(3)将“浸渣”溶于
 ,再过滤、蒸馏,可从“浸渣”中分离出
,再过滤、蒸馏,可从“浸渣”中分离出(4)实验室“萃取”时,用到的主要仪器是
(5)利用如图1装置完成“抽滤”操作,抽滤的主要优点是过滤较快、固体较干燥,其中安全瓶的作用是

(6)利用如图2装置制备去离子水,水中所含的阴离子在阳离子交换柱中发生反应的离子方程式为

(7)某工厂用10吨该矿石合成介孔
 ,已知整个流程中
,已知整个流程中 的损耗率为10%,
的损耗率为10%,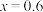 ,则最终可以得到
,则最终可以得到
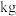 。
。
您最近一年使用:0次
解题方法
4 . 实验室利用如图装置探究SO2还原CuO,并进一步检测产物含量。回答下列相关问题:

Ⅰ. SO2还原CuO探究
(1)装置A中发生反应的化学方程式_______________________________________ 。
(2)在制取SO2时,使用H2SO4溶液的浓度为__________ 时(填序号,从下列浓度中选取),制备SO2的速率明显快。请解释不选下列其它浓度硫酸的原因____________________ 。
a. 98% H2SO4 b.65% H2SO4 c. 5% H2SO4
(3)充分反应后,黑色固体变为红色。取C中适量的产物,加水后溶液显蓝色并有红色沉淀物,取红色沉淀物滴加盐酸,溶液又呈现蓝色并仍有少量红色不溶物,由此可以得出:
①已知SO2与CuO反应生成两种产物,写出该化学方程式___________________________ 。
②取红色沉淀物滴加盐酸,反应的离子方程式______________________________________ 。
Ⅱ.生成物中CuSO4含量检测
(4)用“碘量法”测定产物中CuSO4含量。取m g固体溶解于水配制成100mL溶液,取20.00mL溶液滴加几滴稀硫酸,再加入过量KI溶液,以淀粉为指示剂用Na2S2O3标准溶液滴定,相关化学反应为2Cu2++4I-=2CuI↓+I2,I2+I-⇌I ,I2+2S2O
,I2+2S2O =S4O
=S4O +2I-。
+2I-。
①若消耗0.1000mol/L Na2S2O3标准溶液VmL,则产物中CuSO4质量分数为____________ 。
②CuI沉淀物对I 具有强的吸附能力,由此会造成CuSO4质量分数测定值
具有强的吸附能力,由此会造成CuSO4质量分数测定值_______ (填“偏大”或“偏小”)。

Ⅰ. SO2还原CuO探究
(1)装置A中发生反应的化学方程式
(2)在制取SO2时,使用H2SO4溶液的浓度为
a. 98% H2SO4 b.65% H2SO4 c. 5% H2SO4
(3)充分反应后,黑色固体变为红色。取C中适量的产物,加水后溶液显蓝色并有红色沉淀物,取红色沉淀物滴加盐酸,溶液又呈现蓝色并仍有少量红色不溶物,由此可以得出:
①已知SO2与CuO反应生成两种产物,写出该化学方程式
②取红色沉淀物滴加盐酸,反应的离子方程式
Ⅱ.生成物中CuSO4含量检测
(4)用“碘量法”测定产物中CuSO4含量。取m g固体溶解于水配制成100mL溶液,取20.00mL溶液滴加几滴稀硫酸,再加入过量KI溶液,以淀粉为指示剂用Na2S2O3标准溶液滴定,相关化学反应为2Cu2++4I-=2CuI↓+I2,I2+I-⇌I
 ,I2+2S2O
,I2+2S2O =S4O
=S4O +2I-。
+2I-。①若消耗0.1000mol/L Na2S2O3标准溶液VmL,则产物中CuSO4质量分数为
②CuI沉淀物对I
 具有强的吸附能力,由此会造成CuSO4质量分数测定值
具有强的吸附能力,由此会造成CuSO4质量分数测定值
您最近一年使用:0次



