名校
1 . FeCl3是中学常见的试剂,某实验小组用以下装置制备FeCl3固体,并探究FeCl3溶液与Cu的反应。
已知:FeCl3晶体易升华,FeCl3溶液易水解。
Ⅰ.FeCl3的制备___________ 。
(2)F的名称为___________ ,从D、E、F中选择合适的装置制备纯净的 ,正确的接口顺序为a-
,正确的接口顺序为a-___________ (可选试剂:饱和食盐水、NaOH溶液、浓硫酸、碱石灰,仪器可重复使用)。
(3)写出装置D中制备 的离子方程式
的离子方程式___________ 。
Ⅱ.探究FeCl3溶液与Cu的反应
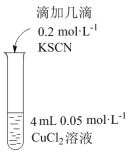
向4mL0.1mol/LFeCl3溶液中滴加几滴0.2mol/LKSCN溶液,溶液变红;再加入过量Cu粉,溶液红色褪去,不久有白色沉淀产生。
查阅资料可知: 和
和 均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:
均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:
猜想1: 与过量的Cu粉反应生成
与过量的Cu粉反应生成 ,再结合
,再结合 生成白色沉淀
生成白色沉淀 。
。
猜想2: 与
与 发生氧化还原反应生成
发生氧化还原反应生成 ,再结合
,再结合 生成白色沉淀
生成白色沉淀 。
。
针对上述猜想,实验小组同学设计了以下实验:
(4)实验结果说明猜想___________ (填“1”或“2”)不合理。
(5)根据实验2中的现象进一步查阅资料发现:
i. 与
与 可发生如下两种反应:
可发生如下两种反应:
反应A: (淡黄色);
(淡黄色);
反应B: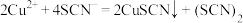 (黄色)。
(黄色)。
ii. 与
与 共存时溶液显绿色。
共存时溶液显绿色。
①由实验2中的现象推测,反应速率:A___________ (填“>”或“<”)B,说明反应B___________ (填“是”或“不是”)产生 的主要原因。
的主要原因。
②进一步查阅资料可知,当反应体系中同时存在 、
、 、
、 时,
时, 氧化性增强,可将
氧化性增强,可将 氧化为
氧化为 。据此将实验2改进,向
。据此将实验2改进,向 溶液中同时加入
溶液中同时加入 、
、 ,立即生成白色沉淀
,立即生成白色沉淀 ,写出该反应离子方程式
,写出该反应离子方程式___________ 。
(6)若向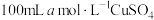 溶液中滴加足量的
溶液中滴加足量的 和
和 的混合溶液,经过一系列操作得到白色沉淀
的混合溶液,经过一系列操作得到白色沉淀 的质量
的质量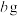 ,则
,则 的产率为
的产率为___________ (写出表达式即可)。
已知:FeCl3晶体易升华,FeCl3溶液易水解。
Ⅰ.FeCl3的制备
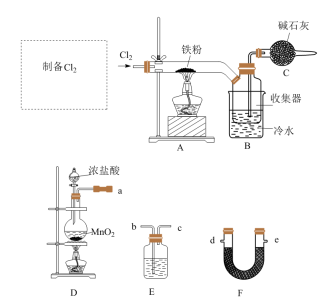
(2)F的名称为
 ,正确的接口顺序为a-
,正确的接口顺序为a-(3)写出装置D中制备
 的离子方程式
的离子方程式Ⅱ.探究FeCl3溶液与Cu的反应
向4mL0.1mol/LFeCl3溶液中滴加几滴0.2mol/LKSCN溶液,溶液变红;再加入过量Cu粉,溶液红色褪去,不久有白色沉淀产生。
查阅资料可知:
 和
和 均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:
均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:猜想1:
 与过量的Cu粉反应生成
与过量的Cu粉反应生成 ,再结合
,再结合 生成白色沉淀
生成白色沉淀 。
。猜想2:
 与
与 发生氧化还原反应生成
发生氧化还原反应生成 ,再结合
,再结合 生成白色沉淀
生成白色沉淀 。
。针对上述猜想,实验小组同学设计了以下实验:
| 实验编号 | 操作 | 现象 |
| 实验1 |
| 加入铜粉后无现象 |
| 实验2 |
| 溶液很快由蓝色变为绿色,未观察到白色沉淀; 2h后溶液为绿色,未观察到白色沉淀;24h后, 溶液绿色变浅,试管底部有白色沉淀 |
(5)根据实验2中的现象进一步查阅资料发现:
i.
 与
与 可发生如下两种反应:
可发生如下两种反应:反应A:
 (淡黄色);
(淡黄色);反应B:
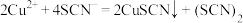 (黄色)。
(黄色)。ii.
 与
与 共存时溶液显绿色。
共存时溶液显绿色。①由实验2中的现象推测,反应速率:A
 的主要原因。
的主要原因。②进一步查阅资料可知,当反应体系中同时存在
 、
、 、
、 时,
时, 氧化性增强,可将
氧化性增强,可将 氧化为
氧化为 。据此将实验2改进,向
。据此将实验2改进,向 溶液中同时加入
溶液中同时加入 、
、 ,立即生成白色沉淀
,立即生成白色沉淀 ,写出该反应离子方程式
,写出该反应离子方程式(6)若向
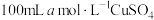 溶液中滴加足量的
溶液中滴加足量的 和
和 的混合溶液,经过一系列操作得到白色沉淀
的混合溶液,经过一系列操作得到白色沉淀 的质量
的质量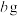 ,则
,则 的产率为
的产率为
您最近一年使用:0次
2023-03-10更新
|
1014次组卷
|
3卷引用:广东省广州大学附属中学2023-2024学年高三上学期开学考试化学试题
名校
解题方法
2 . 某小组为了探究 溶液和
溶液和 溶液反应的情况,开展了如下活动。回答下列问题:
溶液反应的情况,开展了如下活动。回答下列问题:
【查阅资料】
①CuCl、CuI为难溶于水的白色固体;
② 在酸性环境中易歧化为Cu和
在酸性环境中易歧化为Cu和 ;
;
③ (无色溶液)
(无色溶液)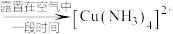 (深蓝色溶液)
(深蓝色溶液)
【理论预测】 溶液和
溶液和 溶液反应的主要含铜产物的可能情况:
溶液反应的主要含铜产物的可能情况:
(1)二者因发生复分解反应生成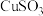 ;二者因发生双水解反应生成
;二者因发生双水解反应生成___________ ;二者因发生氧化还原反应生成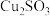 、CuCl;……
、CuCl;……
【实验探究一】 溶液和
溶液和 溶液反应
溶液反应
(2)取少量实验1中已洗净的白色沉淀于试管中,滴加足量浓氨水,先观察到___________ ,反应的离子方程式为___________ ;露置一段时间,又观察到___________ ,证明白色沉淀为CuCl。
【实验探究二】棕黄色沉淀的成分探究
(3)实验1中棕黄色沉淀存在时间较短,难以获得。实验小组将实验1中的 溶液替换为等体积等浓度的
溶液替换为等体积等浓度的___________ 溶液,成功制备了棕黄色沉淀,并进行了如下实验。
(4)实验2中可观察到现象:___________ ,证棕黄色沉淀中含有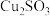 。
。
(5)实验3中因发生了反应___________ 、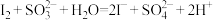 ,使得上层清液呈无色且不能使淀粉溶液变蓝;白色沉淀B是
,使得上层清液呈无色且不能使淀粉溶液变蓝;白色沉淀B是 ,试剂1是
,试剂1是___________ ;据此证明棕黄色沉淀中含有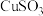 。
。
 溶液和
溶液和 溶液反应的情况,开展了如下活动。回答下列问题:
溶液反应的情况,开展了如下活动。回答下列问题:【查阅资料】
①CuCl、CuI为难溶于水的白色固体;
②
 在酸性环境中易歧化为Cu和
在酸性环境中易歧化为Cu和 ;
;③
 (无色溶液)
(无色溶液)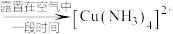 (深蓝色溶液)
(深蓝色溶液)【理论预测】
 溶液和
溶液和 溶液反应的主要含铜产物的可能情况:
溶液反应的主要含铜产物的可能情况:(1)二者因发生复分解反应生成
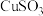 ;二者因发生双水解反应生成
;二者因发生双水解反应生成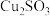 、CuCl;……
、CuCl;……【实验探究一】
 溶液和
溶液和 溶液反应
溶液反应| 编号 | 实验操作 | 实验现象 |
| 1 | 2mL0.2  溶液和1mL0.2 溶液和1mL0.2  溶液混合 溶液混合 | 立即有棕黄色沉淀生成,3min后沉淀颜色变浅并伴有少量白色沉淀产生,再振荡1min后沉淀全部变为白色 |
(2)取少量实验1中已洗净的白色沉淀于试管中,滴加足量浓氨水,先观察到
【实验探究二】棕黄色沉淀的成分探究
(3)实验1中棕黄色沉淀存在时间较短,难以获得。实验小组将实验1中的
 溶液替换为等体积等浓度的
溶液替换为等体积等浓度的| 编号 | 实验操作 |
| 2 | 取少量洗净的裟黄色沉淀于试管中,并加入一定量的稀硫酸 |
| 3 | 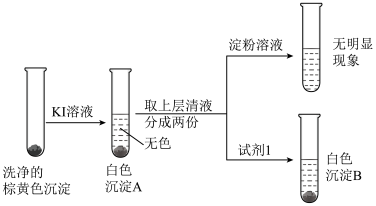 注:实验所用试剂均经过除氧处理 |
(4)实验2中可观察到现象:
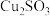 。
。(5)实验3中因发生了反应
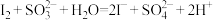 ,使得上层清液呈无色且不能使淀粉溶液变蓝;白色沉淀B是
,使得上层清液呈无色且不能使淀粉溶液变蓝;白色沉淀B是 ,试剂1是
,试剂1是 。
。
您最近一年使用:0次
名校
解题方法
3 . 碱式氯化镁(MgOHCl)常用作塑料添加剂,工业上制备方法较多,其中利用氢氧化镁热分解氯化铵制氨气并得到碱式氯化镁的工艺属于我国首创。某中学科研小组根据该原理设计如下装置图进行相关实验,装置C中CuO的质量为8.0g。
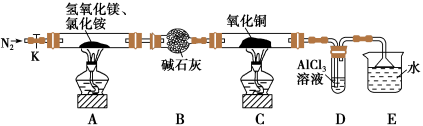
请回答下列问题:
(1)装置A中发生反应生成碱式氯化镁的化学方程式为:___________ 。
(2)装置D中生成沉淀,发生反应的离子方程式为___________ 。
(3)反应过程中持续通入N2的作用有两点:一是:将装置A中产生的氨气完全导出,二是:_______ 。
(4)若测得碱石灰的质量增加了ag,则得到碱式氯化镁的质量为___________ g。
(5)反应完毕,装置C中的氧化铜全部由黑色变为红色,称其质量为6.8g,且生成的气体可直接排放到大气中,该反应中转移电子的物质的量为___ mol,写出装置C中发生的化学反应方程式_____ 。

请回答下列问题:
(1)装置A中发生反应生成碱式氯化镁的化学方程式为:
(2)装置D中生成沉淀,发生反应的离子方程式为
(3)反应过程中持续通入N2的作用有两点:一是:将装置A中产生的氨气完全导出,二是:
(4)若测得碱石灰的质量增加了ag,则得到碱式氯化镁的质量为
(5)反应完毕,装置C中的氧化铜全部由黑色变为红色,称其质量为6.8g,且生成的气体可直接排放到大气中,该反应中转移电子的物质的量为
您最近一年使用:0次
4 . Ⅰ.铜与浓硝酸反应的装置如下图。

(1)仪器A的名称为_______ ,装置B的作用为_______ 。
(2)装置C中发生反应的离子方程式为_______ 。
Ⅱ.胆矾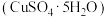 是一种重要化工原料,某研究小组以生锈的铜屑为原料[主要成分是
是一种重要化工原料,某研究小组以生锈的铜屑为原料[主要成分是 ,含有少量的油污、
,含有少量的油污、 、
、 、
、 ]制备胆矾。流程如下。
]制备胆矾。流程如下。
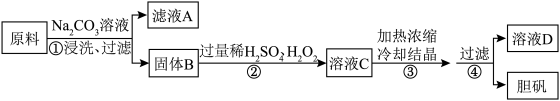
回答下列问题:
(3)“步骤①”中使用 溶液的目的是
溶液的目的是_______ 。
(4)“步骤②”中,在 存在下
存在下 溶于稀
溶于稀 ,该过程发生反应的化学方程式为
,该过程发生反应的化学方程式为_______ 。
(5)“步骤②”中,该研究小组认为仅用浓 溶解固体
溶解固体 ,也可以得到溶液
,也可以得到溶液 ,该方案的不足之处为
,该方案的不足之处为_______ 。
(6)该研究小组甲乙两名同学继续实验探究,发现溶液D能将 氧化为
氧化为 。
。
a.甲同学认为不可能是“步骤②”中过量 将
将 氧化为
氧化为 ,理由是
,理由是_______ 。
b.乙同学通过实验证实,只能是 将
将 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为_______ 。

(1)仪器A的名称为
(2)装置C中发生反应的离子方程式为
Ⅱ.胆矾
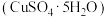 是一种重要化工原料,某研究小组以生锈的铜屑为原料[主要成分是
是一种重要化工原料,某研究小组以生锈的铜屑为原料[主要成分是 ,含有少量的油污、
,含有少量的油污、 、
、 、
、 ]制备胆矾。流程如下。
]制备胆矾。流程如下。
回答下列问题:
(3)“步骤①”中使用
 溶液的目的是
溶液的目的是(4)“步骤②”中,在
 存在下
存在下 溶于稀
溶于稀 ,该过程发生反应的化学方程式为
,该过程发生反应的化学方程式为(5)“步骤②”中,该研究小组认为仅用浓
 溶解固体
溶解固体 ,也可以得到溶液
,也可以得到溶液 ,该方案的不足之处为
,该方案的不足之处为(6)该研究小组甲乙两名同学继续实验探究,发现溶液D能将
 氧化为
氧化为 。
。a.甲同学认为不可能是“步骤②”中过量
 将
将 氧化为
氧化为 ,理由是
,理由是b.乙同学通过实验证实,只能是
 将
将 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为
您最近一年使用:0次
22-23高三上·云南昆明·开学考试
名校
解题方法
5 . 碱式碳酸铜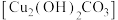 是孔雀石的主要成分,呈暗绿色或淡蓝绿色,难溶于水。某研究性学习小组制定了如下实验来探究制备碱式碳酸铜的最佳配比:将浓度均为
是孔雀石的主要成分,呈暗绿色或淡蓝绿色,难溶于水。某研究性学习小组制定了如下实验来探究制备碱式碳酸铜的最佳配比:将浓度均为 的
的 、
、 溶液混合,磁力搅拌30分钟后置于75℃恒温装置中反应75分钟,冷却至室温后抽滤、洗涤、干燥、称重。实验数据如下表所示。
溶液混合,磁力搅拌30分钟后置于75℃恒温装置中反应75分钟,冷却至室温后抽滤、洗涤、干燥、称重。实验数据如下表所示。
回答下列问题:
(1)本实验中,制备碱式碳酸铜的离子方程式为___________ 。
(2)实现恒温75℃加热可采取的方式为___________ 。
(3)实验过程中,需对碱式碳酸铜沉淀进行抽滤(减压过滤),装置如图甲,抽滤的主要优点是___________ ;检验滤渣是否洗涤干净的实验操作是___________ 。

(4)由以上实验数据判断,生成碱式碳酸铜的反应中, 的最佳比例为
的最佳比例为___________ ;在该比例下,碱式碳酸铜的产率为___________ (保留2位有效数字)。
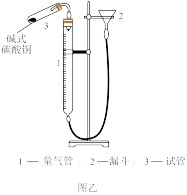
(5)取mg制得的碱式碳酸铜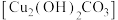 样品,在如图乙装置中加热分解(加热装置已省略),量气管及导管内盛装的试剂为
样品,在如图乙装置中加热分解(加热装置已省略),量气管及导管内盛装的试剂为___________ ,若收集到气体体积为VL(已折算成标准状况下),则样品中 的纯度为
的纯度为___________ %(用含m、V的式子表示)。
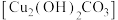 是孔雀石的主要成分,呈暗绿色或淡蓝绿色,难溶于水。某研究性学习小组制定了如下实验来探究制备碱式碳酸铜的最佳配比:将浓度均为
是孔雀石的主要成分,呈暗绿色或淡蓝绿色,难溶于水。某研究性学习小组制定了如下实验来探究制备碱式碳酸铜的最佳配比:将浓度均为 的
的 、
、 溶液混合,磁力搅拌30分钟后置于75℃恒温装置中反应75分钟,冷却至室温后抽滤、洗涤、干燥、称重。实验数据如下表所示。
溶液混合,磁力搅拌30分钟后置于75℃恒温装置中反应75分钟,冷却至室温后抽滤、洗涤、干燥、称重。实验数据如下表所示。| 实验编号 | I | II | III | IV | V |
 体积/mL 体积/mL | 30 | 30 | 30 | 30 | 30 |
 体积/mL 体积/mL | 24 | 30 | 36 | 42 | 48 |
| 产物成分 | 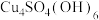 | 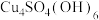  |  |  |  |
| 产物质量/g | 1.4725 | 1.5218 | 1.5473 | 1.5357 | 1.5315 |
(1)本实验中,制备碱式碳酸铜的离子方程式为
(2)实现恒温75℃加热可采取的方式为
(3)实验过程中,需对碱式碳酸铜沉淀进行抽滤(减压过滤),装置如图甲,抽滤的主要优点是

(4)由以上实验数据判断,生成碱式碳酸铜的反应中,
 的最佳比例为
的最佳比例为(5)取mg制得的碱式碳酸铜
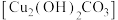 样品,在如图乙装置中加热分解(加热装置已省略),量气管及导管内盛装的试剂为
样品,在如图乙装置中加热分解(加热装置已省略),量气管及导管内盛装的试剂为 的纯度为
的纯度为
您最近一年使用:0次
2022-08-21更新
|
531次组卷
|
3卷引用:云南师范大学附属中学2023-2024学年高三上学期开学考试化学试题
(已下线)云南师范大学附属中学2023-2024学年高三上学期开学考试化学试题云南师范大学附属中学2023-2024学年高三上学期开学考试化学试题云南省昆明市第一中学2022-2023学年高三上学期第一次摸底测试化学试题