2024·贵州贵阳·二模
名校
解题方法
1 . 氯乙烯是用途广泛的石油化工产品,工业上常利用乙烯氧氯化法生产:

已知:ⅰ.
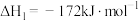
ⅱ.
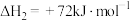
ⅲ.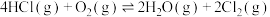
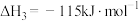
回答下列问题:
(1)
___________  。
。
(2)已知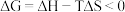 ,反应可自发进行。若
,反应可自发进行。若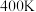 时反应ⅱ中
时反应ⅱ中 ,此时反应ⅱ
,此时反应ⅱ___________ (“能”或“不能”)自发进行。
(3)为提高反应ⅱ中氯乙烯的平衡产率,可采取的措施有___________ 。
a.加入合适的催化剂 b.升高温度 c.增大压强 d.及时氧化
(4)向 密闭容器中初始投入
密闭容器中初始投入 、
、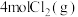 和
和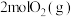 发生乙烯氧氯化反应,不同温度下测得反应在平衡时
发生乙烯氧氯化反应,不同温度下测得反应在平衡时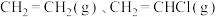 、
、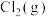 三种组分的体积分数随温度的变化如图1所示。
三种组分的体积分数随温度的变化如图1所示。___________ 和___________ 的体积分数随温度的变化。
②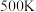 时反应进行到
时反应进行到 达到平衡,
达到平衡, 内用
内用 的浓度变化表示的
的浓度变化表示的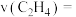
___________ ,该反应的平衡常数
___________ 。
(5)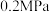 时,控制进料浓度
时,控制进料浓度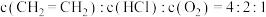 。容器中发生反应
。容器中发生反应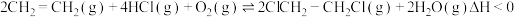 ,不同温度对
,不同温度对 的平衡转化率和催化剂的催化效率的影响如图2所示。(备注:催化效率是指催化剂转化反应物为生成物的能力,通常通过产物的选择性和反应速率来衡量。图2中通过
的平衡转化率和催化剂的催化效率的影响如图2所示。(备注:催化效率是指催化剂转化反应物为生成物的能力,通常通过产物的选择性和反应速率来衡量。图2中通过 转化为
转化为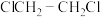 的转化率大小来体现)
的转化率大小来体现)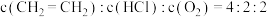 ,所得
,所得 的平衡转化率曲线应在点M的
的平衡转化率曲线应在点M的___________ (填“上”或“下”)方。
②因受现有工业设备限制,需保持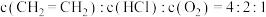 不变,在235℃、
不变,在235℃、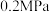 下,若要进一步增大
下,若要进一步增大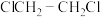 的选择性,可选择从
的选择性,可选择从___________ 方向进一步展开研究。

已知:ⅰ.

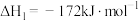
ⅱ.

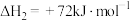
ⅲ.
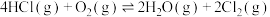
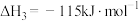
回答下列问题:
(1)

 。
。(2)已知
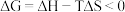 ,反应可自发进行。若
,反应可自发进行。若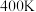 时反应ⅱ中
时反应ⅱ中 ,此时反应ⅱ
,此时反应ⅱ(3)为提高反应ⅱ中氯乙烯的平衡产率,可采取的措施有
a.加入合适的催化剂 b.升高温度 c.增大压强 d.及时氧化

(4)向
 密闭容器中初始投入
密闭容器中初始投入 、
、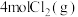 和
和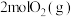 发生乙烯氧氯化反应,不同温度下测得反应在平衡时
发生乙烯氧氯化反应,不同温度下测得反应在平衡时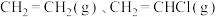 、
、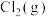 三种组分的体积分数随温度的变化如图1所示。
三种组分的体积分数随温度的变化如图1所示。
②
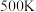 时反应进行到
时反应进行到 达到平衡,
达到平衡, 内用
内用 的浓度变化表示的
的浓度变化表示的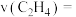

(5)
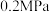 时,控制进料浓度
时,控制进料浓度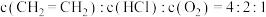 。容器中发生反应
。容器中发生反应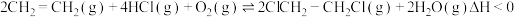 ,不同温度对
,不同温度对 的平衡转化率和催化剂的催化效率的影响如图2所示。(备注:催化效率是指催化剂转化反应物为生成物的能力,通常通过产物的选择性和反应速率来衡量。图2中通过
的平衡转化率和催化剂的催化效率的影响如图2所示。(备注:催化效率是指催化剂转化反应物为生成物的能力,通常通过产物的选择性和反应速率来衡量。图2中通过 转化为
转化为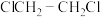 的转化率大小来体现)
的转化率大小来体现)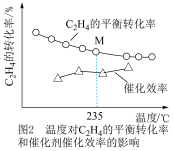
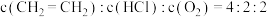 ,所得
,所得 的平衡转化率曲线应在点M的
的平衡转化率曲线应在点M的②因受现有工业设备限制,需保持
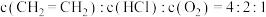 不变,在235℃、
不变,在235℃、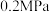 下,若要进一步增大
下,若要进一步增大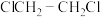 的选择性,可选择从
的选择性,可选择从
您最近一年使用:0次
2021·河南·模拟预测
2 . 环己酮( )作为一种重要的基础化工原料,在各个领域有着广泛用途,作为精细化工的一部分。苯酚(
)作为一种重要的基础化工原料,在各个领域有着广泛用途,作为精细化工的一部分。苯酚( )催化加氢制备环已酮既可实现苯酚的综合利用,又可避免使用氧化剂对环境造成污染,一直受到研究人员的关注。涉及反应如下:
)催化加氢制备环已酮既可实现苯酚的综合利用,又可避免使用氧化剂对环境造成污染,一直受到研究人员的关注。涉及反应如下:
ⅰ.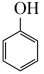 (g)+2H2(g)⇌
(g)+2H2(g)⇌ 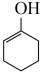 (g)
(g)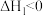 ;
;
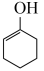
ⅱ.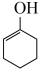 (g)⇌
(g)⇌ 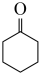 (g)
(g)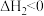 ;
;
ⅲ.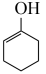 (g)+H2(g)⇌
(g)+H2(g)⇌ 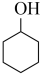 (g)
(g)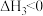 ;
;
ⅳ.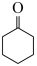 (g)+H2(g)⇌
(g)+H2(g)⇌ 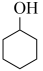 (g)
(g)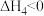 。
。
请回答下列问题:
(1)稳定性: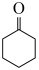
_______  (填“>”“<”或“=”)
(填“>”“<”或“=”)
(2)反应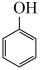 (g)+3H2(g)⇌
(g)+3H2(g)⇌ 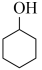 (g)的反应热
(g)的反应热
_______ (用含 、
、 、
、 的代数式表示)。
的代数式表示)。
(3)通过上述反应完成苯酚(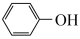 )催化加氢制备环己酮。平衡时,随温度升高,
)催化加氢制备环己酮。平衡时,随温度升高,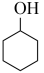 的体积分数变化如图甲所示:
的体积分数变化如图甲所示:
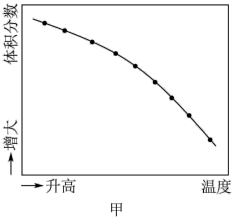
随着温度升高,环己醇的体积分数减小的原因为_______ 。
(4)采用适宜的温度,在容积为1L的恒容密闭容器中,加入1mol苯酚和2mol 只发生反应ⅰ,10min后反应达到平衡状态,测得体系压强是起始压强的0.5倍。
只发生反应ⅰ,10min后反应达到平衡状态,测得体系压强是起始压强的0.5倍。
①达到平衡时1−环己烯醇的平均生成速率v=_______ 。
②该温度下,该反应的平衡常数
_______  ,如果这时向该密闭容器中再充入1mol苯酚和1mol1−环己烯醇,此时v正
,如果这时向该密闭容器中再充入1mol苯酚和1mol1−环己烯醇,此时v正_______ v逆(填“>”“<”或“=”)。
(5)环己酮也可以用环己醇间接电解氧化法制备,其原理如图乙所示:
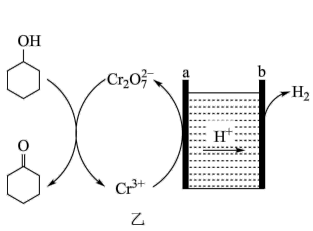
b应接直流电源的_______ (填“负极”或“正极”),a电极的电极反应式为_______ 。
 )作为一种重要的基础化工原料,在各个领域有着广泛用途,作为精细化工的一部分。苯酚(
)作为一种重要的基础化工原料,在各个领域有着广泛用途,作为精细化工的一部分。苯酚( )催化加氢制备环已酮既可实现苯酚的综合利用,又可避免使用氧化剂对环境造成污染,一直受到研究人员的关注。涉及反应如下:
)催化加氢制备环已酮既可实现苯酚的综合利用,又可避免使用氧化剂对环境造成污染,一直受到研究人员的关注。涉及反应如下:ⅰ.
 (g)+2H2(g)⇌
(g)+2H2(g)⇌  (g)
(g)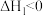 ;
;ⅱ.
 (g)⇌
(g)⇌  (g)
(g)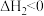 ;
;ⅲ.
 (g)+H2(g)⇌
(g)+H2(g)⇌  (g)
(g)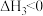 ;
;ⅳ.
 (g)+H2(g)⇌
(g)+H2(g)⇌  (g)
(g)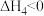 。
。请回答下列问题:
(1)稳定性:

 (填“>”“<”或“=”)
(填“>”“<”或“=”)(2)反应
 (g)+3H2(g)⇌
(g)+3H2(g)⇌  (g)的反应热
(g)的反应热
 、
、 、
、 的代数式表示)。
的代数式表示)。(3)通过上述反应完成苯酚(
 )催化加氢制备环己酮。平衡时,随温度升高,
)催化加氢制备环己酮。平衡时,随温度升高, 的体积分数变化如图甲所示:
的体积分数变化如图甲所示:
随着温度升高,环己醇的体积分数减小的原因为
(4)采用适宜的温度,在容积为1L的恒容密闭容器中,加入1mol苯酚和2mol
 只发生反应ⅰ,10min后反应达到平衡状态,测得体系压强是起始压强的0.5倍。
只发生反应ⅰ,10min后反应达到平衡状态,测得体系压强是起始压强的0.5倍。①达到平衡时1−环己烯醇的平均生成速率v=
②该温度下,该反应的平衡常数

 ,如果这时向该密闭容器中再充入1mol苯酚和1mol1−环己烯醇,此时v正
,如果这时向该密闭容器中再充入1mol苯酚和1mol1−环己烯醇,此时v正(5)环己酮也可以用环己醇间接电解氧化法制备,其原理如图乙所示:

b应接直流电源的
您最近一年使用:0次
2021-12-06更新
|
296次组卷
|
3卷引用:押江苏卷第18题 化学反应原理综合题 -备战2022年高考化学临考题号押题(江苏卷)
(已下线)押江苏卷第18题 化学反应原理综合题 -备战2022年高考化学临考题号押题(江苏卷)河南省部分重点高中2021-2022学年高三上学期12月适应性检测化学试题辽宁省凌源市2021-2022学年高三下学期高三开学考试化学试题
解题方法
3 . 利用氨水吸收烟气中的二氧化硫,其相关反应的主要热化学方程式如下:
SO2(g)+NH3·H2O(aq)=NH4HSO3(aq) △H1=a kJ·mol-1
NH3·H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(aq)+H2O(l) △H2=b kJ·mol-1
2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) △H3=c kJ·mol-1
⑴反应2SO2(g)+4NH3·H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)的 △H=_____ kJ·mol-1。
⑵空气氧化(NH4)2SO3的速率随温度的变化如图所示,当温度超过60℃时,(NH4)2SO3氧化速率下降的原因可能是_______ 。
⑶以磷石膏废渣和碳酸铵为原料制备硫酸铵,不仅解决了环境问题,还使硫资源获得二次利用。反应的离子方程式为CaSO4(s)+CO32—(aq)SO42—(aq)+CaCO3(s),该反应的平衡常数 K=____ 。 [已知Ksp(CaCO3)=2.9×10-9,Ksp(CaSO4)=9.1×10-6 ]
⑷(NH4)2SO4在工农业生产中有多种用途。
①将黄铜精矿(主要成分Cu2S)与硫酸铵混合后在空气中进行焙烧,可转化为硫酸铜同时产生氨气。该反应的化学方程式为________ 。
②研究硫酸铵的分解机理有利于对磷石膏的开发。在500℃下硫酸铵分解过程中得到4种产物,其含氮物质随时间变化关系如图甲所示。写出该条件下硫酸铵分解的化学方程式,并用单线桥标出电子转移的方向及数目:_____________ 。
③(NH4)2SO4是工业制备K2SO4的重要原料。根据图乙中相关物质的溶解度曲线,简述工业上制备K2SO4晶体的设计思路:___________ 。
SO2(g)+NH3·H2O(aq)=NH4HSO3(aq) △H1=a kJ·mol-1
NH3·H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(aq)+H2O(l) △H2=b kJ·mol-1
2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) △H3=c kJ·mol-1
⑴反应2SO2(g)+4NH3·H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)的 △H=
⑵空气氧化(NH4)2SO3的速率随温度的变化如图所示,当温度超过60℃时,(NH4)2SO3氧化速率下降的原因可能是

⑶以磷石膏废渣和碳酸铵为原料制备硫酸铵,不仅解决了环境问题,还使硫资源获得二次利用。反应的离子方程式为CaSO4(s)+CO32—(aq)SO42—(aq)+CaCO3(s),该反应的平衡常数 K=
⑷(NH4)2SO4在工农业生产中有多种用途。
①将黄铜精矿(主要成分Cu2S)与硫酸铵混合后在空气中进行焙烧,可转化为硫酸铜同时产生氨气。该反应的化学方程式为

②研究硫酸铵的分解机理有利于对磷石膏的开发。在500℃下硫酸铵分解过程中得到4种产物,其含氮物质随时间变化关系如图甲所示。写出该条件下硫酸铵分解的化学方程式,并用单线桥标出电子转移的方向及数目:
③(NH4)2SO4是工业制备K2SO4的重要原料。根据图乙中相关物质的溶解度曲线,简述工业上制备K2SO4晶体的设计思路:
您最近一年使用:0次
2017-03-28更新
|
156次组卷
|
3卷引用:2017届江苏省南通市高三高考全真模拟(五)化学 试卷



