名校
解题方法
1 . “碳达峰”“碳中和”是推动我国经济社会高质量发展的内在要求。通过二氧化碳催化加氢合成二甲醚是一种重要的转化方法,其过程如下:
反应I: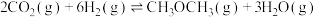
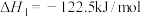
反应II:

回答下列问题:
(1)反应 的
的
___________ 。
(2)二氧化碳与氢气合成 时,通常控制温度为500℃左右,其可能的原因为___________(填字母)。
时,通常控制温度为500℃左右,其可能的原因为___________(填字母)。
(3)在1L恒温密闭容器中充入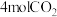 和
和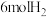 ,初始压强为p,20min时反应I、II都达到平衡状态,体系压强为0.8p,测得
,初始压强为p,20min时反应I、II都达到平衡状态,体系压强为0.8p,测得 。
。
①0~20min内
___________ 。
②反应II的化学平衡常数
___________ 。
③平衡时 的选择性=
的选择性=___________ 。( 的选择性
的选择性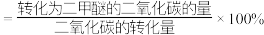 )
)
(4)在密闭容器中通入 和
和 ,在铁系催化剂作用下进行反应,
,在铁系催化剂作用下进行反应, 的平衡转化率随温度和压强的变化如图所示。图中,温度大于800℃时,随着压强的增大,
的平衡转化率随温度和压强的变化如图所示。图中,温度大于800℃时,随着压强的增大, 的平衡转化率减小,请解释原因:
的平衡转化率减小,请解释原因:___________ 。

(5)为实现“碳中和”,还可通过电解法用 制备
制备 ,电解装置如图所示。
,电解装置如图所示。

①铂电极的电极反应式为___________ 。
②当玻碳电极收集到标况下22.4L气体时,阴极区的质量变化为___________ 。
反应I:
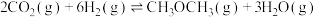
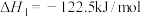
反应II:


回答下列问题:
(1)反应
 的
的
(2)二氧化碳与氢气合成
 时,通常控制温度为500℃左右,其可能的原因为___________(填字母)。
时,通常控制温度为500℃左右,其可能的原因为___________(填字母)。| A.反应速率快 | B.平衡的转化率高 |
| C.催化剂活性高 | D.主反应催化剂选择性好 |
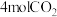 和
和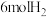 ,初始压强为p,20min时反应I、II都达到平衡状态,体系压强为0.8p,测得
,初始压强为p,20min时反应I、II都达到平衡状态,体系压强为0.8p,测得 。
。①0~20min内

②反应II的化学平衡常数

③平衡时
 的选择性=
的选择性= 的选择性
的选择性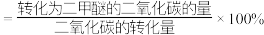 )
)(4)在密闭容器中通入
 和
和 ,在铁系催化剂作用下进行反应,
,在铁系催化剂作用下进行反应, 的平衡转化率随温度和压强的变化如图所示。图中,温度大于800℃时,随着压强的增大,
的平衡转化率随温度和压强的变化如图所示。图中,温度大于800℃时,随着压强的增大, 的平衡转化率减小,请解释原因:
的平衡转化率减小,请解释原因:
(5)为实现“碳中和”,还可通过电解法用
 制备
制备 ,电解装置如图所示。
,电解装置如图所示。
①铂电极的电极反应式为
②当玻碳电极收集到标况下22.4L气体时,阴极区的质量变化为
您最近一年使用:0次
2023-11-27更新
|
793次组卷
|
3卷引用:重庆市第八中学2024届高三上学期高考适应性月考卷(三)化学试题
2 . 2023年1月,重庆市经济和信息化委员会、重庆市发展和改革委员会、重庆市生态环境局联合印发了《重庆市工业领域碳达峰实施方案》,提出了21项重点工作举措,为实现碳达峰奠定了坚实基础。由 制备甲醇、甲醛、甲酸等,实现
制备甲醇、甲醛、甲酸等,实现 的资源化利用已成为重要课题。回答下列问题:
的资源化利用已成为重要课题。回答下列问题:
(1)常温常压下,甲醛为气态,而甲酸为液态,其原因是___________ 。
(2)科研团队通过多种途径实现了 合成甲醛,总反应为
合成甲醛,总反应为

已知:
反应Ⅰ:

反应Ⅱ:

反应Ⅲ:

反应Ⅳ: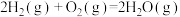

①
___________ 。
②向一恒温恒容容器中充入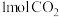 和
和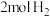 只发生反应Ⅰ,若起始时容器内压强为1.2kPa,反应经3min达到平衡,平衡时
只发生反应Ⅰ,若起始时容器内压强为1.2kPa,反应经3min达到平衡,平衡时 的分压为0.24kPa,则这段时间内的平均反应速率
的分压为0.24kPa,则这段时间内的平均反应速率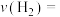
___________ kPa/min。平衡后,再向容器内通入 和
和 ,使二者分压均增大0.05kPa,
,使二者分压均增大0.05kPa, 的转化率将
的转化率将___________ (填“增大”“减小”或“不变”)。
③若在某恒温恒容容器中充入 和
和 只发生反应Ⅱ,下列说法正确的是
只发生反应Ⅱ,下列说法正确的是___________ (填序号)。
A.反应Ⅱ在高温下可以自发进行
B.若混合气体的平均密度不再改变,说明反应Ⅱ已经达到平衡
C.反应任意时刻均存在
D.增大 浓度,
浓度,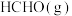 的平衡物质的量分数一定增大
的平衡物质的量分数一定增大
(3)我国科研团队设计了一种表面锂掺杂的锡纳米粒子催化剂s-SnLi用于 制备甲酸。在不使用催化剂和使用s-SnLi催化剂两种反应路径下由
制备甲酸。在不使用催化剂和使用s-SnLi催化剂两种反应路径下由 制备甲酸,各反应物、中间体、产物(其中CO为副产物)的相对能量如图甲所示,据图分析,便用s-SnLi化剂除了能加快制备甲酸反应的速率,还具有的作用是
制备甲酸,各反应物、中间体、产物(其中CO为副产物)的相对能量如图甲所示,据图分析,便用s-SnLi化剂除了能加快制备甲酸反应的速率,还具有的作用是___________ 。


(4)基于催化剂s-SnLi的 电催化制备甲酸盐同时释放电能的装置如图乙所示,该电池放电时,正极的电极方程式为
电催化制备甲酸盐同时释放电能的装置如图乙所示,该电池放电时,正极的电极方程式为___________ 。若电池工作tmin,维持电流强度为IA,理论上消耗 的质量为
的质量为___________ (已知1mol电子所带电荷量为FC,用含I、t、F的代数式表示)。
 制备甲醇、甲醛、甲酸等,实现
制备甲醇、甲醛、甲酸等,实现 的资源化利用已成为重要课题。回答下列问题:
的资源化利用已成为重要课题。回答下列问题:(1)常温常压下,甲醛为气态,而甲酸为液态,其原因是
(2)科研团队通过多种途径实现了
 合成甲醛,总反应为
合成甲醛,总反应为

已知:
反应Ⅰ:


反应Ⅱ:


反应Ⅲ:


反应Ⅳ:
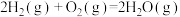

①

②向一恒温恒容容器中充入
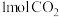 和
和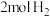 只发生反应Ⅰ,若起始时容器内压强为1.2kPa,反应经3min达到平衡,平衡时
只发生反应Ⅰ,若起始时容器内压强为1.2kPa,反应经3min达到平衡,平衡时 的分压为0.24kPa,则这段时间内的平均反应速率
的分压为0.24kPa,则这段时间内的平均反应速率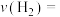
 和
和 ,使二者分压均增大0.05kPa,
,使二者分压均增大0.05kPa, 的转化率将
的转化率将③若在某恒温恒容容器中充入
 和
和 只发生反应Ⅱ,下列说法正确的是
只发生反应Ⅱ,下列说法正确的是A.反应Ⅱ在高温下可以自发进行
B.若混合气体的平均密度不再改变,说明反应Ⅱ已经达到平衡
C.反应任意时刻均存在

D.增大
 浓度,
浓度,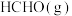 的平衡物质的量分数一定增大
的平衡物质的量分数一定增大(3)我国科研团队设计了一种表面锂掺杂的锡纳米粒子催化剂s-SnLi用于
 制备甲酸。在不使用催化剂和使用s-SnLi催化剂两种反应路径下由
制备甲酸。在不使用催化剂和使用s-SnLi催化剂两种反应路径下由 制备甲酸,各反应物、中间体、产物(其中CO为副产物)的相对能量如图甲所示,据图分析,便用s-SnLi化剂除了能加快制备甲酸反应的速率,还具有的作用是
制备甲酸,各反应物、中间体、产物(其中CO为副产物)的相对能量如图甲所示,据图分析,便用s-SnLi化剂除了能加快制备甲酸反应的速率,还具有的作用是

(4)基于催化剂s-SnLi的
 电催化制备甲酸盐同时释放电能的装置如图乙所示,该电池放电时,正极的电极方程式为
电催化制备甲酸盐同时释放电能的装置如图乙所示,该电池放电时,正极的电极方程式为 的质量为
的质量为
您最近一年使用:0次
2023-05-14更新
|
168次组卷
|
2卷引用:重庆市第八中学校2023届高三下学期适应性月考(八)化学试题
3 . 我国在应对气候变化工作中取得显著成效,并向国际社会承诺2030年实现“碳达峰”,2060年实现“碳
中和”。因此将CO2转化为高附加值化学品成为科学家研究的重要课题。异丁烯[CH2=C(CH3)2]作为汽油添加剂的主要成分,可利用异丁烷与CO2反应来制备。
反应I:CH3CH(CH3)CH3(g)+CO2(g) CH2=C(CH3)2(g)+H2O(g)+CO(g) △H1=+165.2kJ·mol-1
CH2=C(CH3)2(g)+H2O(g)+CO(g) △H1=+165.2kJ·mol-1
反应II:CH3CH(CH3)CH3(g) CH2=C(CH3)2(g)+H2(g) △H2
CH2=C(CH3)2(g)+H2(g) △H2
回答下列问题:
(1)已知:CO(g)+H2O(g) CO2(g)+H2(g) △H=-41.2kJ·mol-1,则△H2=
CO2(g)+H2(g) △H=-41.2kJ·mol-1,则△H2=_______ 。
(2)向1.0L恒容密闭容器中加入1molCH3CH(CH3)CH3(g)和1molCO2(g),利用反应I制备异丁烯。已知正反应速率可表示为v正=k正c[CH3CH(CH3)CH3]·c(CO2),逆反应速率可表示为,v逆=k逆c[CH2=c(CH3)2]·c(H2O)·c(CO),其中k正、K逆为速率常数。
①图中能够代表k逆的曲线为_______ (填“L1”“L2”“L3”或“L4”)。
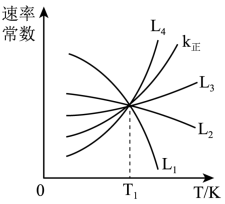
②温度为T1时,该反应的化学平衡常数K=_______ ,平衡时,CH3CH(CH3)CH3的转化率_______ 50%(填“以>”、“=”、“<”)。
(3)CH4-CO2重整技术是实现“碳中和”的一种理想的CO2利用技术,反应为:CO2(g)+CH4(g) 2CO(g)+2H2(g)。在pMPa时,将CO2和CH4按物质的量之比为1:1充入密闭容器中,分别在无催化剂及ZrO2催化下反应相同时间,测得CO2的转化率与温度的关系如图所示:
2CO(g)+2H2(g)。在pMPa时,将CO2和CH4按物质的量之比为1:1充入密闭容器中,分别在无催化剂及ZrO2催化下反应相同时间,测得CO2的转化率与温度的关系如图所示:
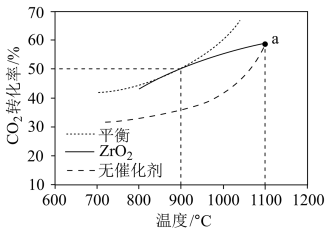
①a点CO2转化率相等的原因是_______ 。
②在pMPa、900°C、ZrO2催化条件下,将CO2、CH4、H2O按物质的量之比为1:1:n充入密闭容器,CO2的平衡转化率为α,此时平衡常数Kp=_______ (以分压表示,分压=总压×物质的量分数;写出含α、n、p的计算表达式)。
(4)利用电化学可以将CO2有效转化为HCOO-,装置如图所示。

①在该装置中,左侧Pt电极上的电极反应式:_______ 。
②装置工作时,阴极除有HCOO-生成外,还可能生成副产物降低电解效率。阴极生成的副产物可能是_______ ,标准状况下,当阳极生成O2的体积为224mL时,测得阴极区内的c(HCOO-)=0.015mol/L,则电解效率_______ 。(忽略电解前后溶液体积的变化)已知:电解效率=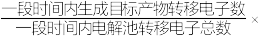 100%。
100%。
中和”。因此将CO2转化为高附加值化学品成为科学家研究的重要课题。异丁烯[CH2=C(CH3)2]作为汽油添加剂的主要成分,可利用异丁烷与CO2反应来制备。
反应I:CH3CH(CH3)CH3(g)+CO2(g)
 CH2=C(CH3)2(g)+H2O(g)+CO(g) △H1=+165.2kJ·mol-1
CH2=C(CH3)2(g)+H2O(g)+CO(g) △H1=+165.2kJ·mol-1反应II:CH3CH(CH3)CH3(g)
 CH2=C(CH3)2(g)+H2(g) △H2
CH2=C(CH3)2(g)+H2(g) △H2回答下列问题:
(1)已知:CO(g)+H2O(g)
 CO2(g)+H2(g) △H=-41.2kJ·mol-1,则△H2=
CO2(g)+H2(g) △H=-41.2kJ·mol-1,则△H2=(2)向1.0L恒容密闭容器中加入1molCH3CH(CH3)CH3(g)和1molCO2(g),利用反应I制备异丁烯。已知正反应速率可表示为v正=k正c[CH3CH(CH3)CH3]·c(CO2),逆反应速率可表示为,v逆=k逆c[CH2=c(CH3)2]·c(H2O)·c(CO),其中k正、K逆为速率常数。
①图中能够代表k逆的曲线为

②温度为T1时,该反应的化学平衡常数K=
(3)CH4-CO2重整技术是实现“碳中和”的一种理想的CO2利用技术,反应为:CO2(g)+CH4(g)
 2CO(g)+2H2(g)。在pMPa时,将CO2和CH4按物质的量之比为1:1充入密闭容器中,分别在无催化剂及ZrO2催化下反应相同时间,测得CO2的转化率与温度的关系如图所示:
2CO(g)+2H2(g)。在pMPa时,将CO2和CH4按物质的量之比为1:1充入密闭容器中,分别在无催化剂及ZrO2催化下反应相同时间,测得CO2的转化率与温度的关系如图所示:
①a点CO2转化率相等的原因是
②在pMPa、900°C、ZrO2催化条件下,将CO2、CH4、H2O按物质的量之比为1:1:n充入密闭容器,CO2的平衡转化率为α,此时平衡常数Kp=
(4)利用电化学可以将CO2有效转化为HCOO-,装置如图所示。

①在该装置中,左侧Pt电极上的电极反应式:
②装置工作时,阴极除有HCOO-生成外,还可能生成副产物降低电解效率。阴极生成的副产物可能是
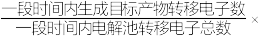 100%。
100%。
您最近一年使用:0次
2022-08-19更新
|
354次组卷
|
2卷引用:重庆缙云教育联盟2023届高三二模考试化学试题



