名校
1 . 下列图示与对应的叙述相符的是
| A | B | C | D |
 | 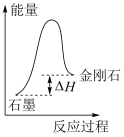 |  |  |
| 探究反应物的接触面积对反应速率的影响 | 从能量角度考虑,石墨比金刚石稳定 | 反应开始后,注射器活塞向右移动,该反应为放热反应 | 某放热反应分别在有、无催化剂的情况下的能量变化 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-11-12更新
|
441次组卷
|
9卷引用:福建省龙岩市六县一中2021-2022学年高二上学期期中联考化学试题
福建省龙岩市六县一中2021-2022学年高二上学期期中联考化学试题福建省武平县第一中学2021-2022学年高二上学期期中考试化学试题河北省邯郸市八校联盟(永年一中、大化一中等)2021-2022学年高二上学期期中考试化学试题贵州省毕节市金沙县2021-2022学年高二上学期期期中化学试题福建省长汀县第一中学2022-2023学年高二上学期第一次月考化学试题云南省昆明市第一中学2021-2022学年高二下学期期中考试化学试题云南省楚雄天人中学2022-2023学年高二上学期九月月考化学试题广东省惠州市丰湖高级中学2022-2023学年高二上学期期中考试化学试题广东省深圳市南山为明学校2023-2024学年高二上学期期中考试化学试题
名校
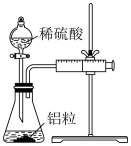
2 . 某同学设计如图所示实验,探究反应中的能量变化。
下列判断正确的是

下列判断正确的是
| A.由实验可知,(a)、(b)、(c)所涉及的反应都是放热反应 |
| B.若用NaOH固体测定中和热,则测定中和热的数值偏高 |
| C.实验(c)中将环形玻璃搅拌棒改为铁质搅拌棒对实验结果没有影响 |
| D.将实验(a)中的铝片更换为等质量的铝粉后释放出的热量有所增加 |
您最近一年使用:0次
2021-11-12更新
|
118次组卷
|
4卷引用:福建省三明市四地四校2021-2022学年高二上学期期中联考协作卷化学试题
名校
解题方法
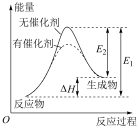
3 . 二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。二氧化碳加氢制甲醇的总反应可表示为: CO2(g)+3H2(g)=CH3OH(g)+H2O(g)。该反应一般认为通过如下步骤来实现:
①CO2(g)+H2(g)=CO(g)+H2O(g)
②CO(g)+2H2(g)=CH3OH(g)
其能量曲线如下图所示,下列有关说法错误的是
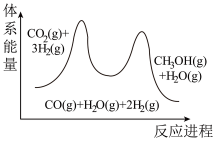
①CO2(g)+H2(g)=CO(g)+H2O(g)
②CO(g)+2H2(g)=CH3OH(g)
其能量曲线如下图所示,下列有关说法错误的是

| A.反应①为吸热反应,反应②为放热反应 |
| B.决定该总反应速率的是反应① |
| C.CO是该总反应的催化剂 |
| D.该总反应用于工业生产,能促进碳中和 |
您最近一年使用:0次
2021-11-10更新
|
196次组卷
|
3卷引用:福建省南安市侨光中学、昌财实验中学2021-2022学年高二上学期第二次阶段考化学试题
名校
4 . 对于反应2SO2(g)+O2(g)⇌2SO3(g)ΔH=-196.6kJ·mol-1,能量变化如图所示。下列说法中正确的是


| A.2SO2(g)+O2(g)⇌2SO3(l)ΔH>-196.6kJ·mol-1 |
| B.恒温恒容条件下充入稀有气体,平衡向正方向移动 |
| C.增大氧气浓度,平衡向正方向移动,平衡常数K增大 |
| D.过程II可能使用了催化剂 |
您最近一年使用:0次
5 . 已知H2(g)+ O2(g)=H2O(g),反应过程中能量变化如下图,问:
O2(g)=H2O(g),反应过程中能量变化如下图,问:
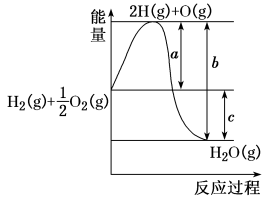
(1)a、b、c分别代表什么意义?
a_______ ;
b_______ ;
c_______ 。
(2)该反应是放热反应还是吸热反应?_______ 。
(3)若已知2H2(g)+O2(g)=2H2O(g) ΔH1=-Q1
2H2(g)+O2(g)=2H2O(l) ΔH2=-Q2
则ΔH1_______ ΔH2,Q1_______ Q2(填“>”、“<”或“=”)。
 O2(g)=H2O(g),反应过程中能量变化如下图,问:
O2(g)=H2O(g),反应过程中能量变化如下图,问:
(1)a、b、c分别代表什么意义?
a
b
c
(2)该反应是放热反应还是吸热反应?
(3)若已知2H2(g)+O2(g)=2H2O(g) ΔH1=-Q1
2H2(g)+O2(g)=2H2O(l) ΔH2=-Q2
则ΔH1
您最近一年使用:0次
名校
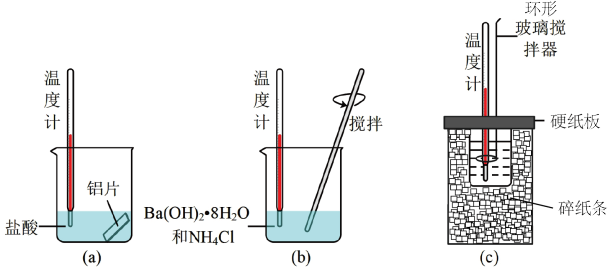
6 . 化学反应过程伴随有热量的变化。
(1)下列过程中属于放热反应的有___________ 。
①燃烧木炭取暖②C与H2O(g)反应制取水煤气③煅烧石灰石(主要成分是CaCO3)制生石灰④氯化铵晶体和Ba(OH)2·8H2O混合搅拌⑤金属腐蚀⑥浓硫酸稀释
(2)一定条件下,由稳定单质反应生成1mol化合物的反应热叫该化合物的生成热(ΔH)。图为VIA族元素(O、S、Se、Te)氢化物a、b、c、d的生成热数据示意图。
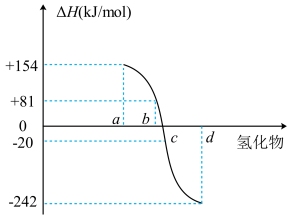
①非金属元素氢化物的稳定性与氢化物的生成热ΔH的关系为___________ 。
②硫化氢发生分解反应的热化学方程式为___________ 。
(3)利用CH4可制备乙烯及合成气(CO、H2)。有关化学键键能(E)的数据如表:
①已知2CH4(g)=CH2=CH2(g)+2H2(g) ΔH=+167kJ/mol,则a=___________ 。
②已知5C2H4(g)+12MnO (aq)+36H+(aq)=12Mn2+(aq)+10CO2(g)+28H2O(l) ΔH=-mkJ·mol-1,当放出的热量为nkJ时,该反应转移的电子数为
(aq)+36H+(aq)=12Mn2+(aq)+10CO2(g)+28H2O(l) ΔH=-mkJ·mol-1,当放出的热量为nkJ时,该反应转移的电子数为___________ 。(用含m、n的代数式表示)
③制备合成气反应历程分两步(步骤I、步骤II),反应中C(ads)为吸附性活性炭,反应历程的能量变化如图:
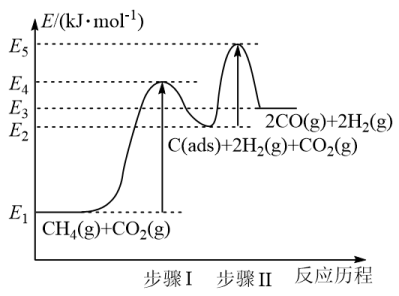
步骤I反应的焓变ΔH1为___________ kJ/mol(选用E1~E5的关系式表示)
④反应CH4(g)+CO2(g)=2CO(g)+2H2(g)的焓变为ΔH2,与步骤Ⅰ反应的焓变ΔH1相比,ΔH1___________ ΔH2(填“>”或“<”)
(1)下列过程中属于放热反应的有
①燃烧木炭取暖②C与H2O(g)反应制取水煤气③煅烧石灰石(主要成分是CaCO3)制生石灰④氯化铵晶体和Ba(OH)2·8H2O混合搅拌⑤金属腐蚀⑥浓硫酸稀释
(2)一定条件下,由稳定单质反应生成1mol化合物的反应热叫该化合物的生成热(ΔH)。图为VIA族元素(O、S、Se、Te)氢化物a、b、c、d的生成热数据示意图。

①非金属元素氢化物的稳定性与氢化物的生成热ΔH的关系为
②硫化氢发生分解反应的热化学方程式为
(3)利用CH4可制备乙烯及合成气(CO、H2)。有关化学键键能(E)的数据如表:
| 化学键 | H-H | C=C | C-C | C-H |
| E(kJ/mol) | 436 | a | 348 | 413 |
②已知5C2H4(g)+12MnO
 (aq)+36H+(aq)=12Mn2+(aq)+10CO2(g)+28H2O(l) ΔH=-mkJ·mol-1,当放出的热量为nkJ时,该反应转移的电子数为
(aq)+36H+(aq)=12Mn2+(aq)+10CO2(g)+28H2O(l) ΔH=-mkJ·mol-1,当放出的热量为nkJ时,该反应转移的电子数为③制备合成气反应历程分两步(步骤I、步骤II),反应中C(ads)为吸附性活性炭,反应历程的能量变化如图:

步骤I反应的焓变ΔH1为
④反应CH4(g)+CO2(g)=2CO(g)+2H2(g)的焓变为ΔH2,与步骤Ⅰ反应的焓变ΔH1相比,ΔH1
您最近一年使用:0次
7 . 下列各组热化学方程式中,化学反应的 前者大于后者的是
前者大于后者的是
①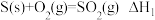 ;
;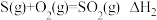
②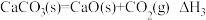
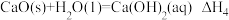
 前者大于后者的是
前者大于后者的是①
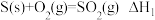 ;
;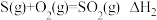
②
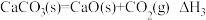
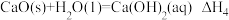
| A.①② | B.仅① | C.仅② | D.①②都是后者的 大 大 |
您最近一年使用:0次
名校
解题方法
8 . 自嗨锅的发热包主要成分有:硅藻土、铁粉、铝粉、焦炭粉、盐、生石灰,使用时使发热包里面的物质与水接触即可。下列说法错误的是
| A.硅藻土可增大反应物的接触面积 |
| B.主要反应物为生石灰,与水反应放热 |
| C.铁粉发生析氢腐蚀,缓慢放出热量,延长放热时间 |
| D.焦炭粉的作用是做正极材料 |
您最近一年使用:0次
9 . 回答下列问题
Ⅰ.在高温、高压、催化剂作用下,1mol石墨转化为金刚石,吸收1.9 kJ的热量。
(1)该反应的∆H_______ 0(填“大于”或“小于”)。
(2)对于石墨和金刚石,_______ 更稳定。
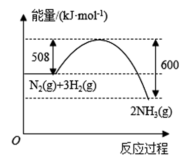
(3)N2(g)和H2(g)反应生成NH3(g)的过程中能量的变化示意图如图所示,说明每生成1mol NH3(g)_______ (填“吸收”或“放出”)的能量是_______ kJ。
Ⅱ.完成下列反应的热化学方程式。
(4)沼气是一种能源,它的主要成分是CH4,常温下,0.5 mol CH4完全燃烧生成CO2(g)和液态水时,放出445 kJ热量,则热化学方程式为_______ 。
(5)已知H2S完全燃烧生成SO2(g)和H2O(l),H2S的燃烧热为a kJ·mol-1,写出H2S的燃烧热的热化学方程式_______ 。
(6)SF6是一种优良的绝缘气体,分子结构中,只存在S-F键,已知1 mol S(s)转化为气态硫原子吸收能量280kJ,F-F键能为160 kJ·mol-1,S-F键能为330 kJ·mol-1,试写出S(s)和F2(g)反应生成SF6(g)的热化学方程式_______ 。
Ⅰ.在高温、高压、催化剂作用下,1mol石墨转化为金刚石,吸收1.9 kJ的热量。

(1)该反应的∆H
(2)对于石墨和金刚石,
(3)N2(g)和H2(g)反应生成NH3(g)的过程中能量的变化示意图如图所示,说明每生成1mol NH3(g)
Ⅱ.完成下列反应的热化学方程式。
(4)沼气是一种能源,它的主要成分是CH4,常温下,0.5 mol CH4完全燃烧生成CO2(g)和液态水时,放出445 kJ热量,则热化学方程式为
(5)已知H2S完全燃烧生成SO2(g)和H2O(l),H2S的燃烧热为a kJ·mol-1,写出H2S的燃烧热的热化学方程式
(6)SF6是一种优良的绝缘气体,分子结构中,只存在S-F键,已知1 mol S(s)转化为气态硫原子吸收能量280kJ,F-F键能为160 kJ·mol-1,S-F键能为330 kJ·mol-1,试写出S(s)和F2(g)反应生成SF6(g)的热化学方程式
您最近一年使用:0次
10 . 下列各组热化学方程式中,化学反应的∆H前者小于后者的有
① ∆H1
∆H1 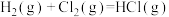 ∆H2
∆H2
②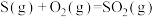 ∆H3
∆H3 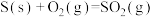 ∆H4
∆H4
③ ∆H5
∆H5  ∆H6
∆H6
④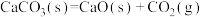 ∆H7
∆H7 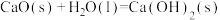 ∆H8
∆H8
⑤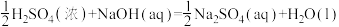 ∆H9
∆H9 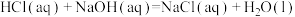 ∆H10
∆H10
⑥ ∆H11
∆H11  ∆H12
∆H12
①
 ∆H1
∆H1 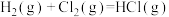 ∆H2
∆H2②
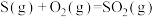 ∆H3
∆H3 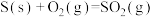 ∆H4
∆H4③
 ∆H5
∆H5  ∆H6
∆H6④
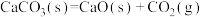 ∆H7
∆H7 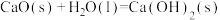 ∆H8
∆H8⑤
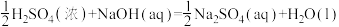 ∆H9
∆H9 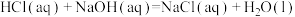 ∆H10
∆H10⑥
 ∆H11
∆H11  ∆H12
∆H12| A.2项 | B.3项 | C.4项 | D.5项 |
您最近一年使用:0次



