名校
解题方法
1 . 回收利用含硫烟气有利于节约资源、保护环境。
I.含H2S的烟气回收
(1)将一部分含H2S的烟气在空气中燃烧,将燃烧所得产物与剩余烟气混合,冷却后可回收得到硫磺(S8)。该工艺中涉及反应如下:
反应1: ;
;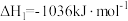
反应2: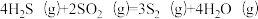 ;
;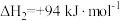
反应3: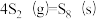 ;
;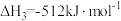
①反应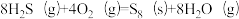 的△H=
的△H=_______ kJ∙mol-1。
②相同条件下需控制反应1与反应2中的烟气体积比为1:2的原因是_______ 。
Ⅱ.含SO2的烟气回收
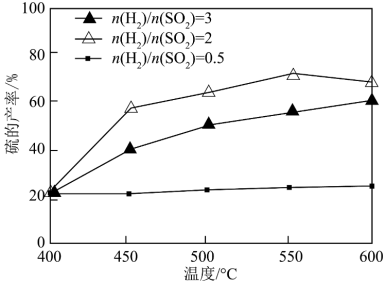
(2)以FeS2/Al2O3为催化剂,用H2还原SO2制S。
其他条件一定,改变起始时H2与SO2的比例,反应相同时间,测得S的产率随温度的变化关系如图所示。500℃,n(H2)/n(SO2)=3时硫的产率比n(H2)/n(SO2)=2时小的原因可能是_______ 。
(3)以V2O5/炭基材料为催化剂,SO2在炭表面被氧气催化氧化为SO3,SO3再转化为硫酸盐等。
①V2O5/炭基材料脱硫涉及反应: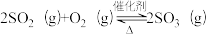 ,下列关于该反应的说法正确的是
,下列关于该反应的说法正确的是_______ (填字母序号)。
a.通入过量空气,可提高SO2的平衡转化率
b.当n(SO2):n(SO3)=l:1时,可判断反应达到平衡
c.使SO3液化从平衡体系中分离,能加快正反应速率,增大SO2转化率
②450℃、在V2O5催化下,SO2和O2的反应过程是按照如下两步完成的:
反应I:_______(快反应)
反应Ⅱ: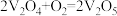 (慢反应)
(慢反应)
请补充上述反应的化学方程式_______ ,决定总反应速率快慢的是反应_______ (填“I”或“Ⅱ”)。
Ⅲ.工业上可采取多种方法减少SO2的排放,回答下列方法中的问题。
(4)方法1(双碱法):用NaOH溶液吸收SO2,并用CaO使NaOH再生NaOH溶液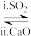 Na2SO3溶液
Na2SO3溶液
①写出过程i的离子方程式:_______ 。
②CaO在水中存在如下转化: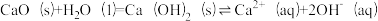
从平衡移动的角度,简述过程i中NaOH再生的原理:_______ 。
方法2:用氨水除去SO2
③已知25℃,NH3·H2O的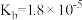 ,H2SO3的
,H2SO3的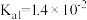 ,
,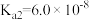 。若氨水的浓度为2.0mol∙L-1,溶液中的c(OH-)=
。若氨水的浓度为2.0mol∙L-1,溶液中的c(OH-)=_______ mol∙L-1。将SO2通入该氨水中,当c(OH-)降至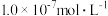 时,溶液中的
时,溶液中的
_______ 。
I.含H2S的烟气回收
(1)将一部分含H2S的烟气在空气中燃烧,将燃烧所得产物与剩余烟气混合,冷却后可回收得到硫磺(S8)。该工艺中涉及反应如下:
反应1:
 ;
;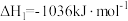
反应2:
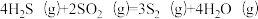 ;
;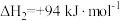
反应3:
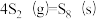 ;
;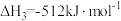
①反应
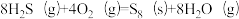 的△H=
的△H=②相同条件下需控制反应1与反应2中的烟气体积比为1:2的原因是
Ⅱ.含SO2的烟气回收
(2)以FeS2/Al2O3为催化剂,用H2还原SO2制S。
其他条件一定,改变起始时H2与SO2的比例,反应相同时间,测得S的产率随温度的变化关系如图所示。500℃,n(H2)/n(SO2)=3时硫的产率比n(H2)/n(SO2)=2时小的原因可能是

(3)以V2O5/炭基材料为催化剂,SO2在炭表面被氧气催化氧化为SO3,SO3再转化为硫酸盐等。
①V2O5/炭基材料脱硫涉及反应:
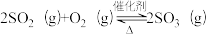 ,下列关于该反应的说法正确的是
,下列关于该反应的说法正确的是a.通入过量空气,可提高SO2的平衡转化率
b.当n(SO2):n(SO3)=l:1时,可判断反应达到平衡
c.使SO3液化从平衡体系中分离,能加快正反应速率,增大SO2转化率
②450℃、在V2O5催化下,SO2和O2的反应过程是按照如下两步完成的:
反应I:_______(快反应)
反应Ⅱ:
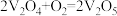 (慢反应)
(慢反应)请补充上述反应的化学方程式
Ⅲ.工业上可采取多种方法减少SO2的排放,回答下列方法中的问题。
(4)方法1(双碱法):用NaOH溶液吸收SO2,并用CaO使NaOH再生NaOH溶液
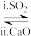 Na2SO3溶液
Na2SO3溶液①写出过程i的离子方程式:
②CaO在水中存在如下转化:
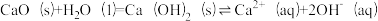
从平衡移动的角度,简述过程i中NaOH再生的原理:
方法2:用氨水除去SO2
③已知25℃,NH3·H2O的
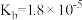 ,H2SO3的
,H2SO3的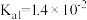 ,
,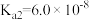 。若氨水的浓度为2.0mol∙L-1,溶液中的c(OH-)=
。若氨水的浓度为2.0mol∙L-1,溶液中的c(OH-)=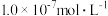 时,溶液中的
时,溶液中的
您最近一年使用:0次
名校
解题方法
2 . 乙烯是重要的工业原材料,中科院设计并完成了 催化氧化
催化氧化 制取
制取 的新路径,
的新路径,
其主要反应为:反应Ⅰ: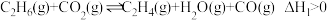
反应Ⅱ: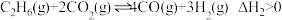
一定条件下,向容积为 的容器中通入
的容器中通入 和
和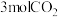 ,若仅考虑上述反应,
,若仅考虑上述反应, 平衡转化率和平衡时
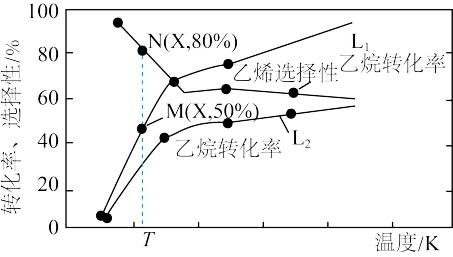
平衡转化率和平衡时 的选择性随温度、压强的关系如图所示,
的选择性随温度、压强的关系如图所示, 代表不同压强下乙烷的平衡转化率。
代表不同压强下乙烷的平衡转化率。
已知:
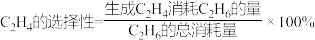
下列说法正确的是
 催化氧化
催化氧化 制取
制取 的新路径,
的新路径,其主要反应为:反应Ⅰ:
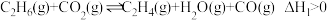
反应Ⅱ:
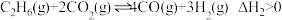
一定条件下,向容积为
 的容器中通入
的容器中通入 和
和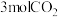 ,若仅考虑上述反应,
,若仅考虑上述反应, 平衡转化率和平衡时
平衡转化率和平衡时 的选择性随温度、压强的关系如图所示,
的选择性随温度、压强的关系如图所示,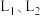 代表不同压强下乙烷的平衡转化率。
代表不同压强下乙烷的平衡转化率。
已知:
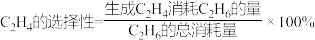
下列说法正确的是
A.压强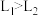 |
B.压强为 、温度为T时,反应达平衡时,混合气体中 、温度为T时,反应达平衡时,混合气体中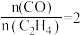 |
C.一定温度下,增大 可提高 可提高 的平衡转化率 的平衡转化率 |
D.反应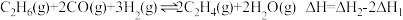 |
您最近一年使用:0次
2022-11-10更新
|
853次组卷
|
5卷引用:江苏省无锡市第一中学2023-2024学年高三上学期10月份质量检测化学试题
名校
解题方法
3 . 甲醇是一种可再生能源,具有开发和应用的广阔前景。
(1)①已知 、
、 的燃烧热分别为
的燃烧热分别为 ,
, 。
。
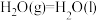

则 的
的
_______  。
。
② 与
与 合成甲醇过程中,会发生副反应:
合成甲醇过程中,会发生副反应:
 ,为减少副反应的发生,同时不降低
,为减少副反应的发生,同时不降低 生成
生成 的反应速率和平衡转化率,可采取的措施是
的反应速率和平衡转化率,可采取的措施是_______ 。
(2)科学家以 为催化剂,液相催化氧化甲烷生成硫酸单甲酯,再经水解得到甲醇,反应机理如图甲所示。图甲所示工艺总反应的化学方程式为
为催化剂,液相催化氧化甲烷生成硫酸单甲酯,再经水解得到甲醇,反应机理如图甲所示。图甲所示工艺总反应的化学方程式为_______ 。


(3)用如图乙所示的电解装置可制得甲醇等。
①阳极区发生的电极反应式为_______ 。
②请解释阴极区NaOH浓度增大的原因_______ 。
(1)①已知
 、
、 的燃烧热分别为
的燃烧热分别为 ,
, 。
。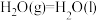

则
 的
的
 。
。②
 与
与 合成甲醇过程中,会发生副反应:
合成甲醇过程中,会发生副反应:
 ,为减少副反应的发生,同时不降低
,为减少副反应的发生,同时不降低 生成
生成 的反应速率和平衡转化率,可采取的措施是
的反应速率和平衡转化率,可采取的措施是(2)科学家以
 为催化剂,液相催化氧化甲烷生成硫酸单甲酯,再经水解得到甲醇,反应机理如图甲所示。图甲所示工艺总反应的化学方程式为
为催化剂,液相催化氧化甲烷生成硫酸单甲酯,再经水解得到甲醇,反应机理如图甲所示。图甲所示工艺总反应的化学方程式为

(3)用如图乙所示的电解装置可制得甲醇等。
①阳极区发生的电极反应式为
②请解释阴极区NaOH浓度增大的原因
您最近一年使用:0次
2021-01-19更新
|
259次组卷
|
2卷引用:江苏省江阴市第一中学2021届高三12月份阶段性检测化学试题



