名校
解题方法
1 . 回收利用含硫烟气有利于节约资源、保护环境。
I.含H2S的烟气回收
(1)将一部分含H2S的烟气在空气中燃烧,将燃烧所得产物与剩余烟气混合,冷却后可回收得到硫磺(S8)。该工艺中涉及反应如下:
反应1: ;
;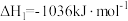
反应2: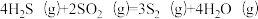 ;
;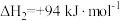
反应3: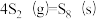 ;
;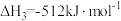
①反应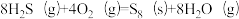 的△H=
的△H=_______ kJ∙mol-1。
②相同条件下需控制反应1与反应2中的烟气体积比为1:2的原因是_______ 。
Ⅱ.含SO2的烟气回收
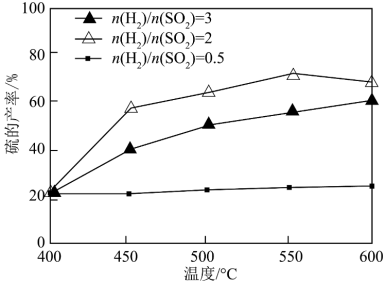
(2)以FeS2/Al2O3为催化剂,用H2还原SO2制S。
其他条件一定,改变起始时H2与SO2的比例,反应相同时间,测得S的产率随温度的变化关系如图所示。500℃,n(H2)/n(SO2)=3时硫的产率比n(H2)/n(SO2)=2时小的原因可能是_______ 。
(3)以V2O5/炭基材料为催化剂,SO2在炭表面被氧气催化氧化为SO3,SO3再转化为硫酸盐等。
①V2O5/炭基材料脱硫涉及反应: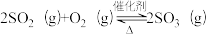 ,下列关于该反应的说法正确的是
,下列关于该反应的说法正确的是_______ (填字母序号)。
a.通入过量空气,可提高SO2的平衡转化率
b.当n(SO2):n(SO3)=l:1时,可判断反应达到平衡
c.使SO3液化从平衡体系中分离,能加快正反应速率,增大SO2转化率
②450℃、在V2O5催化下,SO2和O2的反应过程是按照如下两步完成的:
反应I:_______(快反应)
反应Ⅱ: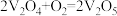 (慢反应)
(慢反应)
请补充上述反应的化学方程式_______ ,决定总反应速率快慢的是反应_______ (填“I”或“Ⅱ”)。
Ⅲ.工业上可采取多种方法减少SO2的排放,回答下列方法中的问题。
(4)方法1(双碱法):用NaOH溶液吸收SO2,并用CaO使NaOH再生NaOH溶液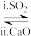 Na2SO3溶液
Na2SO3溶液
①写出过程i的离子方程式:_______ 。
②CaO在水中存在如下转化: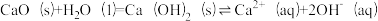
从平衡移动的角度,简述过程i中NaOH再生的原理:_______ 。
方法2:用氨水除去SO2
③已知25℃,NH3·H2O的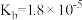 ,H2SO3的
,H2SO3的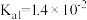 ,
,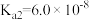 。若氨水的浓度为2.0mol∙L-1,溶液中的c(OH-)=
。若氨水的浓度为2.0mol∙L-1,溶液中的c(OH-)=_______ mol∙L-1。将SO2通入该氨水中,当c(OH-)降至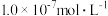 时,溶液中的
时,溶液中的
_______ 。
I.含H2S的烟气回收
(1)将一部分含H2S的烟气在空气中燃烧,将燃烧所得产物与剩余烟气混合,冷却后可回收得到硫磺(S8)。该工艺中涉及反应如下:
反应1:
 ;
;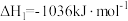
反应2:
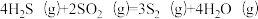 ;
;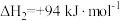
反应3:
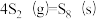 ;
;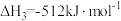
①反应
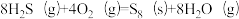 的△H=
的△H=②相同条件下需控制反应1与反应2中的烟气体积比为1:2的原因是
Ⅱ.含SO2的烟气回收
(2)以FeS2/Al2O3为催化剂,用H2还原SO2制S。
其他条件一定,改变起始时H2与SO2的比例,反应相同时间,测得S的产率随温度的变化关系如图所示。500℃,n(H2)/n(SO2)=3时硫的产率比n(H2)/n(SO2)=2时小的原因可能是

(3)以V2O5/炭基材料为催化剂,SO2在炭表面被氧气催化氧化为SO3,SO3再转化为硫酸盐等。
①V2O5/炭基材料脱硫涉及反应:
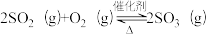 ,下列关于该反应的说法正确的是
,下列关于该反应的说法正确的是a.通入过量空气,可提高SO2的平衡转化率
b.当n(SO2):n(SO3)=l:1时,可判断反应达到平衡
c.使SO3液化从平衡体系中分离,能加快正反应速率,增大SO2转化率
②450℃、在V2O5催化下,SO2和O2的反应过程是按照如下两步完成的:
反应I:_______(快反应)
反应Ⅱ:
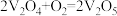 (慢反应)
(慢反应)请补充上述反应的化学方程式
Ⅲ.工业上可采取多种方法减少SO2的排放,回答下列方法中的问题。
(4)方法1(双碱法):用NaOH溶液吸收SO2,并用CaO使NaOH再生NaOH溶液
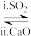 Na2SO3溶液
Na2SO3溶液①写出过程i的离子方程式:
②CaO在水中存在如下转化:
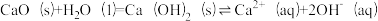
从平衡移动的角度,简述过程i中NaOH再生的原理:
方法2:用氨水除去SO2
③已知25℃,NH3·H2O的
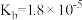 ,H2SO3的
,H2SO3的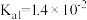 ,
,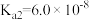 。若氨水的浓度为2.0mol∙L-1,溶液中的c(OH-)=
。若氨水的浓度为2.0mol∙L-1,溶液中的c(OH-)=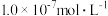 时,溶液中的
时,溶液中的
您最近一年使用:0次
名校
2 . 工业上常采用氨氧化法制硝酸,其流程是将氨和空气混合后通入灼热的铂铑合金网,反应生成NO(g),生成的一氧化氮与残余的氧气继续反应生成二氧化氮:2NO(g)+O2(g) = 2NO2(g);ΔH = -116.4 kJ·mol-1。随后将二氧化氮通入水中制取硝酸。对于反应2NO(g)+O2(g)  2NO2(g),下列说法正确的是
2NO2(g),下列说法正确的是
 2NO2(g),下列说法正确的是
2NO2(g),下列说法正确的是| A.该反应能够自发的原因是ΔS > 0 |
| B.工业上使用合适的催化剂可提高NO2的生产效率 |
| C.升高温度,该反应V(逆)减小,V(正)增大,平衡向逆反应方向移动 |
| D.2 mol NO(g)和1 mol O2(g)中所含化学键能总和比2 mol NO2(g)中大116.4 kJ·mol-1 |
您最近一年使用:0次
解题方法
3 . 国家主席习近平在9月22日召开的联合国大会上表示:“中国将争取在2060年前实现碳中和”。捕集CO2的技术对解决全球温室效应意义重大。回答下列问题:
(1)国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH=-270kJ·mol-1。几种化学键的键能如表所示:
则a=___________ 。
(2)将CO2还原为CH4,是实现CO2资源化利用的有效途径之一,装置如图所示:
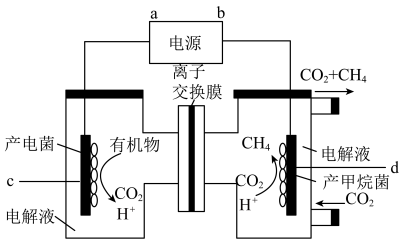
①H+的移动方向为___________ (填“自左至右”或“自右至左”);d电极的电极反应式为___________ 。
②若电源为CH3OH O2
O2 KOH清洁燃料电池,当消耗0.1molCH3OH燃料时,离子交换膜中通过
KOH清洁燃料电池,当消耗0.1molCH3OH燃料时,离子交换膜中通过___________ molH+,该清洁燃料电池中的正极反应式为___________ 。
(3)甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应I:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-49.58kJ·mol-1
反应II:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2
反应III:CO(g)+2H2(g)=CH3OH(g) ΔH3=-90.77kJ·mol-1
反应II的ΔH2=___________ kJ·mol-1。
(4)利用太阳能光解Fe3O4,制备的FeO用于还原CO2合成炭黑,可实现资源的再利用。其转化关系如图2所示。过程II反应的化学方程式是___________ 。

(5)在酸性电解质溶液中,以太阳能电池作电源,惰性材料作电极,可将CO2转化为乙烯。实验装置如图所示。

①若电解过程中生成3.36L(标准状况下)O2,则电路中转移的电子至少为___________ mol。
②生成乙烯的电极反应式是___________ 。
(1)国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH=-270kJ·mol-1。几种化学键的键能如表所示:
| 化学键 | C H H | H H H | H O O | C O O |
| 键能/kJ·mol-1 | 413 | 436 | a | 745 |
(2)将CO2还原为CH4,是实现CO2资源化利用的有效途径之一,装置如图所示:

①H+的移动方向为
②若电源为CH3OH
 O2
O2 KOH清洁燃料电池,当消耗0.1molCH3OH燃料时,离子交换膜中通过
KOH清洁燃料电池,当消耗0.1molCH3OH燃料时,离子交换膜中通过(3)甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应I:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-49.58kJ·mol-1
反应II:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2
反应III:CO(g)+2H2(g)=CH3OH(g) ΔH3=-90.77kJ·mol-1
反应II的ΔH2=
(4)利用太阳能光解Fe3O4,制备的FeO用于还原CO2合成炭黑,可实现资源的再利用。其转化关系如图2所示。过程II反应的化学方程式是

(5)在酸性电解质溶液中,以太阳能电池作电源,惰性材料作电极,可将CO2转化为乙烯。实验装置如图所示。

①若电解过程中生成3.36L(标准状况下)O2,则电路中转移的电子至少为
②生成乙烯的电极反应式是
您最近一年使用:0次
名校
4 .  (主要指NO和
(主要指NO和 )是大气主要污染物之一、有效去除大气中的
)是大气主要污染物之一、有效去除大气中的 是环境保护的重要课题。
是环境保护的重要课题。
(1)用水吸收 的相关热化学方程式如下:
的相关热化学方程式如下:

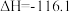 kJ⋅mol
kJ⋅mol
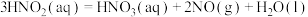
 kJ⋅mol
kJ⋅mol
反应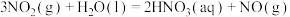 的
的
_______ kJ⋅mol 。
。
(2)用氨水吸收 ,可得到
,可得到 和
和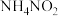 的混合溶液。利用双离子交换膜电解法电解
的混合溶液。利用双离子交换膜电解法电解 溶液可获得硝酸和氨。判断阴极、阳极的产物,写出对应的电极反应式。
溶液可获得硝酸和氨。判断阴极、阳极的产物,写出对应的电极反应式。
阴极反应:_______
阳极反应:_______
(3)用酸性 水溶液吸收
水溶液吸收 ,吸收过程中存在
,吸收过程中存在 与
与 生成
生成 和
和 的反应。写出该反应的化学方程式:
的反应。写出该反应的化学方程式:_______ 。
(4)在有氧条件下,新型催化剂M能催化 与
与 反应生成
反应生成 。
。
① 与
与 生成
生成 的反应中,当生成1 mol
的反应中,当生成1 mol  时,转移的电子数为
时,转移的电子数为_______ mol。
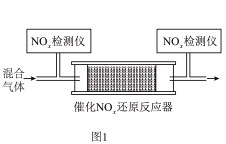
②将一定比例的 、
、 和
和 的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图1)。
的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图1)。
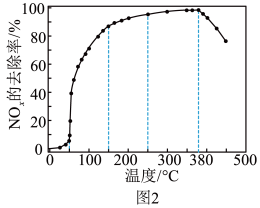
反应相同时间 的去除率随反应温度的变化曲线如图2所示,在50~250℃范围内随着温度的升高,
的去除率随反应温度的变化曲线如图2所示,在50~250℃范围内随着温度的升高, 的去除率先迅速上升后上升缓慢的主要原因是
的去除率先迅速上升后上升缓慢的主要原因是_______ ;当反应温度高于380℃时, 的去除率迅速下降的原因可能是
的去除率迅速下降的原因可能是_______ 。
 (主要指NO和
(主要指NO和 )是大气主要污染物之一、有效去除大气中的
)是大气主要污染物之一、有效去除大气中的 是环境保护的重要课题。
是环境保护的重要课题。(1)用水吸收
 的相关热化学方程式如下:
的相关热化学方程式如下:
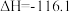 kJ⋅mol
kJ⋅mol
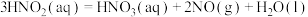
 kJ⋅mol
kJ⋅mol
反应
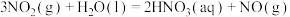 的
的
 。
。(2)用氨水吸收
 ,可得到
,可得到 和
和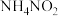 的混合溶液。利用双离子交换膜电解法电解
的混合溶液。利用双离子交换膜电解法电解 溶液可获得硝酸和氨。判断阴极、阳极的产物,写出对应的电极反应式。
溶液可获得硝酸和氨。判断阴极、阳极的产物,写出对应的电极反应式。阴极反应:
阳极反应:
(3)用酸性
 水溶液吸收
水溶液吸收 ,吸收过程中存在
,吸收过程中存在 与
与 生成
生成 和
和 的反应。写出该反应的化学方程式:
的反应。写出该反应的化学方程式:(4)在有氧条件下,新型催化剂M能催化
 与
与 反应生成
反应生成 。
。①
 与
与 生成
生成 的反应中,当生成1 mol
的反应中,当生成1 mol  时,转移的电子数为
时,转移的电子数为②将一定比例的
 、
、 和
和 的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图1)。
的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图1)。
反应相同时间
 的去除率随反应温度的变化曲线如图2所示,在50~250℃范围内随着温度的升高,
的去除率随反应温度的变化曲线如图2所示,在50~250℃范围内随着温度的升高, 的去除率先迅速上升后上升缓慢的主要原因是
的去除率先迅速上升后上升缓慢的主要原因是 的去除率迅速下降的原因可能是
的去除率迅速下降的原因可能是
您最近一年使用:0次
名校
5 . 已知:①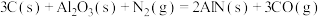
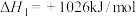
②
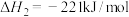 ;
;
③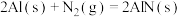
 ;
;
则反应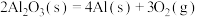 的
的 等于
等于
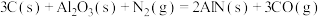
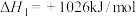
②

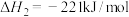 ;
;③
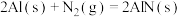
 ;
;则反应
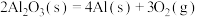 的
的 等于
等于| A.+753kJ/mol | B.-753kJ/mol | C.+3351kJ/mol | D.-3351kJ/mol |
您最近一年使用:0次
2023-01-10更新
|
575次组卷
|
4卷引用:江苏省无锡市匡园双语学校2023-2024学年高二下学期第一次月考化学试卷
江苏省无锡市匡园双语学校2023-2024学年高二下学期第一次月考化学试卷 湖北省孝感市2022-2023学年高二上学期1月期末考试化学试题广东省江门市第一中学2022-2023学年高二上学期期末考试(线上考试)化学试题(已下线)专题02 反应热的计算-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)
名校
6 . 气态含氮化合物是把双刃剑,既是固氮的主要途径,也是大气污染物。气态含氮化合物及相关反应是新型科研热点。回答下列问题:
(1)还原法:①用 催化还原
催化还原 可以消除氮氧化物的污染。已知:
可以消除氮氧化物的污染。已知:
ⅰ:
ⅱ:
写出 还原
还原 至
至 和水蒸气的热化学方程式
和水蒸气的热化学方程式_______ 。
②尿素水溶液热解产生的 可去除尾气中的
可去除尾气中的 ,流程如下:
,流程如下:

a.尿素 中氮元素的化合价为
中氮元素的化合价为_______ 。
b.若氧化处理后的尾气中混有 ,此时催化剂表面会因为覆盖部分硫酸盐而导致催化剂中毒,降低
,此时催化剂表面会因为覆盖部分硫酸盐而导致催化剂中毒,降低 的去除率。试分析硫酸盐的产生过程
的去除率。试分析硫酸盐的产生过程_______ 。
③某脱硝反应机理如图-1所示, 参与Ⅰ的反应方程式为
参与Ⅰ的反应方程式为_______ 。

(2)氧化法: 氧化性强于
氧化性强于 ,能更有效地氧化
,能更有效地氧化 。
。
Ⅰ:
Ⅱ: (活化能
(活化能 )
)
Ⅲ: (活化能
(活化能 )
)
 可经
可经 处理后再用碱液吸收而实现脱除。为分析氧化时温度对
处理后再用碱液吸收而实现脱除。为分析氧化时温度对 脱除率的影响,将
脱除率的影响,将 与
与 混合反应一段时间,再用碱液吸收氧化后的气体。其他条件相同时,脱除率随
混合反应一段时间,再用碱液吸收氧化后的气体。其他条件相同时,脱除率随 与
与 混合反应温度变化如图-2所示。试分析在
混合反应温度变化如图-2所示。试分析在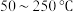 范围内,随着温度的升高
范围内,随着温度的升高 脱除率先几乎不变后下降的可能原因是
脱除率先几乎不变后下降的可能原因是_______ 。

(3)研究表明氮氧化物的脱除率除了与还原剂、氧化剂、催化剂相关外,还取决于催化剂表面氧缺位的密集程度。以 (A、B均为过渡元素)为催化剂,用
(A、B均为过渡元素)为催化剂,用 还原
还原 的机理如下:
的机理如下:
第一阶段: (不稳定)
(不稳定) 低价态的金属离子(还原前后催化剂中金属原子的个数不变)
低价态的金属离子(还原前后催化剂中金属原子的个数不变)
第二阶段:Ⅰ.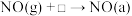 Ⅱ.
Ⅱ.
Ⅲ. Ⅳ.
Ⅳ.
Ⅴ.
注:表示催化剂表面的氧缺位,g表示气态,a表示吸附态
第一阶段用氢气还原 得到低价态的金属离子越多,第二阶段反应的速率越快,原因是
得到低价态的金属离子越多,第二阶段反应的速率越快,原因是_______ 。
(1)还原法:①用
 催化还原
催化还原 可以消除氮氧化物的污染。已知:
可以消除氮氧化物的污染。已知:ⅰ:

ⅱ:

写出
 还原
还原 至
至 和水蒸气的热化学方程式
和水蒸气的热化学方程式②尿素水溶液热解产生的
 可去除尾气中的
可去除尾气中的 ,流程如下:
,流程如下:
a.尿素
 中氮元素的化合价为
中氮元素的化合价为b.若氧化处理后的尾气中混有
 ,此时催化剂表面会因为覆盖部分硫酸盐而导致催化剂中毒,降低
,此时催化剂表面会因为覆盖部分硫酸盐而导致催化剂中毒,降低 的去除率。试分析硫酸盐的产生过程
的去除率。试分析硫酸盐的产生过程③某脱硝反应机理如图-1所示,
 参与Ⅰ的反应方程式为
参与Ⅰ的反应方程式为
(2)氧化法:
 氧化性强于
氧化性强于 ,能更有效地氧化
,能更有效地氧化 。
。Ⅰ:

Ⅱ:
 (活化能
(活化能 )
)Ⅲ:
 (活化能
(活化能 )
) 可经
可经 处理后再用碱液吸收而实现脱除。为分析氧化时温度对
处理后再用碱液吸收而实现脱除。为分析氧化时温度对 脱除率的影响,将
脱除率的影响,将 与
与 混合反应一段时间,再用碱液吸收氧化后的气体。其他条件相同时,脱除率随
混合反应一段时间,再用碱液吸收氧化后的气体。其他条件相同时,脱除率随 与
与 混合反应温度变化如图-2所示。试分析在
混合反应温度变化如图-2所示。试分析在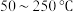 范围内,随着温度的升高
范围内,随着温度的升高 脱除率先几乎不变后下降的可能原因是
脱除率先几乎不变后下降的可能原因是
(3)研究表明氮氧化物的脱除率除了与还原剂、氧化剂、催化剂相关外,还取决于催化剂表面氧缺位的密集程度。以
 (A、B均为过渡元素)为催化剂,用
(A、B均为过渡元素)为催化剂,用 还原
还原 的机理如下:
的机理如下:第一阶段:
 (不稳定)
(不稳定) 低价态的金属离子(还原前后催化剂中金属原子的个数不变)
低价态的金属离子(还原前后催化剂中金属原子的个数不变)第二阶段:Ⅰ.
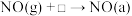 Ⅱ.
Ⅱ.
Ⅲ.
 Ⅳ.
Ⅳ.
Ⅴ.

注:表示催化剂表面的氧缺位,g表示气态,a表示吸附态
第一阶段用氢气还原
 得到低价态的金属离子越多,第二阶段反应的速率越快,原因是
得到低价态的金属离子越多,第二阶段反应的速率越快,原因是
您最近一年使用:0次
2022-12-17更新
|
560次组卷
|
3卷引用:江苏省无锡市天一中学等四校2022-2023学年高三上学期联考化学试题
7 . 尿素 是一种高效缓释氮肥。利用
是一种高效缓释氮肥。利用 和
和 合成尿素的反应分两步进行:
合成尿素的反应分两步进行:
①
 ;
;
②
 。
。
下列说法正确的是
 是一种高效缓释氮肥。利用
是一种高效缓释氮肥。利用 和
和 合成尿素的反应分两步进行:
合成尿素的反应分两步进行:①

 ;
;②

 。
。下列说法正确的是
A. 的 的 |
B.反应①的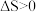 |
C.反应①的平衡常数 |
D.尿素分子中C的化合价为 |
您最近一年使用:0次
名校
解题方法
8 . 乙烯是重要的工业原材料,中科院设计并完成了 催化氧化
催化氧化 制取
制取 的新路径,
的新路径,
其主要反应为:反应Ⅰ: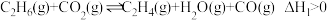
反应Ⅱ: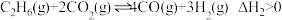
一定条件下,向容积为 的容器中通入
的容器中通入 和
和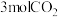 ,若仅考虑上述反应,
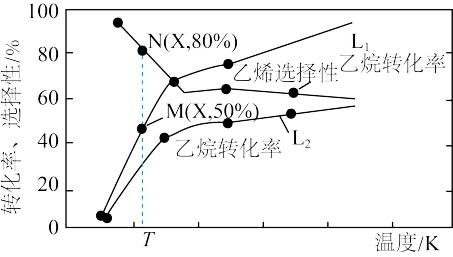
,若仅考虑上述反应, 平衡转化率和平衡时
平衡转化率和平衡时 的选择性随温度、压强的关系如图所示,
的选择性随温度、压强的关系如图所示, 代表不同压强下乙烷的平衡转化率。
代表不同压强下乙烷的平衡转化率。
已知:
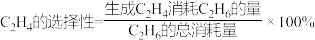
下列说法正确的是
 催化氧化
催化氧化 制取
制取 的新路径,
的新路径,其主要反应为:反应Ⅰ:
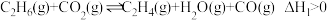
反应Ⅱ:
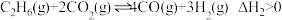
一定条件下,向容积为
 的容器中通入
的容器中通入 和
和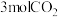 ,若仅考虑上述反应,
,若仅考虑上述反应, 平衡转化率和平衡时
平衡转化率和平衡时 的选择性随温度、压强的关系如图所示,
的选择性随温度、压强的关系如图所示,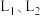 代表不同压强下乙烷的平衡转化率。
代表不同压强下乙烷的平衡转化率。
已知:
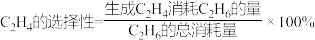
下列说法正确的是
A.压强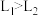 |
B.压强为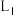 、温度为T时,反应达平衡时,混合气体中 、温度为T时,反应达平衡时,混合气体中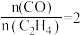 |
C.一定温度下,增大 可提高 可提高 的平衡转化率 的平衡转化率 |
D.反应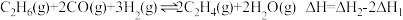 |
您最近一年使用:0次
2022-11-10更新
|
833次组卷
|
5卷引用:江苏省无锡市第一中学2023-2024学年高三上学期10月份质量检测化学试题
名校
9 . 氢气既是一种优质的能源,又是一种重要化工原料,高纯氢的制备是目前的研究热点。
(1)甲烷水蒸气催化重整是制备高纯氢的方法之一,甲烷和水蒸气反应的热化学方程式是:CH4(g)+2H2O(g)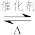 CO2(g)+4H2 (g) △H=+165.0kJ·mol-1
CO2(g)+4H2 (g) △H=+165.0kJ·mol-1
已知反应器中存在如下反应过程:
ⅰ.CH4(g)+H2O(g) CO(g)+3H2 (g) △H1=+206.4kJ·mol-1
CO(g)+3H2 (g) △H1=+206.4kJ·mol-1
ⅱ.CO(g)+H2O(g) CO2(g)+H2(g) △H2
CO2(g)+H2(g) △H2
根据上述信息计算:△H2=____ 。
(2)欲增大CH4转化为H2的平衡转化率,可采取的措施有____ (填标号)。
A.适当增大反应物投料比n(H2O):n(CH4) B.提高压强 C.分离出CO2
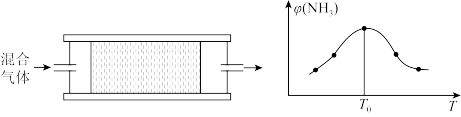
(3)H2用于工业合成氨:N2+3H2 2NH3。将n(N2):n(H2)=1:3的混合气体,匀速通过装有催化剂的反应器反应,反应器温度变化与从反应器排出气体中NH3的体积分数φ(NH3)关系如图,反应器温度升高NH3的体积分数φ(NH3)先增大后减小的原因是
2NH3。将n(N2):n(H2)=1:3的混合气体,匀速通过装有催化剂的反应器反应,反应器温度变化与从反应器排出气体中NH3的体积分数φ(NH3)关系如图,反应器温度升高NH3的体积分数φ(NH3)先增大后减小的原因是____ 。
(4)某温度下,n(N2):n(H2)=1:3的混合气体在刚性容器内发生反应,起始气体总压为2×107Pa,平衡时总压为开始的90%,则 的转化率为
的转化率为____ 。
(1)甲烷水蒸气催化重整是制备高纯氢的方法之一,甲烷和水蒸气反应的热化学方程式是:CH4(g)+2H2O(g)
 CO2(g)+4H2 (g) △H=+165.0kJ·mol-1
CO2(g)+4H2 (g) △H=+165.0kJ·mol-1已知反应器中存在如下反应过程:
ⅰ.CH4(g)+H2O(g)
 CO(g)+3H2 (g) △H1=+206.4kJ·mol-1
CO(g)+3H2 (g) △H1=+206.4kJ·mol-1ⅱ.CO(g)+H2O(g)
 CO2(g)+H2(g) △H2
CO2(g)+H2(g) △H2| 化学键 | H—H | O—H | C—H | C≡O |
| 键能E/(kJ·mol-1) | 436 | 465 | a | 1076 |
(2)欲增大CH4转化为H2的平衡转化率,可采取的措施有
A.适当增大反应物投料比n(H2O):n(CH4) B.提高压强 C.分离出CO2
(3)H2用于工业合成氨:N2+3H2
 2NH3。将n(N2):n(H2)=1:3的混合气体,匀速通过装有催化剂的反应器反应,反应器温度变化与从反应器排出气体中NH3的体积分数φ(NH3)关系如图,反应器温度升高NH3的体积分数φ(NH3)先增大后减小的原因是
2NH3。将n(N2):n(H2)=1:3的混合气体,匀速通过装有催化剂的反应器反应,反应器温度变化与从反应器排出气体中NH3的体积分数φ(NH3)关系如图,反应器温度升高NH3的体积分数φ(NH3)先增大后减小的原因是
(4)某温度下,n(N2):n(H2)=1:3的混合气体在刚性容器内发生反应,起始气体总压为2×107Pa,平衡时总压为开始的90%,则
 的转化率为
的转化率为
您最近一年使用:0次
名校
10 . SO2和H2S是大气污染物,这两种气体的转化研究对资源综合利用和环境保护有重要意义。
水煤气还原法:①2H2(g)+SO2(g)=S(1)+2H2O(g) ΔH1=+45.4 kJ/mol
②2CO(g)+SO2(g)=S(1)+2CO2(g) ΔH2=-37.0 kJ/mol
(1)写出CO(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式_______ ;若该反应在恒温恒容体系中进行,则其达到平衡的标志为_______ (填字母)。
A.单位时间内,生成nmolCO的同时生成nmolCO2
B.混合气体的平均摩尔质量保持不变
C.混合气体的总压强保持不变
D.CO2(g)与H2(g)的体积比保持不变
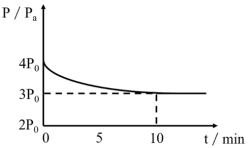
(2)在温度为T℃下,将1.4molH2和1molSO2通入2L恒容密闭容器中发生上述反应①2H2(g)+SO2(g)=S(1)+2H2O(g),反应体系中气体的总压强随时间变化如图所示。在0~10min,该反应的平均速率v(H2)=_______ mol·L-1·min-1,SO2的平衡转化率α(SO2)= _______ 。
(3)某密闭容器中发生上述反应②2CO(g)+SO2(g)=S(1)+2CO2(g),平衡时CO的体积分数(%)与压强和温度的关系如图所示。则T1、T2、T3由小到大的关系顺序是_______ ,判断的理由是_______ 。

水煤气还原法:①2H2(g)+SO2(g)=S(1)+2H2O(g) ΔH1=+45.4 kJ/mol
②2CO(g)+SO2(g)=S(1)+2CO2(g) ΔH2=-37.0 kJ/mol
(1)写出CO(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式
A.单位时间内,生成nmolCO的同时生成nmolCO2
B.混合气体的平均摩尔质量保持不变
C.混合气体的总压强保持不变
D.CO2(g)与H2(g)的体积比保持不变
(2)在温度为T℃下,将1.4molH2和1molSO2通入2L恒容密闭容器中发生上述反应①2H2(g)+SO2(g)=S(1)+2H2O(g),反应体系中气体的总压强随时间变化如图所示。在0~10min,该反应的平均速率v(H2)=

(3)某密闭容器中发生上述反应②2CO(g)+SO2(g)=S(1)+2CO2(g),平衡时CO的体积分数(%)与压强和温度的关系如图所示。则T1、T2、T3由小到大的关系顺序是

您最近一年使用:0次



