1 . 氢气是一种清洁能源,研究制氢技术具有重要意义。
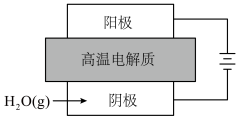
(1)一种高温固体氧化物电解水制氢原理如图所示。通过施加高温下的电压,使电解质中的 从阴极一侧迁移到阳极一侧,同时氧化为
从阴极一侧迁移到阳极一侧,同时氧化为 。
。___________ (用电极反应式表示)。
②电解质常选用铈( )的氧化物,晶胞结构如图所示,其化学式为
)的氧化物,晶胞结构如图所示,其化学式为___________ 。 进入
进入 氧化物晶格后(
氧化物晶格后( 取代部分
取代部分 ),电解效率显著提升,其原因是
),电解效率显著提升,其原因是___________ 。
(2)乙醇-水催化重整可获得 。其主要反应为:
。其主要反应为:
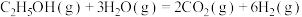
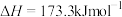

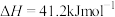
在 、
、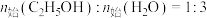 时,若仅考虑上述反应,平衡时
时,若仅考虑上述反应,平衡时 和
和 的转化率随温度的变化如图所示。
的转化率随温度的变化如图所示。 的
的
___________  。
。
②平衡时, 的产率随温度的变化为
的产率随温度的变化为___________ 。
(3)在“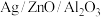 ”催化作用下,乙醇-水催化重整中部分物种变化路径如图所示。
”催化作用下,乙醇-水催化重整中部分物种变化路径如图所示。 的
的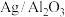 催化剂几乎没有催化活性的原因可能是
催化剂几乎没有催化活性的原因可能是___________ 。
ii.若用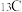 标记乙醇
标记乙醇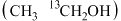 ,最终产物中含
,最终产物中含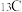 的物质化学式为
的物质化学式为___________ 。
(1)一种高温固体氧化物电解水制氢原理如图所示。通过施加高温下的电压,使电解质中的
 从阴极一侧迁移到阳极一侧,同时氧化为
从阴极一侧迁移到阳极一侧,同时氧化为 。
。
②电解质常选用铈(
 )的氧化物,晶胞结构如图所示,其化学式为
)的氧化物,晶胞结构如图所示,其化学式为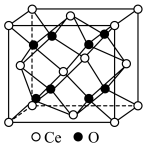
 进入
进入 氧化物晶格后(
氧化物晶格后( 取代部分
取代部分 ),电解效率显著提升,其原因是
),电解效率显著提升,其原因是(2)乙醇-水催化重整可获得
 。其主要反应为:
。其主要反应为: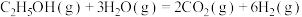
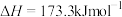

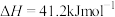
在
 、
、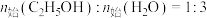 时,若仅考虑上述反应,平衡时
时,若仅考虑上述反应,平衡时 和
和 的转化率随温度的变化如图所示。
的转化率随温度的变化如图所示。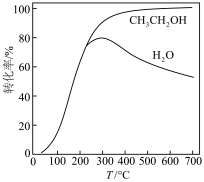
 的
的
 。
。②平衡时,
 的产率随温度的变化为
的产率随温度的变化为(3)在“
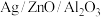 ”催化作用下,乙醇-水催化重整中部分物种变化路径如图所示。
”催化作用下,乙醇-水催化重整中部分物种变化路径如图所示。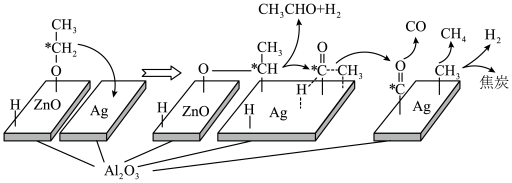
 的
的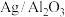 催化剂几乎没有催化活性的原因可能是
催化剂几乎没有催化活性的原因可能是ii.若用
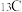 标记乙醇
标记乙醇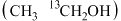 ,最终产物中含
,最终产物中含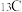 的物质化学式为
的物质化学式为
您最近半年使用:0次
2024·江苏·模拟预测
2 . CO、SO2等烟道气对环境有污染,需经处理后才能排放,处理含CO、SO2烟道气的一种方法是将其在催化剂作用下转化为单质S(l):2CO(g)+SO2(g)=S(l)+2CO2(g) ΔH。回答下列问题:
(1)已知CO的燃烧热为283.0 kJ⋅mol-1,S(l)+O2(g)=SO2(g) ΔH=-296.8 kJ⋅mol-1。则上述反应的ΔH=___________ kJ⋅mol-1。
(2)其他条件相同、催化剂不同时发生上述反应。SO2的转化率随反应温度的变化如图1所示。Fe2O3和NiO作催化剂均能使SO2的转化率达到最高,不考虑催化剂价格因素,选择Fe2O3的主要优点是___________ 。___________ mol⋅L-1⋅min-1。
②2 min后改变下列条件能使上述反应的速率增大,且平衡向正向移动的是___________ (填字母)。
a.选用更高效的催化剂 b.升高温度 c.及时分离出CO2 d.增加CO的浓度
(4)在密闭容器中,充入2 mol CO和1 mol SO2,发生上述反应,SO2的平衡转化率随温度、压强的变化如图3所示。___________ 。
②B点对应条件下Kx=___________ [对于反应mA(g)+nB(g) pC(g)+qD(g),Kx=
pC(g)+qD(g),Kx= 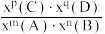 ,x为物质的量分数]。
,x为物质的量分数]。
③A点和C点压强平衡常数之比为___________ (用分压代替浓度,分压=总压×物质的量分数)。
(1)已知CO的燃烧热为283.0 kJ⋅mol-1,S(l)+O2(g)=SO2(g) ΔH=-296.8 kJ⋅mol-1。则上述反应的ΔH=
(2)其他条件相同、催化剂不同时发生上述反应。SO2的转化率随反应温度的变化如图1所示。Fe2O3和NiO作催化剂均能使SO2的转化率达到最高,不考虑催化剂价格因素,选择Fe2O3的主要优点是

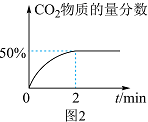
②2 min后改变下列条件能使上述反应的速率增大,且平衡向正向移动的是
a.选用更高效的催化剂 b.升高温度 c.及时分离出CO2 d.增加CO的浓度
(4)在密闭容器中,充入2 mol CO和1 mol SO2,发生上述反应,SO2的平衡转化率随温度、压强的变化如图3所示。

②B点对应条件下Kx=
 pC(g)+qD(g),Kx=
pC(g)+qD(g),Kx= 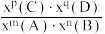 ,x为物质的量分数]。
,x为物质的量分数]。③A点和C点压强平衡常数之比为
您最近半年使用:0次
名校
3 . 第三周期元素的单质及其化合物具有重要用途。在熔融状态下,可用金属钠制备金属钾;MgCl2可制备多种镁产品;铝—空气电池具有较高的比能量,在碱性电解液中总反应为4Al+3O2+4OH-+6H2O=4[Al(OH)4]-。高纯硅广泛用于信息技术领域,高温条件下,将粗硅转化为三氯硅烷(SiHCl3),再经氢气还原得到高纯硅。硫有多种单质,如斜方硫(燃烧热为297kJ·mol–1)、单斜硫等。H2S可除去废水中Hg2+等重金属离子,H2S水溶液在空气中会缓慢氧化生成S而变浑浊。SO2催化氧化是工业制硫酸的重要反应之一,常用V2O5作催化剂。下列化学反应表示正确的是
| A.斜方硫燃烧:S(s,斜方硫)+O2(g)=SO2(g) ∆H=297kJ·mol–1 |
| B.CuSO4溶液中加入小粒金属钠:2Na+Cu2+=Cu+2Na+ |
C.SiHCl3转化为高纯硅:SiHCl3+H2 Si+3HCl Si+3HCl |
| D.铝—空气电池放电时的负极反应:Al+4H2O-3e−=[Al(OH)4]-+4H+ |
您最近半年使用:0次
名校
解题方法
4 . 有效去除大气中的NOx和水体中的氮,并且转化为可利用的资源是重要课题。
(1)在微生物作用的条件下, 经过两步反应被氧化成
经过两步反应被氧化成 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下: (aq)+2O2(g)=
(aq)+2O2(g)= (aq)+2H+(aq)+H2O(l) ΔH=
(aq)+2H+(aq)+H2O(l) ΔH=_______ kJ·mol-1
(2)近年来,采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中的c(OH-)制备纳米Cu2O备受关注,其模拟装置如图甲、乙。_______ (请填“C”或“D”)极相连。
②该电解池的阳极反应式为_______ 。
③该电解池(图乙)中离子交换膜为_______ (请填“阴”或“阳”)离子交换膜。
④理论上,每生产144g纳米Cu2O,需要消耗肼(N2H4)_______ mol。
(3)纳米颗粒在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。_______ 。
②上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中_______ (填字母)的活化能。
A.*CO+*OH→*CO+*H2O
B.*CO→*OCH
C.*OCH2→*OCH3
D.*OCH3→*CH3OH
(4)磷酸铵镁(MgNH4PO4)沉淀法可去除水体中的氨氮( 和NH3)。实验室中模拟氨氮处理:1 L的模拟氨氮废水(主要含
和NH3)。实验室中模拟氨氮处理:1 L的模拟氨氮废水(主要含 ),置于搅拌器上,设定反应温度为25 ℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30 min后,取液面下2 cm处清液测定氨氮质量浓度。已知:常温下,磷酸铵镁(MgNH4PO4)微溶于水;H3PO4的Ka1=6.9×10-3, Ka2=6.2×10-8 ,Ka3=4.8×10-13。
),置于搅拌器上,设定反应温度为25 ℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30 min后,取液面下2 cm处清液测定氨氮质量浓度。已知:常温下,磷酸铵镁(MgNH4PO4)微溶于水;H3PO4的Ka1=6.9×10-3, Ka2=6.2×10-8 ,Ka3=4.8×10-13。_______ 。
②当反应pH为9.0时,该沉淀法对氨氮的去除率达到最高,当pH继续增至10.0时,氨氮的去除率下降,原因是_______ 。
(1)在微生物作用的条件下,
 经过两步反应被氧化成
经过两步反应被氧化成 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下: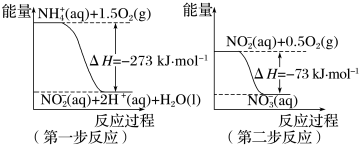
 (aq)+2O2(g)=
(aq)+2O2(g)= (aq)+2H+(aq)+H2O(l) ΔH=
(aq)+2H+(aq)+H2O(l) ΔH=(2)近年来,采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中的c(OH-)制备纳米Cu2O备受关注,其模拟装置如图甲、乙。
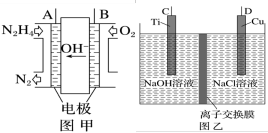
②该电解池的阳极反应式为
③该电解池(图乙)中离子交换膜为
④理论上,每生产144g纳米Cu2O,需要消耗肼(N2H4)
(3)纳米颗粒在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。
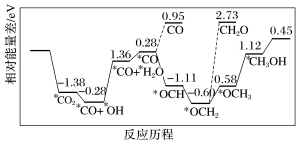
②上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中
A.*CO+*OH→*CO+*H2O
B.*CO→*OCH
C.*OCH2→*OCH3
D.*OCH3→*CH3OH
(4)磷酸铵镁(MgNH4PO4)沉淀法可去除水体中的氨氮(
 和NH3)。实验室中模拟氨氮处理:1 L的模拟氨氮废水(主要含
和NH3)。实验室中模拟氨氮处理:1 L的模拟氨氮废水(主要含 ),置于搅拌器上,设定反应温度为25 ℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30 min后,取液面下2 cm处清液测定氨氮质量浓度。已知:常温下,磷酸铵镁(MgNH4PO4)微溶于水;H3PO4的Ka1=6.9×10-3, Ka2=6.2×10-8 ,Ka3=4.8×10-13。
),置于搅拌器上,设定反应温度为25 ℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30 min后,取液面下2 cm处清液测定氨氮质量浓度。已知:常温下,磷酸铵镁(MgNH4PO4)微溶于水;H3PO4的Ka1=6.9×10-3, Ka2=6.2×10-8 ,Ka3=4.8×10-13。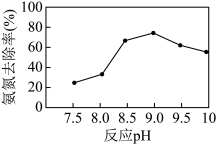
②当反应pH为9.0时,该沉淀法对氨氮的去除率达到最高,当pH继续增至10.0时,氨氮的去除率下降,原因是
您最近半年使用:0次
名校
5 . 电催化还原CO2是当今资源化利用二氧化碳的重点课题。
(1)利用CO2合成淀粉
①
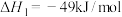
②
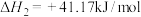
③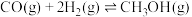

___________ (填“高温自发”“低温自发”或“任何温度下都自发”)。
(2)一种有机多孔电极材料(铜粉沉积在一种有机物的骨架上)电催化还原CO2的装置示意图如图1所示.控制其他条件相同,将一定量的CO2通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如图2所示.___________ 。
②控制电压为0.8V,电解时转移电子的物质的量为___________ mol。
③科研小组利用13CO2代替原有的CO2进行研究,其目的是___________ 。
(3)一种铜基复合电极材料Au/Cu2O的制备方法:将一定量Cu2O分散至水与乙醇的混合溶液中,向溶液中逐滴滴加HAuCl4(一种强酸)溶液,搅拌一段时间后离心分离,得Au/Cu2O,溶液呈蓝色.写出Cu2O还原HAuCl4的离子方程式:___________ 。
(4)金属Cu/La复合电极材料电催化还原CO2制备甲醛和乙醇的可能机理如图3所示。研究表明,在不同电极材料上形成中间体的部分反应活化能如图4所示。___________ 。
②与单纯的Cu电极相比,利用Cu/La复合电极材料电催化还原CO2的优点是___________ 。
(1)利用CO2合成淀粉
①

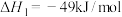
②

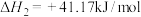
③
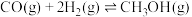

(2)一种有机多孔电极材料(铜粉沉积在一种有机物的骨架上)电催化还原CO2的装置示意图如图1所示.控制其他条件相同,将一定量的CO2通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如图2所示.
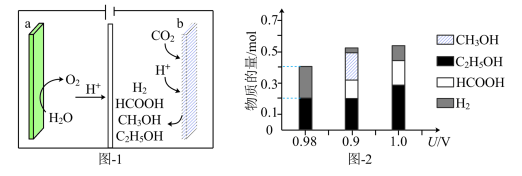
②控制电压为0.8V,电解时转移电子的物质的量为
③科研小组利用13CO2代替原有的CO2进行研究,其目的是
(3)一种铜基复合电极材料Au/Cu2O的制备方法:将一定量Cu2O分散至水与乙醇的混合溶液中,向溶液中逐滴滴加HAuCl4(一种强酸)溶液,搅拌一段时间后离心分离,得Au/Cu2O,溶液呈蓝色.写出Cu2O还原HAuCl4的离子方程式:
(4)金属Cu/La复合电极材料电催化还原CO2制备甲醛和乙醇的可能机理如图3所示。研究表明,在不同电极材料上形成中间体的部分反应活化能如图4所示。
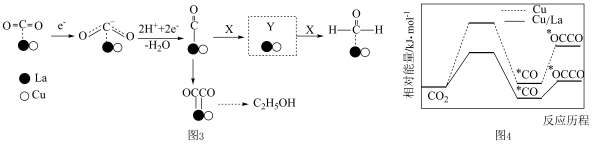
②与单纯的Cu电极相比,利用Cu/La复合电极材料电催化还原CO2的优点是
您最近半年使用:0次
名校
6 . 尿素[CO(NH2)2]的生产具有重要意义。
(1)尿素的催化合成
已知:2H2(g)+O2(g)=2H2O(l) ΔH1=-286.0 kJ·mol-1
N2(g)+3H2(g)=2NH3(g) ΔH2=-92.2 kJ·mol-1
2NH3(g)+CO2(g)=CO(NH2)2(aq)+H2O(l) ΔH3=-101.5 kJ·mol-1
则反应2CO2+2N2+4H2O=2CO(NH2)2+3O2的 ΔH=___________ kJ·mol-1
(2)尿素的电化学合成
①电催化CO2和 合成尿素的装置如下图所示,生成尿素的电极反应式为
合成尿素的装置如下图所示,生成尿素的电极反应式为___________ 。
已知:CO2在阴极还能被还原为CH4,其生成CH4的趋势比生成CO的趋势更大。但实验数据说明,一定时间内,阴极产物中CO的物质的量大于CH4,可能的原因为___________ 。
(3)尿素的应用
尿素将烟气中氮氧化物还原为N2以达到消除污染的目的。控制其他条件相同,将混有NO、NO2、SO2、N2和O2的模拟烟气匀速通过装有尿素溶液的装置,在装置出口处检测NO、NO2的脱除率α(α= ×100%)。
×100%)。
①当烟气中有少量SO2时,有利于NO2脱除,其可能的原因是___________ 。
②当烟气中无SO2存在时,且 超过一定数值时,测得α(NO)变为负值,其可能的原因是
超过一定数值时,测得α(NO)变为负值,其可能的原因是___________ 。
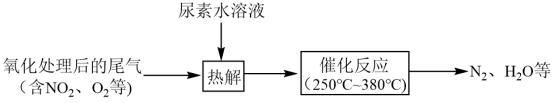
③尿素水溶液热解产生的NH3可去除尾气中的NOx,流程如下:___________ 。
(1)尿素的催化合成
已知:2H2(g)+O2(g)=2H2O(l) ΔH1=-286.0 kJ·mol-1
N2(g)+3H2(g)=2NH3(g) ΔH2=-92.2 kJ·mol-1
2NH3(g)+CO2(g)=CO(NH2)2(aq)+H2O(l) ΔH3=-101.5 kJ·mol-1
则反应2CO2+2N2+4H2O=2CO(NH2)2+3O2的 ΔH=
(2)尿素的电化学合成
①电催化CO2和
 合成尿素的装置如下图所示,生成尿素的电极反应式为
合成尿素的装置如下图所示,生成尿素的电极反应式为
已知:CO2在阴极还能被还原为CH4,其生成CH4的趋势比生成CO的趋势更大。但实验数据说明,一定时间内,阴极产物中CO的物质的量大于CH4,可能的原因为
(3)尿素的应用
尿素将烟气中氮氧化物还原为N2以达到消除污染的目的。控制其他条件相同,将混有NO、NO2、SO2、N2和O2的模拟烟气匀速通过装有尿素溶液的装置,在装置出口处检测NO、NO2的脱除率α(α=
 ×100%)。
×100%)。①当烟气中有少量SO2时,有利于NO2脱除,其可能的原因是
②当烟气中无SO2存在时,且
 超过一定数值时,测得α(NO)变为负值,其可能的原因是
超过一定数值时,测得α(NO)变为负值,其可能的原因是③尿素水溶液热解产生的NH3可去除尾气中的NOx,流程如下:
您最近半年使用:0次
解题方法
7 . 硫、氮和磷是生物必须的营养元素,含硫、氮和磷的化合物在自然界中广泛存在。
(1)火山喷发产生H2S在大气中发生如下反应:
①
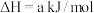
②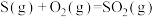
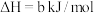
写出H2S(g)完全燃烧的热化学方程式_______ 。
(2)工业上可用NaClO碱性溶液吸收SO2.为了提高吸收效率,常用Ni2O3作为催化剂。反应过程中产生的四价镍和原子氧具有极强的氧化能力,可加快对SO2的吸收。该催化过程的示意图如下图所示。Ca(ClO)2也可用于脱硫,且脱硫效果比NaClO更好,原因是_______ 。_______ ;
②若无能量损失,相同条件下,SO2和NO的体积比为_______ 时,两种气体都能被完全处理。
(4)某含磷废水的主要成分是H3PO3.25℃时,向一定体积的亚磷酸(H3PO3,二元弱酸)溶液中滴加等物质的量浓度的NaOH溶液,混合液中含磷粒子的物质的量分数( )与溶液pH的关系如下图所示。
)与溶液pH的关系如下图所示。_______ 7(填“<”或“>”或“=”)。
②Na2HPO3其水解平衡常数
_______ (填数值)。
(5)太阳能光电催化——化学耦合分解H2S的装置如图所示。该太阳能光电催化——化学耦合分解H2S的过程可描述为_______ 。
(1)火山喷发产生H2S在大气中发生如下反应:
①

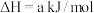
②
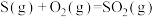
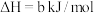
写出H2S(g)完全燃烧的热化学方程式
(2)工业上可用NaClO碱性溶液吸收SO2.为了提高吸收效率,常用Ni2O3作为催化剂。反应过程中产生的四价镍和原子氧具有极强的氧化能力,可加快对SO2的吸收。该催化过程的示意图如下图所示。Ca(ClO)2也可用于脱硫,且脱硫效果比NaClO更好,原因是


②若无能量损失,相同条件下,SO2和NO的体积比为
(4)某含磷废水的主要成分是H3PO3.25℃时,向一定体积的亚磷酸(H3PO3,二元弱酸)溶液中滴加等物质的量浓度的NaOH溶液,混合液中含磷粒子的物质的量分数(
 )与溶液pH的关系如下图所示。
)与溶液pH的关系如下图所示。
②Na2HPO3其水解平衡常数

(5)太阳能光电催化——化学耦合分解H2S的装置如图所示。该太阳能光电催化——化学耦合分解H2S的过程可描述为
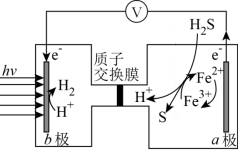
您最近半年使用:0次
8 . 天然气、石油钻探过程会释放出 、
、 等气体。
等气体。
Ⅰ.某种将 和
和 共活化的工艺涉及反应如下:
共活化的工艺涉及反应如下:
①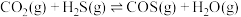

②

③
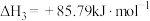
④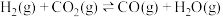
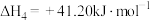
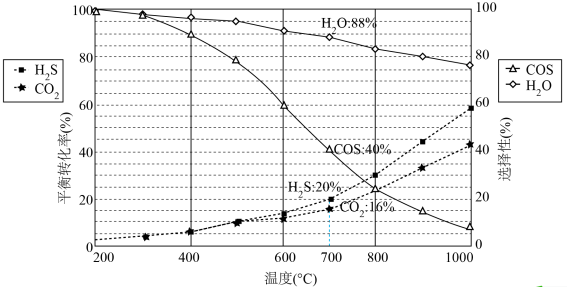
恒压密闭容器中,反应物的平衡转化率、部分生成物的选择性与温度关系如图所示。
已知:ⅰ. 和
和 的初始物质的量相等;
的初始物质的量相等;
ⅱ.COS的选择性 ,
, 的选择性
的选择性 ;
;
ⅲ.产率=转化率×选择性。
(1)
_______ 。
(2)温度高于 时,
时, 的转化率大于
的转化率大于 ,原因是
,原因是_______ 。
(3) 达到平衡时,反应体系中
达到平衡时,反应体系中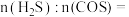
_______ 。
(4)催化剂 对反应②具有高选择性,通过理论计算得到反应的主要路径如下图。
对反应②具有高选择性,通过理论计算得到反应的主要路径如下图。请在答题纸对应区域绘出 过渡态 的示意图
的示意图_______ 。 协同转化装置,实现对天然气中
协同转化装置,实现对天然气中 和
和 的高效去除,其中电极分别为
的高效去除,其中电极分别为 石墨烯(石墨烯包裹的
石墨烯(石墨烯包裹的 )和石墨烯。过程如图所示:
)和石墨烯。过程如图所示:_______ 。
(6)阳极区发生反应为:
①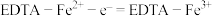 ;
;
②_______ 。
(7)工作时, 石墨烯电极区的
石墨烯电极区的 基本保持不变,原因是
基本保持不变,原因是_______ 。
 、
、 等气体。
等气体。Ⅰ.某种将
 和
和 共活化的工艺涉及反应如下:
共活化的工艺涉及反应如下:①
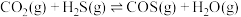

②


③

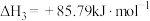
④
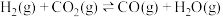
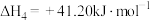
恒压密闭容器中,反应物的平衡转化率、部分生成物的选择性与温度关系如图所示。
已知:ⅰ.
 和
和 的初始物质的量相等;
的初始物质的量相等;ⅱ.COS的选择性
 ,
, 的选择性
的选择性 ;
;ⅲ.产率=转化率×选择性。
(1)

(2)温度高于
 时,
时, 的转化率大于
的转化率大于 ,原因是
,原因是(3)
 达到平衡时,反应体系中
达到平衡时,反应体系中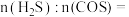
(4)催化剂
 对反应②具有高选择性,通过理论计算得到反应的主要路径如下图。
对反应②具有高选择性,通过理论计算得到反应的主要路径如下图。 的示意图
的示意图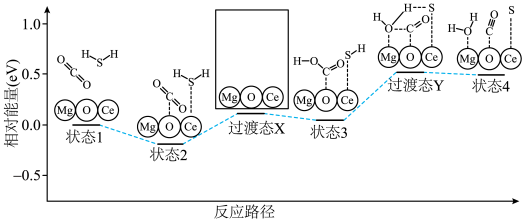
 协同转化装置,实现对天然气中
协同转化装置,实现对天然气中 和
和 的高效去除,其中电极分别为
的高效去除,其中电极分别为 石墨烯(石墨烯包裹的
石墨烯(石墨烯包裹的 )和石墨烯。过程如图所示:
)和石墨烯。过程如图所示: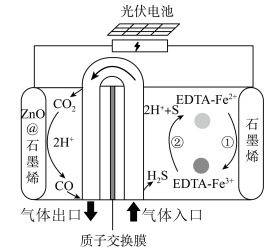
(6)阳极区发生反应为:
①
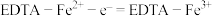 ;
;②
(7)工作时,
 石墨烯电极区的
石墨烯电极区的 基本保持不变,原因是
基本保持不变,原因是
您最近半年使用:0次
名校
解题方法
9 . 已知氮元素及其化合物的转化关系如下图所示,回答下列问题。_______ 。
(2)反应④的离子方程式为_______ 。理论上如图N2合成1mol硝酸,至少需要氧气共_______ mol。
(3)汽车尾气净化装置中,气体在催化剂表面吸附与解吸作用的过程如图所示,该过程的总反应化学方程式为_______ 。
①根据上图得知_______ (填字母)。
A.NaOH溶液浓度越大,氮氧化物的吸收率越大
B.NO2含量越大,氮氧化物的吸收率越大
②当α小于50%时,加入H2O2能提升氮氧化物的吸收率,原因是_______ 。

(2)反应④的离子方程式为
(3)汽车尾气净化装置中,气体在催化剂表面吸附与解吸作用的过程如图所示,该过程的总反应化学方程式为

①根据上图得知
A.NaOH溶液浓度越大,氮氧化物的吸收率越大
B.NO2含量越大,氮氧化物的吸收率越大
②当α小于50%时,加入H2O2能提升氮氧化物的吸收率,原因是
您最近半年使用:0次
名校
解题方法
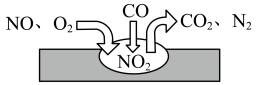
10 . 处理、回收和利用CO和CO2既能实现资源的综合利用,也是环境科学研究的热点课题。请回答下列问题:
(1)CO处理大气污染物 的相关原理为
的相关原理为 ,
,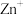 为该反应的催化剂,过程如下:
为该反应的催化剂,过程如下:



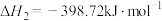
若反应 的正反应的活化能为
的正反应的活化能为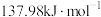 ,则逆反应的活化能为
,则逆反应的活化能为_______  。
。
(2)在容积相同的密闭容器A(起始温度为450℃,恒温)、B(起始温度为450℃,绝热)中分别加入等量的 、CO和相同催化剂。实验测得容器A、B中CO转化率随时间的变化关系如图所示。
、CO和相同催化剂。实验测得容器A、B中CO转化率随时间的变化关系如图所示。_______ (填“m”或“n”)曲线。
(3)已知反应 的速率方程为
的速率方程为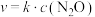 ,其中k为速率常数,只和温度有关。为了提高反应速率,可采取的措施有_______。
,其中k为速率常数,只和温度有关。为了提高反应速率,可采取的措施有_______。
(4)根据阿伦尼乌斯经验公式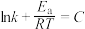 (其中k为速率常数,R、C均为常数,
(其中k为速率常数,R、C均为常数, 为活化能,T为绝对温度),使用x和y两种不同的催化剂得到相关图像,如图所示。在外界因素相同的条件下使用x和y两种催化剂,活化分子百分数最高的是
为活化能,T为绝对温度),使用x和y两种不同的催化剂得到相关图像,如图所示。在外界因素相同的条件下使用x和y两种催化剂,活化分子百分数最高的是_______ (填“x”或“y”),原因是_______ 。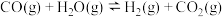 中CO的平衡转化率随
中CO的平衡转化率随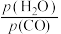 及温度变化关系如下图所示:
及温度变化关系如下图所示: )代替物质的量浓度(
)代替物质的量浓度(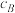 )也可以表示平衡常数(记作
)也可以表示平衡常数(记作 ),则该反应的
),则该反应的
_______ (填表达式,不必代数计算);如果提高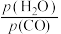 ,则
,则
_______ (填“变大”“变小”或“不变”)。使用铁镁催化剂的实际工业流程中,一般采用400℃左右、 ,采用此条件的原因可能是
,采用此条件的原因可能是_______ 。
(1)CO处理大气污染物
 的相关原理为
的相关原理为 ,
,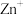 为该反应的催化剂,过程如下:
为该反应的催化剂,过程如下:


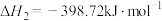
若反应
 的正反应的活化能为
的正反应的活化能为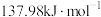 ,则逆反应的活化能为
,则逆反应的活化能为 。
。(2)在容积相同的密闭容器A(起始温度为450℃,恒温)、B(起始温度为450℃,绝热)中分别加入等量的
 、CO和相同催化剂。实验测得容器A、B中CO转化率随时间的变化关系如图所示。
、CO和相同催化剂。实验测得容器A、B中CO转化率随时间的变化关系如图所示。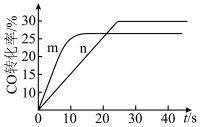
(3)已知反应
 的速率方程为
的速率方程为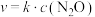 ,其中k为速率常数,只和温度有关。为了提高反应速率,可采取的措施有_______。
,其中k为速率常数,只和温度有关。为了提高反应速率,可采取的措施有_______。A.恒压条件下,通入 | B.恒容条件下,通入CO |
| C.降温 | D.缩小容器体积 |
(4)根据阿伦尼乌斯经验公式
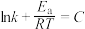 (其中k为速率常数,R、C均为常数,
(其中k为速率常数,R、C均为常数, 为活化能,T为绝对温度),使用x和y两种不同的催化剂得到相关图像,如图所示。在外界因素相同的条件下使用x和y两种催化剂,活化分子百分数最高的是
为活化能,T为绝对温度),使用x和y两种不同的催化剂得到相关图像,如图所示。在外界因素相同的条件下使用x和y两种催化剂,活化分子百分数最高的是
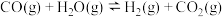 中CO的平衡转化率随
中CO的平衡转化率随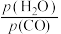 及温度变化关系如下图所示:
及温度变化关系如下图所示: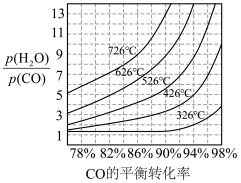
 )代替物质的量浓度(
)代替物质的量浓度(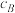 )也可以表示平衡常数(记作
)也可以表示平衡常数(记作 ),则该反应的
),则该反应的
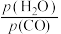 ,则
,则
 ,采用此条件的原因可能是
,采用此条件的原因可能是
您最近半年使用:0次



