名校
1 . 第三周期元素的单质及其化合物具有重要用途。在熔融状态下,可用金属钠制备金属钾;MgCl2可制备多种镁产品;铝—空气电池具有较高的比能量,在碱性电解液中总反应为4Al+3O2+4OH-+6H2O=4[Al(OH)4]-。高纯硅广泛用于信息技术领域,高温条件下,将粗硅转化为三氯硅烷(SiHCl3),再经氢气还原得到高纯硅。硫有多种单质,如斜方硫(燃烧热为297kJ·mol–1)、单斜硫等。H2S可除去废水中Hg2+等重金属离子,H2S水溶液在空气中会缓慢氧化生成S而变浑浊。SO2催化氧化是工业制硫酸的重要反应之一,常用V2O5作催化剂。下列化学反应表示正确的是
| A.斜方硫燃烧:S(s,斜方硫)+O2(g)=SO2(g) ∆H=297kJ·mol–1 |
| B.CuSO4溶液中加入小粒金属钠:2Na+Cu2+=Cu+2Na+ |
C.SiHCl3转化为高纯硅:SiHCl3+H2 Si+3HCl Si+3HCl |
| D.铝—空气电池放电时的负极反应:Al+4H2O-3e−=[Al(OH)4]-+4H+ |
您最近一年使用:0次
名校
2 . 完成下列填空:
(1) 气态高能燃料乙硼烷
气态高能燃料乙硼烷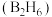 在氧气中燃烧,生成固态三氧化二硼和液态水放出
在氧气中燃烧,生成固态三氧化二硼和液态水放出 热量,其热化学方程式为:
热量,其热化学方程式为:___________ ;
(2)甲烷还原方法是在催化剂作用下可消除氮氧化物(主要为 和
和 )污染,
)污染, 和
和 的混合物反应体系主要发生如下反应:
的混合物反应体系主要发生如下反应:
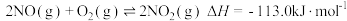 ①
①
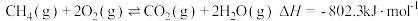 ②
②
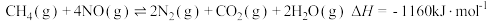 ③
③
则反应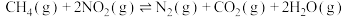 的
的
___________ 。
(3)天然气的一个重要用途是制取 ,其原理为:
,其原理为: 。
。
①该反应的平衡常数表达式为___________ 。
②在密闭容器中通入物质的量浓度均为 的
的 与
与 ,在一定条件下发生反应,测得
,在一定条件下发生反应,测得 的平衡转化率与温度及压强的关系如下图所示,则压强P1
的平衡转化率与温度及压强的关系如下图所示,则压强P1_______ P2(填"大于”或“小于”);压强为 时,在
时,在 点:v(正)
点:v(正)______ v(逆)(填“大于”、“小于”或“等于”)。 可以去除烟气中的
可以去除烟气中的 ,其反应原理如下:
,其反应原理如下: ;其他条件相同,以
;其他条件相同,以 (一种多孔性物质,每克的内表面积高达数百平方米,具有良好的吸附性能)作为催化剂,研究表明,
(一种多孔性物质,每克的内表面积高达数百平方米,具有良好的吸附性能)作为催化剂,研究表明, 在240℃以上发挥催化作用。反应相同的时间,
在240℃以上发挥催化作用。反应相同的时间, 的去除率随反应温度的变化如下图所示。240℃以前,随着温度的升高,
的去除率随反应温度的变化如下图所示。240℃以前,随着温度的升高, 去除率降低的原因是
去除率降低的原因是___________ 。240℃以后,随着温度的升高, 去除率迅速增大的主要原因是
去除率迅速增大的主要原因是___________ 。 的资源化利用能有效减少
的资源化利用能有效减少 排放,实现自然界中的碳循环。
排放,实现自然界中的碳循环。 催化加氢合成甲烷过程中发生下列反应:
催化加氢合成甲烷过程中发生下列反应:
Ⅰ:
Ⅱ:
当 时,
时, 平衡转化率与温度和压强的关系如图所示。800℃时,不同压强下的
平衡转化率与温度和压强的关系如图所示。800℃时,不同压强下的 平衡转化率趋向于相等的原因是
平衡转化率趋向于相等的原因是___________ 。
(1)
 气态高能燃料乙硼烷
气态高能燃料乙硼烷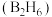 在氧气中燃烧,生成固态三氧化二硼和液态水放出
在氧气中燃烧,生成固态三氧化二硼和液态水放出 热量,其热化学方程式为:
热量,其热化学方程式为:(2)甲烷还原方法是在催化剂作用下可消除氮氧化物(主要为
 和
和 )污染,
)污染, 和
和 的混合物反应体系主要发生如下反应:
的混合物反应体系主要发生如下反应: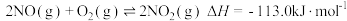 ①
①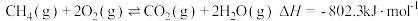 ②
②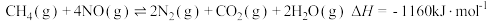 ③
③则反应
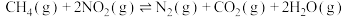 的
的
(3)天然气的一个重要用途是制取
 ,其原理为:
,其原理为: 。
。①该反应的平衡常数表达式为
②在密闭容器中通入物质的量浓度均为
 的
的 与
与 ,在一定条件下发生反应,测得
,在一定条件下发生反应,测得 的平衡转化率与温度及压强的关系如下图所示,则压强P1
的平衡转化率与温度及压强的关系如下图所示,则压强P1 时,在
时,在 点:v(正)
点:v(正)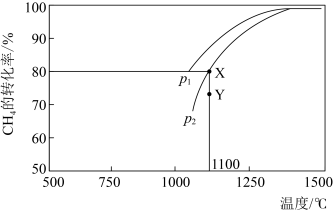
 可以去除烟气中的
可以去除烟气中的 ,其反应原理如下:
,其反应原理如下: ;其他条件相同,以
;其他条件相同,以 (一种多孔性物质,每克的内表面积高达数百平方米,具有良好的吸附性能)作为催化剂,研究表明,
(一种多孔性物质,每克的内表面积高达数百平方米,具有良好的吸附性能)作为催化剂,研究表明, 在240℃以上发挥催化作用。反应相同的时间,
在240℃以上发挥催化作用。反应相同的时间, 的去除率随反应温度的变化如下图所示。240℃以前,随着温度的升高,
的去除率随反应温度的变化如下图所示。240℃以前,随着温度的升高, 去除率降低的原因是
去除率降低的原因是 去除率迅速增大的主要原因是
去除率迅速增大的主要原因是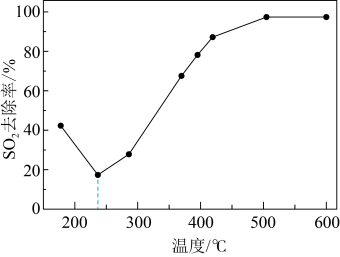
 的资源化利用能有效减少
的资源化利用能有效减少 排放,实现自然界中的碳循环。
排放,实现自然界中的碳循环。 催化加氢合成甲烷过程中发生下列反应:
催化加氢合成甲烷过程中发生下列反应:Ⅰ:

Ⅱ:

当
 时,
时, 平衡转化率与温度和压强的关系如图所示。800℃时,不同压强下的
平衡转化率与温度和压强的关系如图所示。800℃时,不同压强下的 平衡转化率趋向于相等的原因是
平衡转化率趋向于相等的原因是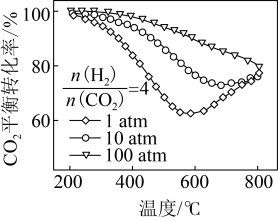
您最近一年使用:0次
名校
3 .  是环境污染物。
是环境污染物。
(1)消除 转化为游离态的氮。氮元素的单质有
转化为游离态的氮。氮元素的单质有 。
。 分子有多种结构,一种
分子有多种结构,一种 分子中4个氮原子在同一平面上,
分子中4个氮原子在同一平面上, 的结构式为
的结构式为_______ 。
(2)以氨气为原料脱硝除去 。
。
①合成氨是人类科学技术上的一项重大突破,氨的用途广泛。
已知: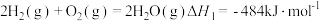
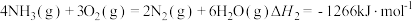
则 的
的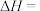
_______  。
。
②近期我国科学家为了解决合成氨反应速率和平衡产率的矛盾,选择使用 双催化剂,通过光辐射产生温差(如体系温度为
双催化剂,通过光辐射产生温差(如体系温度为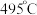 时,
时, 的温度为
的温度为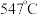 ,而
,而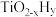 的温度为
的温度为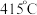 )。结合图1示解释该双催化剂的工作原理是
)。结合图1示解释该双催化剂的工作原理是_______ 。 。研究表明催化剂添加助剂后催化活性提高的原因是形成活性
。研究表明催化剂添加助剂后催化活性提高的原因是形成活性 参与反应,图2为丙烯脱硝机理。
参与反应,图2为丙烯脱硝机理。_______ 。(用化学式表示)
②若参加反应的丙烯与 物质的量之比为
物质的量之比为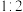 ,则反应的化学方程式为
,则反应的化学方程式为_______ 。
(4)以 为原料脱硝除去
为原料脱硝除去 。
。
烟气中的 与
与 反应缓慢。雾化后的
反应缓慢。雾化后的 在催化剂中
在催化剂中 元素作用下可以产生具有极强氧化活性的
元素作用下可以产生具有极强氧化活性的 (羟基自由基),
(羟基自由基), 能将
能将 快速氧化为
快速氧化为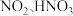 等物质。
等物质。  在一种固体催化剂表面转化的过程如图3所示:
在一种固体催化剂表面转化的过程如图3所示:_______ 。
②化学式为 的催化剂中,
的催化剂中, 和
和 的物质的量之比为
的物质的量之比为_______ 。
 是环境污染物。
是环境污染物。(1)消除
 转化为游离态的氮。氮元素的单质有
转化为游离态的氮。氮元素的单质有 。
。 分子有多种结构,一种
分子有多种结构,一种 分子中4个氮原子在同一平面上,
分子中4个氮原子在同一平面上, 的结构式为
的结构式为(2)以氨气为原料脱硝除去
 。
。①合成氨是人类科学技术上的一项重大突破,氨的用途广泛。
已知:
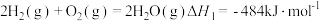
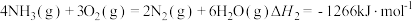
则
 的
的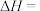
 。
。②近期我国科学家为了解决合成氨反应速率和平衡产率的矛盾,选择使用
 双催化剂,通过光辐射产生温差(如体系温度为
双催化剂,通过光辐射产生温差(如体系温度为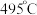 时,
时, 的温度为
的温度为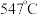 ,而
,而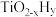 的温度为
的温度为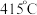 )。结合图1示解释该双催化剂的工作原理是
)。结合图1示解释该双催化剂的工作原理是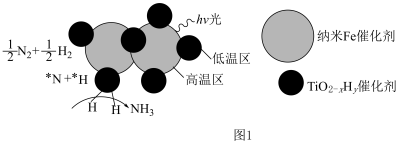
 。研究表明催化剂添加助剂后催化活性提高的原因是形成活性
。研究表明催化剂添加助剂后催化活性提高的原因是形成活性 参与反应,图2为丙烯脱硝机理。
参与反应,图2为丙烯脱硝机理。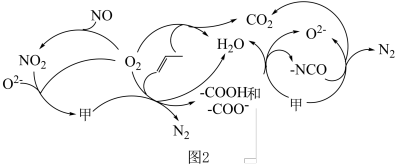
②若参加反应的丙烯与
 物质的量之比为
物质的量之比为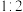 ,则反应的化学方程式为
,则反应的化学方程式为(4)以
 为原料脱硝除去
为原料脱硝除去 。
。烟气中的
 与
与 反应缓慢。雾化后的
反应缓慢。雾化后的 在催化剂中
在催化剂中 元素作用下可以产生具有极强氧化活性的
元素作用下可以产生具有极强氧化活性的 (羟基自由基),
(羟基自由基), 能将
能将 快速氧化为
快速氧化为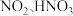 等物质。
等物质。  在一种固体催化剂表面转化的过程如图3所示:
在一种固体催化剂表面转化的过程如图3所示: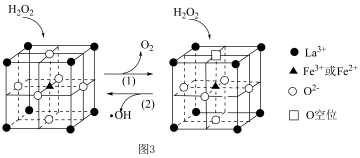
②化学式为
 的催化剂中,
的催化剂中, 和
和 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
名校
解题方法
4 . 氧及其化合物具有广泛用途。 是常用的氧化剂,
是常用的氧化剂, 的燃烧热为
的燃烧热为 ,氧炔焰产生的高温可用于焊接金属。
,氧炔焰产生的高温可用于焊接金属。 可用于水处理,pH约为8时,
可用于水处理,pH约为8时, 可与
可与 反应生成
反应生成 、
、 和
和 。
。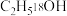 可用于研究酯化反应的机理。CaO可用于烟气(含
可用于研究酯化反应的机理。CaO可用于烟气(含 、
、 、
、 、
、 等)脱硫。
等)脱硫。 是一种绿色氧化剂,电解
是一种绿色氧化剂,电解 饱和溶液产生的
饱和溶液产生的 经水解可制得
经水解可制得 。下列化学反应表示正确的是
。下列化学反应表示正确的是
 是常用的氧化剂,
是常用的氧化剂, 的燃烧热为
的燃烧热为 ,氧炔焰产生的高温可用于焊接金属。
,氧炔焰产生的高温可用于焊接金属。 可用于水处理,pH约为8时,
可用于水处理,pH约为8时, 可与
可与 反应生成
反应生成 、
、 和
和 。
。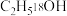 可用于研究酯化反应的机理。CaO可用于烟气(含
可用于研究酯化反应的机理。CaO可用于烟气(含 、
、 、
、 、
、 等)脱硫。
等)脱硫。 是一种绿色氧化剂,电解
是一种绿色氧化剂,电解 饱和溶液产生的
饱和溶液产生的 经水解可制得
经水解可制得 。下列化学反应表示正确的是
。下列化学反应表示正确的是A.乙炔的燃烧: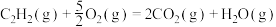  |
B.CaO吸收 的反应: 的反应: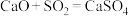 |
C. 处理含 处理含 废水的反应: 废水的反应: |
D.水解 制得 制得 的反应: 的反应: |
您最近一年使用:0次
2023-09-11更新
|
273次组卷
|
3卷引用:江苏省南京市南京师范大学附属中学2023-2024 学年高三9月考试化学试题
5 . 铅及其化合物在工业生产及日常生活中有非常广泛的用途。
(1)工业上可用PbS与PbSO4反应制备粗铅,反应为PbS+PbSO4 2Pb+2SO2↑。
2Pb+2SO2↑。
已知下列反应的热化学方程式:
Ⅰ.2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) ΔH1=a kJ·mol-1
Ⅱ.PbS(s)+2PbO(s)=3Pb(s)+SO2(g) ΔH2= b kJ·mol-1
Ⅲ.PbS(s)+2O2(g)=PbSO4(s) ΔH3=c kJ·mol-1
①反应PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) ΔH=_______ (用含a,b,c的代数式表示)。
②反应Ⅲ在一定条件下能自发进行的原因是_______ 。
(2)工业上可通过电解将粗铅精炼,电解液为H2SiF6和PbSiF6的混合溶液。电解时,当c(H2SiF6)过大时,铅产率减小的原因可能是_______ 。(已知:H2SiF6和PbSiF6均为易溶子水的强电解质。)
(3)铅易造成环境污染,水溶液中铅的存在形态与pH关系如图1所示。
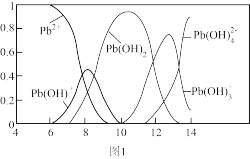
①常温下,向pH=10的含Pb(II)废水滴加氨水至pH=11时,所发生反应的离子方程式为_______ 。
②某工业含有Pb2+的废水,经处理后c(Pb2+)=2×l0-6 mol·L-1,达到排放标准,此溶液的pH不低于_______ 。(已知室温下:Ksp[Pb(OH)2]=2×10-l5)
(4)我国科学家在一种铅的卤化物光电材料中引入稀土铕(Eu3+)盐,可以提升太阳能电池的效率和使用寿命,其作用原理如图2所示。该过程可描述为_______ 。

(1)工业上可用PbS与PbSO4反应制备粗铅,反应为PbS+PbSO4
 2Pb+2SO2↑。
2Pb+2SO2↑。已知下列反应的热化学方程式:
Ⅰ.2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) ΔH1=a kJ·mol-1
Ⅱ.PbS(s)+2PbO(s)=3Pb(s)+SO2(g) ΔH2= b kJ·mol-1
Ⅲ.PbS(s)+2O2(g)=PbSO4(s) ΔH3=c kJ·mol-1
①反应PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) ΔH=
②反应Ⅲ在一定条件下能自发进行的原因是
(2)工业上可通过电解将粗铅精炼,电解液为H2SiF6和PbSiF6的混合溶液。电解时,当c(H2SiF6)过大时,铅产率减小的原因可能是
(3)铅易造成环境污染,水溶液中铅的存在形态与pH关系如图1所示。

①常温下,向pH=10的含Pb(II)废水滴加氨水至pH=11时,所发生反应的离子方程式为
②某工业含有Pb2+的废水,经处理后c(Pb2+)=2×l0-6 mol·L-1,达到排放标准,此溶液的pH不低于
(4)我国科学家在一种铅的卤化物光电材料中引入稀土铕(Eu3+)盐,可以提升太阳能电池的效率和使用寿命,其作用原理如图2所示。该过程可描述为

您最近一年使用:0次
6 . 甲醇是一种基本的有机化工原料,用途十分广泛。
已知:CH3OH(g) ⇌HCHO(g)+H2(g) ΔH=+84kJ·mol-1
2H2(g)+O2(g) ⇌2H2O(g) ΔH=-484kJ·mol-1
(1)①工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:_______ 。
②若在恒温恒容的容器内进行反应CO(g)+2H2(g) ⇌CH3OH(g),下列表示该反应达到平衡状态的标志有_______ (填字母序号)。
A.容器中混合气体的密度不变化
B.有2个H—H键断裂的同时有3个C—H键生成
C.容器中混合气体的压强不变化
D.CH3OH(g)百分含量保持不变
(2)工业上以CO、CO2、H2为原料制备甲醇,其原理如下:
主反应:①CO+2H2⇌CH3OH ②CO2+3H2⇌CH3OH+H2O
副反应:2CO⇌CO2+C 2CO+2H2⇌CH4+CO2
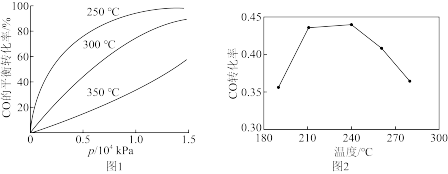
CO在不同温度下的平衡转化率与压强的关系如图1所示。该反应ΔH_____ (填“>”或“<”)0,实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是_____ 。由图2知,当温度高于240℃时,CO转化率下降的原因为_____ 。
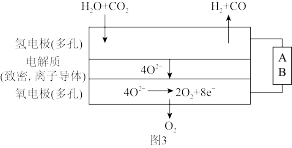
(3)电解水蒸气和CO2产生合成气(H2+CO)。较高温度下(700~1000℃),在SOEC两侧电极上施加一定的直流电压,H2O和CO2在氢电极发生还原反应产生O2-,O2-穿过致密的固体氧化物电解质层到达氧电极,在氧电极发生氧化反应得到纯O2,由图3可知A为直流电源的_____ (填“正极”或“负极”),请写出以H2O为原料生成H2的电极反应式:_____ 。
已知:CH3OH(g) ⇌HCHO(g)+H2(g) ΔH=+84kJ·mol-1
2H2(g)+O2(g) ⇌2H2O(g) ΔH=-484kJ·mol-1
(1)①工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:
②若在恒温恒容的容器内进行反应CO(g)+2H2(g) ⇌CH3OH(g),下列表示该反应达到平衡状态的标志有
A.容器中混合气体的密度不变化
B.有2个H—H键断裂的同时有3个C—H键生成
C.容器中混合气体的压强不变化
D.CH3OH(g)百分含量保持不变
(2)工业上以CO、CO2、H2为原料制备甲醇,其原理如下:
主反应:①CO+2H2⇌CH3OH ②CO2+3H2⇌CH3OH+H2O
副反应:2CO⇌CO2+C 2CO+2H2⇌CH4+CO2
CO在不同温度下的平衡转化率与压强的关系如图1所示。该反应ΔH

(3)电解水蒸气和CO2产生合成气(H2+CO)。较高温度下(700~1000℃),在SOEC两侧电极上施加一定的直流电压,H2O和CO2在氢电极发生还原反应产生O2-,O2-穿过致密的固体氧化物电解质层到达氧电极,在氧电极发生氧化反应得到纯O2,由图3可知A为直流电源的

您最近一年使用:0次
7 . 天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
(1)①已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ∆H1;
CO(g)+H2O(g)=CO2(g)+H2(g) ∆H2;
2CO(g)+O2(g)=2CO2(g) ∆H3;
则CO2(g)+CH4(g)=2CO(g)+2H2(g)的∆H=___________ 。
②天然气中的少量H2S杂质常用氨水吸收,产物为NH4HS。向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式___________ 。
(2)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g) 2CO(g)+2H2(g)。该反应的平衡常数表达式为
2CO(g)+2H2(g)。该反应的平衡常数表达式为___________ ;在密闭容器中通入物质的量浓度均为0.1 mol/L的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如图20-1所示。则压强P1___________ P2(填“大于”或“小于");压强为P2时,在Y点:v(正)___________ v(逆)(填“大于”“小于”或“等于”)。
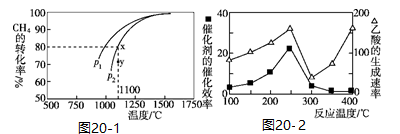
(3)CH4和CO2合成乙酸,某工业生产中以CuAlO2为合成的催化剂,在不同温度下催化剂的催化效率与乙酸的生成速率如图20-2所示。250℃~300℃时,温度升高而乙酸的生成速率降低的原因是___________ ,将CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,其离子方程式为___________ 。
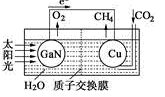
(4)科学家用氮化镓材料与铜组装如下图所示人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.写出铜电极表面的电极反应式___________ 。
(1)①已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ∆H1;
CO(g)+H2O(g)=CO2(g)+H2(g) ∆H2;
2CO(g)+O2(g)=2CO2(g) ∆H3;
则CO2(g)+CH4(g)=2CO(g)+2H2(g)的∆H=
②天然气中的少量H2S杂质常用氨水吸收,产物为NH4HS。向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式
(2)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g)
 2CO(g)+2H2(g)。该反应的平衡常数表达式为
2CO(g)+2H2(g)。该反应的平衡常数表达式为
(3)CH4和CO2合成乙酸,某工业生产中以CuAlO2为合成的催化剂,在不同温度下催化剂的催化效率与乙酸的生成速率如图20-2所示。250℃~300℃时,温度升高而乙酸的生成速率降低的原因是
(4)科学家用氮化镓材料与铜组装如下图所示人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.写出铜电极表面的电极反应式

您最近一年使用:0次
解题方法
8 . 金属镁是一种活泼的常见金属,用途广泛。在25℃,101kPa条件下。有关物质的能量如下表所示(X2表示任意卤素单质):
回答下列问题:
(1)镁与卤素单质的反应属于_______ (“放热”或“吸热”)反应。
(2)镁与卤素单质反应的生成物中,热稳定性最差的是_________ 。
(3)镁与液溴反应的热化学方程式为________ 。
(4)反应F2(g)+MgCl2(s)=MgF2(s)+Cl2(g)的△H=_______ kJ·mol-1。
物质 | Mg | X2 | MgF2 | MgCl2 | MgBr2 | MgI2 |
能量/kJ‧mol-1 | 0 | 0 | -1124 | -641.3 | -524 | -364 |
回答下列问题:
(1)镁与卤素单质的反应属于
(2)镁与卤素单质反应的生成物中,热稳定性最差的是
(3)镁与液溴反应的热化学方程式为
(4)反应F2(g)+MgCl2(s)=MgF2(s)+Cl2(g)的△H=
您最近一年使用:0次
2020-07-31更新
|
64次组卷
|
2卷引用:江苏省南通市海安县2020-2021学年高二上学期第一次月考化学试题
解题方法
9 . 金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在Z-X-X-K]密闭容器中用H2还原WO3可得到金属钨,其总反应为:WO3 (s) + 3H2 (g)  W (s) + 3H2O (g)
W (s) + 3H2O (g)
请回答下列问题:
(1)上述反应的化学平衡常数表达式为___________________________ 。
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为____________ 。
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:

第一阶段反应的化学方程式为___________________________ ;假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为____________________________________ 。
(4)已知:温度过高时,WO2 (s)转变为WO2 (g);
WO2 (s) + 2H2 (g) W (s) + 2H2O (g);ΔH = +66.0 kJ·mol-1
W (s) + 2H2O (g);ΔH = +66.0 kJ·mol-1
WO2 (g) + 2H2 W (s) + 2H2O (g);ΔH = -137.9 kJ·mol-1
W (s) + 2H2O (g);ΔH = -137.9 kJ·mol-1
则WO2 (s) WO2 (g) 的ΔH =
WO2 (g) 的ΔH = ______________________ 。
 W (s) + 3H2O (g)
W (s) + 3H2O (g) 请回答下列问题:
(1)上述反应的化学平衡常数表达式为
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:

第一阶段反应的化学方程式为
(4)已知:温度过高时,WO2 (s)转变为WO2 (g);
WO2 (s) + 2H2 (g)
 W (s) + 2H2O (g);ΔH = +66.0 kJ·mol-1
W (s) + 2H2O (g);ΔH = +66.0 kJ·mol-1 WO2 (g) + 2H2
 W (s) + 2H2O (g);ΔH = -137.9 kJ·mol-1
W (s) + 2H2O (g);ΔH = -137.9 kJ·mol-1 则WO2 (s)
 WO2 (g) 的ΔH =
WO2 (g) 的ΔH =
您最近一年使用:0次



