名校
解题方法
1 . 氮的氢化物和氧化物是氮元素的两类重要化合物,与人们的日常生活和生产关系密切。请回答下列问题:
(1)肼(N2H4)是一种氮的氢化物,作为火箭燃料是其主要用途。
①写出肼的电子式:___________ 。
②已知反应:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH1=-1048.9kJ·mol-1 (i)
N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534.2kJ·mol-1 (ii)
则N2(g)+2O2(g)=N2O4(l) ΔH=___________ 。
(2)工业合成氨为农业的丰收奠定了基础。为探究工业合成氨反应原理,进行下列实验:温度为T1时,将20.4gNH3和11.2gN2通入到容积为1.0L的恒容密闭容器中,0.5h达到平衡时,H2体积分数为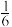 。化学反应速率v(H2)=
。化学反应速率v(H2)=___________ mol·L-1·h-1,NH3分解率=___________ 。
(3)氮的氧化物很多,且多数不稳定,最稳定的氮氧化物是NO2.在恒容密闭容器中投入一定量的N2O4,发生反应:N2O4(g)⇌2NO2(g) △H,N2O4的平衡转化率[a(N2O4)]随温度(T1、……T4逐渐升高)的变化关系如下图:
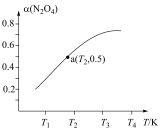
N2O4(g)转化为NO2(g)的△H___________ 0(填“>”或“<”)。若容器中通入N2O4的起始压强102kPa,则a点温度下的平衡常数Kp=___________ (用平衡分压代替平衡浓度计算,P分=P总×物质的量分数)。
(4)在汽车消音器管道中安装三元催化转化器,可发生反应:2NO(g)+2CO(g) 2CO2(g)+N2(g)。在某1.0L恒容密闭容器中各通入1.0mol的CO和NO,发生上述反应,经10min达到平衡状态,容器内压强变为原来的
2CO2(g)+N2(g)。在某1.0L恒容密闭容器中各通入1.0mol的CO和NO,发生上述反应,经10min达到平衡状态,容器内压强变为原来的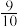 。
。
①下列能判断该反应达到平衡状态的是___________ (填序号)。
a.容器中,v正(CO)=v逆(NO) b.容器中的气体颜色不再变化
c.容器中气体的密度不再变化 d.容器内总分子数不再变化
②反应达到平衡后,仅将NO、CO2两种气体的浓度均增加1倍,则平衡___________ (填“向右移动”“向左移动”或“不移动”)。
(1)肼(N2H4)是一种氮的氢化物,作为火箭燃料是其主要用途。
①写出肼的电子式:
②已知反应:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH1=-1048.9kJ·mol-1 (i)
N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534.2kJ·mol-1 (ii)
则N2(g)+2O2(g)=N2O4(l) ΔH=
(2)工业合成氨为农业的丰收奠定了基础。为探究工业合成氨反应原理,进行下列实验:温度为T1时,将20.4gNH3和11.2gN2通入到容积为1.0L的恒容密闭容器中,0.5h达到平衡时,H2体积分数为
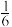 。化学反应速率v(H2)=
。化学反应速率v(H2)=(3)氮的氧化物很多,且多数不稳定,最稳定的氮氧化物是NO2.在恒容密闭容器中投入一定量的N2O4,发生反应:N2O4(g)⇌2NO2(g) △H,N2O4的平衡转化率[a(N2O4)]随温度(T1、……T4逐渐升高)的变化关系如下图:

N2O4(g)转化为NO2(g)的△H
(4)在汽车消音器管道中安装三元催化转化器,可发生反应:2NO(g)+2CO(g)
 2CO2(g)+N2(g)。在某1.0L恒容密闭容器中各通入1.0mol的CO和NO,发生上述反应,经10min达到平衡状态,容器内压强变为原来的
2CO2(g)+N2(g)。在某1.0L恒容密闭容器中各通入1.0mol的CO和NO,发生上述反应,经10min达到平衡状态,容器内压强变为原来的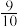 。
。①下列能判断该反应达到平衡状态的是
a.容器中,v正(CO)=v逆(NO) b.容器中的气体颜色不再变化
c.容器中气体的密度不再变化 d.容器内总分子数不再变化
②反应达到平衡后,仅将NO、CO2两种气体的浓度均增加1倍,则平衡
您最近一年使用:0次
解题方法
2 . 丙烯是一种用途广泛的有机原料,可制备多种化工产品。请回答:
已知:CH2=CHCH3与H2O发生加成反应的化学方程式如下(a、b均大于0):
Ⅰ: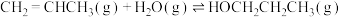
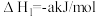
Ⅱ: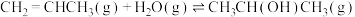

“反应Ⅰ”和“反应Ⅱ”均满足范特霍夫方程 (R为热力学常数,C为不同反应常数),其平衡常数与温度的关系如图1所示,T1℃时,在初始压强为400 kPa的恒容密闭容器中,按1:1的物质的量之比充入CH2=CHCH3(g)和H2O(g)发生反应I和反应Ⅱ,产物的分压随时间变化如图2所示:
(R为热力学常数,C为不同反应常数),其平衡常数与温度的关系如图1所示,T1℃时,在初始压强为400 kPa的恒容密闭容器中,按1:1的物质的量之比充入CH2=CHCH3(g)和H2O(g)发生反应I和反应Ⅱ,产物的分压随时间变化如图2所示:___________ 。
(2)若反应Ⅱ的熵变为△S(Ⅱ),则反应Ⅲ: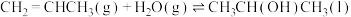 的熵变△S(Ⅲ)
的熵变△S(Ⅲ)__________ (填“>”“=”或“<”)△S(Ⅱ)。
(3)由图可知“反应Ⅰ”和“反应Ⅱ”的焓变△H1__________ (填“>”“=”或“<”)△H2。
(4)若在绝热恒容容器中发生上述反应,则下列事实能说明反应达到平衡状态的是___________(填标号)。
(5)①图2中表示CH3CH(OH)CH3的曲线为_________ (填“M”或“N”)。
②图2中CH2=CHCH3(g)的平衡转化率为___________ %。
③T1℃时,反应Ⅱ的平衡常数Kp=__________ kPa-1(Kp为以分压表示的平衡常数)。
④若其他条件不变,T1℃时,向压强为400kPa的恒压密闭容器中,充入n(CH2=CHCH3):n(H2O)=1:1的混合气体,达到新平衡时,CH3CH(OH)CH3(g)的平衡产率将___________ (填“变大”“变小”或“不变”)。
已知:CH2=CHCH3与H2O发生加成反应的化学方程式如下(a、b均大于0):
Ⅰ:
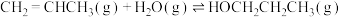
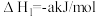
Ⅱ:
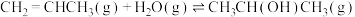

“反应Ⅰ”和“反应Ⅱ”均满足范特霍夫方程
 (R为热力学常数,C为不同反应常数),其平衡常数与温度的关系如图1所示,T1℃时,在初始压强为400 kPa的恒容密闭容器中,按1:1的物质的量之比充入CH2=CHCH3(g)和H2O(g)发生反应I和反应Ⅱ,产物的分压随时间变化如图2所示:
(R为热力学常数,C为不同反应常数),其平衡常数与温度的关系如图1所示,T1℃时,在初始压强为400 kPa的恒容密闭容器中,按1:1的物质的量之比充入CH2=CHCH3(g)和H2O(g)发生反应I和反应Ⅱ,产物的分压随时间变化如图2所示: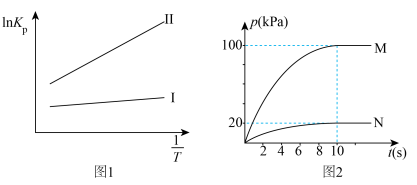
(2)若反应Ⅱ的熵变为△S(Ⅱ),则反应Ⅲ:
 的熵变△S(Ⅲ)
的熵变△S(Ⅲ)(3)由图可知“反应Ⅰ”和“反应Ⅱ”的焓变△H1
(4)若在绝热恒容容器中发生上述反应,则下列事实能说明反应达到平衡状态的是___________(填标号)。
| A.容器内气体的压强不变 |
| B.容器内温度不变 |
| C.容器内气体的密度不再改变 |
| D.容器内n(CH2=CHCH3):n(H2O)的比值不变 |
(5)①图2中表示CH3CH(OH)CH3的曲线为
②图2中CH2=CHCH3(g)的平衡转化率为
③T1℃时,反应Ⅱ的平衡常数Kp=
④若其他条件不变,T1℃时,向压强为400kPa的恒压密闭容器中,充入n(CH2=CHCH3):n(H2O)=1:1的混合气体,达到新平衡时,CH3CH(OH)CH3(g)的平衡产率将
您最近一年使用:0次
2024-03-23更新
|
675次组卷
|
5卷引用:2024届河北省张家口市高三下学期一模化学试题
2024届河北省张家口市高三下学期一模化学试题河北省沧州市2024届高三下学期一模化学试卷(已下线)题型11 反应原理综合题(25题)-2024年高考化学常考点必杀300题(新高考通用)(已下线)压轴题13?化学反应原理综合题(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)四川省雅安市天全中学2024届高三下学期模拟预测化学试题4
名校
解题方法
3 . 甲醇的用途十分广泛,主要用于有机合成、作燃料、生产农药、作良好的有机溶剂等。催化 和
和 反应可以合成甲醇,反应化学方程式为
反应可以合成甲醇,反应化学方程式为 。
。
已知:① ;
;
② 。
。
回答下列问题:
(1)写出催化 和
和 合成甲醇的热化学反应方程式:
合成甲醇的热化学反应方程式:___________ 。
(2)对于催化 和
和 合成甲醇的反应,增大压强,平衡
合成甲醇的反应,增大压强,平衡___________ (填“向左”“向右”或“不”)移动;温度升高平衡常数___________ (填“变大”“变小”或“不变”)。
(3)在相同条件下研究催化剂Ⅰ、催化剂Ⅱ对反应 的影响,在密闭容器内充入一定量
的影响,在密闭容器内充入一定量 和
和 ,部分物质的浓度c随反应时间t的变化曲线如图1所示。
,部分物质的浓度c随反应时间t的变化曲线如图1所示。

①a曲线表示___________ 。
②催化剂Ⅰ比催化剂Ⅱ催化效率___________ (填“高”“低”或“相同”),原因是___________ 。
(4)523K时,在1L恒容密闭容器中充入 和
和 ,在催化剂作用下反应合成甲醇,容器内的压强变化如下。
,在催化剂作用下反应合成甲醇,容器内的压强变化如下。
反应从开始到20min时,以 浓度表示平均反应速率
浓度表示平均反应速率
___________ ;此温度下,压强平衡常数
___________  (保留三位有效数字)。
(保留三位有效数字)。
(5)一定条件下,在3个相同的密闭容器中分别充入 和
和 ,
, 分别为1:1、1:2、1:3,CO2(g)的转化率随压强的变化关系如图2所示,曲线a的
分别为1:1、1:2、1:3,CO2(g)的转化率随压强的变化关系如图2所示,曲线a的
___________ ,原因是___________ 。

 和
和 反应可以合成甲醇,反应化学方程式为
反应可以合成甲醇,反应化学方程式为 。
。已知:①
 ;
;②
 。
。回答下列问题:
(1)写出催化
 和
和 合成甲醇的热化学反应方程式:
合成甲醇的热化学反应方程式:(2)对于催化
 和
和 合成甲醇的反应,增大压强,平衡
合成甲醇的反应,增大压强,平衡(3)在相同条件下研究催化剂Ⅰ、催化剂Ⅱ对反应
 的影响,在密闭容器内充入一定量
的影响,在密闭容器内充入一定量 和
和 ,部分物质的浓度c随反应时间t的变化曲线如图1所示。
,部分物质的浓度c随反应时间t的变化曲线如图1所示。
①a曲线表示
②催化剂Ⅰ比催化剂Ⅱ催化效率
(4)523K时,在1L恒容密闭容器中充入
 和
和 ,在催化剂作用下反应合成甲醇,容器内的压强变化如下。
,在催化剂作用下反应合成甲醇,容器内的压强变化如下。| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| 压强/MPa | 12.4 | 10.2 | 8.4 | 7.0 | 6.2 | 6.2 |
 浓度表示平均反应速率
浓度表示平均反应速率

 (保留三位有效数字)。
(保留三位有效数字)。(5)一定条件下,在3个相同的密闭容器中分别充入
 和
和 ,
, 分别为1:1、1:2、1:3,CO2(g)的转化率随压强的变化关系如图2所示,曲线a的
分别为1:1、1:2、1:3,CO2(g)的转化率随压强的变化关系如图2所示,曲线a的

您最近一年使用:0次
解题方法
4 . 甲烷在日常生活及有机合成中用途广泛,某实验小组研究甲烷在高温下气相裂解反应的原理及其应用。
已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3kJ·mol-1
②C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) ΔH2=-1323.8kJ·mol-1
③2H2(g)+O2(g)=2H2O(l) ΔH3=-571.6kJ·mol-1
(1)裂解反应2CH4(g)⇌C2H4(g)+2H2(g)的ΔH=______ kJ·mol-1。
(2)在某密闭容器中投入1molCH4(g),在不同条件下发生反应:2CH4(g)⇌C2H4(g)+2H2(g)。实验测得平衡时C2H4(g)的物质的量随温度、压强的变化如图1所示。_______ ,温度:T1____ (填“>”、“<”或“=”)T2。
②M、N、Q三点的平衡常数由大到小的顺序为_______________ 。
③M点对应的压强平衡常数Kp=________________ (以分压表示,分压=总压×物质的量分数)。
④若在某密闭容器中充入2molH2、a(a>0)molC2H4和2molCH4,在T1K、p1kPa下进行上述反应。为了使该反应逆向进行,a的范围为_____________________ 。
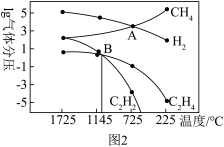
(3)该实验小组在研究过程中得出固体表面催化裂解甲烷时,几种气体平衡时分压(Pa)与温度(°C)的关系如图2所示。______________ 。
已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3kJ·mol-1
②C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) ΔH2=-1323.8kJ·mol-1
③2H2(g)+O2(g)=2H2O(l) ΔH3=-571.6kJ·mol-1
(1)裂解反应2CH4(g)⇌C2H4(g)+2H2(g)的ΔH=
(2)在某密闭容器中投入1molCH4(g),在不同条件下发生反应:2CH4(g)⇌C2H4(g)+2H2(g)。实验测得平衡时C2H4(g)的物质的量随温度、压强的变化如图1所示。

②M、N、Q三点的平衡常数由大到小的顺序为
③M点对应的压强平衡常数Kp=
④若在某密闭容器中充入2molH2、a(a>0)molC2H4和2molCH4,在T1K、p1kPa下进行上述反应。为了使该反应逆向进行,a的范围为
(3)该实验小组在研究过程中得出固体表面催化裂解甲烷时,几种气体平衡时分压(Pa)与温度(°C)的关系如图2所示。
您最近一年使用:0次
名校
解题方法
5 . 铁及其化合物在工业上有许多用途。回答下列有关问题:
(1)铁系氧化物材料在五金器材的抛光、光学仪器和玉石的磨光材料、吸波材料、半导体材料等方面得以广泛应用。在空气中加热FeCO3可制得铁系氧化物材料。已知:
①4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1648 kJ·mol-1;
②C(s)+O2(g)=CO2(g) ΔH=-393 kJ·mol-1;
③2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) ΔH=-1480 kJ·mol-1;
则在空气中加热FeCO3生成铁系氧化物Fe2O3的热化学方程式为___________ 。
(2)已知在某种含铁催化剂作用下发生下列反应:CO(g)+3H2(g)⇌CH4(g)+H2O(g) ΔH<0。一定温度下和压强条件下,把1 mol CO和3 mol H2加入到压强为p0的恒压密闭容器中,测得不同时间CO的体积分数φ(CO)如下表:
①当___________ 不再发生变化时(写出一条即可),则表明反应CO(g)+3H2(g)⇌CH4(g)+H2O(g)达到平衡。
②达到平衡时CO的转化率为___________ ;若用平衡分压代替平衡浓度,则该温度下的平衡常数K=___________ (已知:气体分压=气体总压×体积分数)。
③若下图表示该反应中CO的平衡转化率与温度、压强的关系。图中温度T1、T2、T3由高到低的顺序是___________ 。

(3)甲醇在催化剂条件下可以直接被氧化成甲酸。常温下,甲酸的电离常数Ka=1.0×10-4,20.00 mL0.1000 mol∙L-1NaOH溶液与等体积一定浓度的甲酸溶液混合,所得溶液中c(HCOOH)=c(HCOO-),则c(OH-)=___________ ,溶液中离子浓度由大到小的顺序为___________ 。
(1)铁系氧化物材料在五金器材的抛光、光学仪器和玉石的磨光材料、吸波材料、半导体材料等方面得以广泛应用。在空气中加热FeCO3可制得铁系氧化物材料。已知:
①4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1648 kJ·mol-1;
②C(s)+O2(g)=CO2(g) ΔH=-393 kJ·mol-1;
③2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) ΔH=-1480 kJ·mol-1;
则在空气中加热FeCO3生成铁系氧化物Fe2O3的热化学方程式为
(2)已知在某种含铁催化剂作用下发生下列反应:CO(g)+3H2(g)⇌CH4(g)+H2O(g) ΔH<0。一定温度下和压强条件下,把1 mol CO和3 mol H2加入到压强为p0的恒压密闭容器中,测得不同时间CO的体积分数φ(CO)如下表:
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| φ(CO) | 0.250 | 0.230 | 0.214 | 0.202 | 0.200 | 0.200 |
②达到平衡时CO的转化率为
③若下图表示该反应中CO的平衡转化率与温度、压强的关系。图中温度T1、T2、T3由高到低的顺序是

(3)甲醇在催化剂条件下可以直接被氧化成甲酸。常温下,甲酸的电离常数Ka=1.0×10-4,20.00 mL0.1000 mol∙L-1NaOH溶液与等体积一定浓度的甲酸溶液混合,所得溶液中c(HCOOH)=c(HCOO-),则c(OH-)=
您最近一年使用:0次
解题方法
6 . 砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图:______________ 。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式:___________________ 。
(3)已知:As(s)+ H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+ O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
2As(s)+ O2(g)=As2O5(s) ΔH3
O2(g)=As2O5(s) ΔH3
则反应As2O5(s)+3H2O(l)=2H3AsO4(s)的ΔH=___________ 。
(4)298 K时,将20mL 3x mol·L-1Na2AsO3、20mL 3x mol·L-1I2和20 mL NaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-(aq)=AsO43- (aq)+2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。
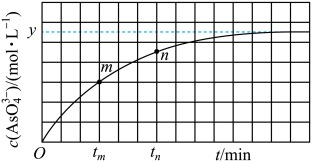
①下列可判断反应达到平衡的是________ (填选项字母)。
a.溶液的pH不再变化 b.v(I-)=2v(AsO33-)
c.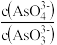 不再变化 d.c(I-)=y mol·L-1
不再变化 d.c(I-)=y mol·L-1
②tm时,v正______ v逆(填“大于”“小于”或“等于”)。
③tm时v逆____ tn时v逆(填“大于”“小于”或“等于”)。
(1)画出砷的原子结构示意图:
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式:
(3)已知:As(s)+
 H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1H2(g)+
 O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2 2As(s)+
 O2(g)=As2O5(s) ΔH3
O2(g)=As2O5(s) ΔH3则反应As2O5(s)+3H2O(l)=2H3AsO4(s)的ΔH=
(4)298 K时,将20mL 3x mol·L-1Na2AsO3、20mL 3x mol·L-1I2和20 mL NaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-(aq)=AsO43- (aq)+2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。

①下列可判断反应达到平衡的是
a.溶液的pH不再变化 b.v(I-)=2v(AsO33-)
c.
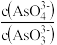 不再变化 d.c(I-)=y mol·L-1
不再变化 d.c(I-)=y mol·L-1②tm时,v正
③tm时v逆
您最近一年使用:0次
名校
解题方法
7 . 甲醛在木材加工、医药等方面有重要用途。甲醇直接脱氢是工业上合成甲醛的新方法,制备过程涉及的主要反应如下:
反应I:CH3OH(g) HCHO(g)+H2(g) △H1=+85.2kJ·mol-1
HCHO(g)+H2(g) △H1=+85.2kJ·mol-1
反应II:CH3OH(g)+1/2O2(1) HCHO(g)+H2O(g) △H2
HCHO(g)+H2O(g) △H2
反应III:H2(g)+1/2O2(g) H2O(g) △H3=-241.8kJ·mol-1
H2O(g) △H3=-241.8kJ·mol-1
副反应:
反应IV:CH3OH(g)+O2(g) CO(g)+2H2O(g) △H4=-393.0kJ·mol-1
CO(g)+2H2O(g) △H4=-393.0kJ·mol-1
(1)计算反应Ⅱ的反应热△H2=____________________________________________ 。
(2)750K下,在恒容密闭容器中,发生反应CH3OH(g) HCHO(g)+H2(g),若起始压强为P0,达到平衡转化率为α,则平衡时的总压强P平=
HCHO(g)+H2(g),若起始压强为P0,达到平衡转化率为α,则平衡时的总压强P平=___________ (用含P0和α的式子表示);当P0=101kPa,测得α=50.0%,计算反应平衡常数Kp=___________ kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
(3)Na2CO3是甲醇脱氢制甲醛的催化剂,有研究指出,催化反应的部分机理如下:
历程i:CH3OH→H+·CH2OH
历程ⅱ:·CH2OH→·H+HCHO
历程ⅲ:·CH2OH→3·H+CO
历程iv:·H+·H→H2
下图表示一定条件下温度对碳酸钠催化脱氢性能的影响,回答下列问题:
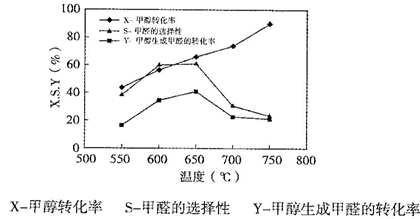
①从平衡角度解析550℃-650℃甲醇生成甲醛的转化率随温度升高的原因___________ ;
②反应历程i的活化能___________ (填“>、“<”或“=”)CH3OH(g) HCHO(g)+H2(g)活化能。
HCHO(g)+H2(g)活化能。
③650℃~750℃,反应历程ii的速率___________ (填“>”、“<”或“=”)反应历程ⅲ的速率。
(4)吹脱是处理甲醛废水的一种工艺,吹脱速率可用方程v=0.0423c(mg·L-1·h-1)表示(其中c为甲醛浓度),下表为常温下甲醛的浓度随吹脱时间变化数据。
则当甲醛浓度为2000mg/L时,其吹脱速率v=___________ mg·L-1·h-1,分析上表数据,起始浓度为10000mg/L,当甲醛浓度降为5000mg/L,吹脱时间为___________ h。
反应I:CH3OH(g)
 HCHO(g)+H2(g) △H1=+85.2kJ·mol-1
HCHO(g)+H2(g) △H1=+85.2kJ·mol-1反应II:CH3OH(g)+1/2O2(1)
 HCHO(g)+H2O(g) △H2
HCHO(g)+H2O(g) △H2反应III:H2(g)+1/2O2(g)
 H2O(g) △H3=-241.8kJ·mol-1
H2O(g) △H3=-241.8kJ·mol-1副反应:
反应IV:CH3OH(g)+O2(g)
 CO(g)+2H2O(g) △H4=-393.0kJ·mol-1
CO(g)+2H2O(g) △H4=-393.0kJ·mol-1(1)计算反应Ⅱ的反应热△H2=
(2)750K下,在恒容密闭容器中,发生反应CH3OH(g)
 HCHO(g)+H2(g),若起始压强为P0,达到平衡转化率为α,则平衡时的总压强P平=
HCHO(g)+H2(g),若起始压强为P0,达到平衡转化率为α,则平衡时的总压强P平=(3)Na2CO3是甲醇脱氢制甲醛的催化剂,有研究指出,催化反应的部分机理如下:
历程i:CH3OH→H+·CH2OH
历程ⅱ:·CH2OH→·H+HCHO
历程ⅲ:·CH2OH→3·H+CO
历程iv:·H+·H→H2
下图表示一定条件下温度对碳酸钠催化脱氢性能的影响,回答下列问题:

①从平衡角度解析550℃-650℃甲醇生成甲醛的转化率随温度升高的原因
②反应历程i的活化能
 HCHO(g)+H2(g)活化能。
HCHO(g)+H2(g)活化能。③650℃~750℃,反应历程ii的速率
(4)吹脱是处理甲醛废水的一种工艺,吹脱速率可用方程v=0.0423c(mg·L-1·h-1)表示(其中c为甲醛浓度),下表为常温下甲醛的浓度随吹脱时间变化数据。
| 浓度(mg/L) | 10000 | 8000 | 4000 | 2000 | 1000 |
| 吹脱时间(h) | 0 | 7 | 23 | 39 | 55 |
则当甲醛浓度为2000mg/L时,其吹脱速率v=
您最近一年使用:0次
2019-02-05更新
|
795次组卷
|
3卷引用:河北省衡水中学2019—2020学年度高三下学期3月16日满分练理综测试 化学试题
解题方法
8 . 甲醛(HCHO)俗称蚁醛,是一种重要的有机原料。
I.利用甲醇(CH3OH)制备甲醛
脱氢法:CH3OH(g)=HCHO(g)+H2(g) ∆H1 = +92.09kJ/mol
氧化法:CH3OH(g) + O2(g)=HCHO(g)+H2O(g) ∆H2
O2(g)=HCHO(g)+H2O(g) ∆H2
(1)已知:2H2(g)+O2(g)=2H2O(g) ∆H3=-483.64 kJ/mol,则∆H2=_______ 。
(2)与脱氢法相比,氧化法在热力学上趋势较大,其原因为_______________ 。
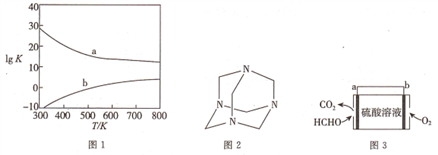
(3)图1为甲醇制备甲醛反应的lgK(K为平衡常数)随温度(T)的变化曲线。曲线____ (填“a”或“b”)对应脱氢法,判断依据为_________________ 。
II.甲醛的用途
(4)将甲醛水溶液与氨水混合蒸发可制得乌洛托品(结构简式如图2),该物质在医药等工业中有广泛用途。若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为_______ 。
(5)将甲醛水溶液与硫酸镍(NiSO4)混合,可用于化学镀镍。若反应过程中有CO2产生,则该反应的离子方程式为____________________ 。
Ⅲ.甲醛的检测
(6)室内甲醛超标会危害人体健康,通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的原理如图3所示,则b极的电极反应式为_________ ,当电路中转移4×10-4 mol电子时,传感器内参加反应的HCHO为_______ mg。
I.利用甲醇(CH3OH)制备甲醛
脱氢法:CH3OH(g)=HCHO(g)+H2(g) ∆H1 = +92.09kJ/mol
氧化法:CH3OH(g) +
 O2(g)=HCHO(g)+H2O(g) ∆H2
O2(g)=HCHO(g)+H2O(g) ∆H2(1)已知:2H2(g)+O2(g)=2H2O(g) ∆H3=-483.64 kJ/mol,则∆H2=
(2)与脱氢法相比,氧化法在热力学上趋势较大,其原因为
(3)图1为甲醇制备甲醛反应的lgK(K为平衡常数)随温度(T)的变化曲线。曲线

II.甲醛的用途
(4)将甲醛水溶液与氨水混合蒸发可制得乌洛托品(结构简式如图2),该物质在医药等工业中有广泛用途。若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为
(5)将甲醛水溶液与硫酸镍(NiSO4)混合,可用于化学镀镍。若反应过程中有CO2产生,则该反应的离子方程式为
Ⅲ.甲醛的检测
(6)室内甲醛超标会危害人体健康,通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的原理如图3所示,则b极的电极反应式为
您最近一年使用:0次
2017-12-27更新
|
837次组卷
|
5卷引用:河北省沧州市普通高中高三上学期教学质量监测(联考)化学试题
河北省沧州市普通高中高三上学期教学质量监测(联考)化学试题(已下线)考点06 化学能与热能-2020年高考化学命题预测与模拟试题分类精编北京市2020届高三化学高考模拟试题(等级考试模拟试题)北京市2020届高三高考模拟试题 (等级考试模拟试题)(已下线)专题15 化学反应原理大题不丢分-2021年高考化学必做热点专题
9 . 镁是海水中含量较多的金属,镁合金及其镁的化合物用途非常广泛。
(1)Mg2Ni是一种储氢合金,已知:
Mg(s)+H2(g)=MgH2(S) △H1=- 74.5kJ·mol-1
Mg2Ni(s)+2H2(g)=Mg2NiH4(s) △H2=- 64.4kJ·mol-l
则:Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s)的△H3=__________ .
(2)某科研小组用水氯镁石(主要成分为MgCl2·6H2O)制备金属镁工艺的关键流程如下:

科研小组将MgCl2·6H2O在氩气气氛中进行热重分析,结果如下图(TG表示残留固体质量占原样品总质量的百分数)。


①图中AB线段为“一段脱水”,试确定B点对应固体物质的化学式_________________ ;图中BC线段为“二段脱水”,在实验中通入H2和Cl2燃烧产物的目的是_______________ 。
②该工艺中,可以循环使用的物质有_____________ 。
(3)CH3MgCl是一种重要的有机合成剂,其中镁的化合价是________________ ,该化合物水解时生成甲烷、氯化镁和氢氧化镁,请写出该反应的化学方程式__________________ 。
(4)储氢材料Mg(AIH4)2在110~200℃的反应为:Mg(AIH4)2=MgH2+2Al+3H2↑;每转移3 mol电子生成Al的质量为_______________ 。
(5)“镁一次氯酸盐”燃料电池的装置如右图所示,该电池的正极反应式为_______________ 。
(1)Mg2Ni是一种储氢合金,已知:
Mg(s)+H2(g)=MgH2(S) △H1=- 74.5kJ·mol-1
Mg2Ni(s)+2H2(g)=Mg2NiH4(s) △H2=- 64.4kJ·mol-l
则:Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s)的△H3=
(2)某科研小组用水氯镁石(主要成分为MgCl2·6H2O)制备金属镁工艺的关键流程如下:

科研小组将MgCl2·6H2O在氩气气氛中进行热重分析,结果如下图(TG表示残留固体质量占原样品总质量的百分数)。


①图中AB线段为“一段脱水”,试确定B点对应固体物质的化学式
②该工艺中,可以循环使用的物质有
(3)CH3MgCl是一种重要的有机合成剂,其中镁的化合价是
(4)储氢材料Mg(AIH4)2在110~200℃的反应为:Mg(AIH4)2=MgH2+2Al+3H2↑;每转移3 mol电子生成Al的质量为
(5)“镁一次氯酸盐”燃料电池的装置如右图所示,该电池的正极反应式为
您最近一年使用:0次
2016-12-09更新
|
657次组卷
|
2卷引用:2015届河北省唐山市高三上学期期末理综化学试卷



