名校
解题方法
1 . 甲烷( )在生产生活中用途广泛,常用作燃料。利用
)在生产生活中用途广泛,常用作燃料。利用 、
、 与
与 在催化剂作用下可以合成甲烷。回答下列问题:
在催化剂作用下可以合成甲烷。回答下列问题:
(1)实验测得 与
与 反应生成
反应生成 和
和 的反应中,每生成
的反应中,每生成 (标准状况)
(标准状况) ,放出热量
,放出热量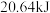 ,则该反应的热化学方程式为
,则该反应的热化学方程式为______________________ 。
(2)已知有关物质的化学键键能数据如下:
试计算反应 的焓变等于
的焓变等于___________ 。
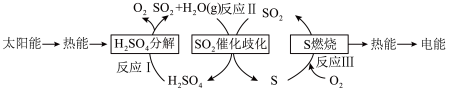
(3)研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储,过程如下:_______________ 。
 (液)分解成气态物质需要吸收的能量是
(液)分解成气态物质需要吸收的能量是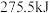 ,硫的燃烧热为
,硫的燃烧热为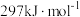 ,则反应Ⅱ的热化学方程式为
,则反应Ⅱ的热化学方程式为___________ 。
(4)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。下图为通过光电转化原理以廉价原料制备新产品的示意图。写出光电转化过程的化学反应方程式:______________ 。
 )在生产生活中用途广泛,常用作燃料。利用
)在生产生活中用途广泛,常用作燃料。利用 、
、 与
与 在催化剂作用下可以合成甲烷。回答下列问题:
在催化剂作用下可以合成甲烷。回答下列问题:(1)实验测得
 与
与 反应生成
反应生成 和
和 的反应中,每生成
的反应中,每生成 (标准状况)
(标准状况) ,放出热量
,放出热量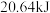 ,则该反应的热化学方程式为
,则该反应的热化学方程式为(2)已知有关物质的化学键键能数据如下:
化学链 |
|
|
|
|
|
键能/ | 436 | 343 | 805 | 413 | 465 |
 的焓变等于
的焓变等于(3)研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储,过程如下:
 (液)分解成气态物质需要吸收的能量是
(液)分解成气态物质需要吸收的能量是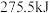 ,硫的燃烧热为
,硫的燃烧热为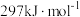 ,则反应Ⅱ的热化学方程式为
,则反应Ⅱ的热化学方程式为(4)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。下图为通过光电转化原理以廉价原料制备新产品的示意图。写出光电转化过程的化学反应方程式:

您最近一年使用:0次
名校
2 . 铅及其化合物广泛用于蓄电池、机械制造、电缆护防等行业。
(1)已知:
① 2CH3OH(1) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1 = – 1275.6 kJ/mol
② 2CO(g) + O2(g) = 2CO2(g) ΔH2 = – 566.0 kJ/mol
③ H2O(g) = H2O(1) ΔH3 = – 44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:_______ 。
(2)利用电解法也可制得金属铅。将PbO溶解在HCl和NaCl的混合溶液中,得到含[PbC14]2-的电解液。用惰性电极电解Na2PbCl4溶液制得金属Pb,装置如下图所示。
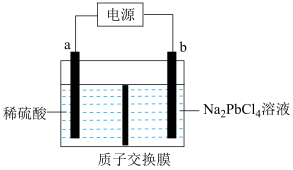
a电极的名称是_______ ,b电极的电极反应式为_______ ,该生产过程中可以循环利用的物质是_______ 。
(3)铅蓄电池是一种用途广泛的二次电池。铅蓄电池的电池反应通常表示如下: Pb+PbO2+2H2SO4 2PbSO4 +2H2O。铅蓄电池充电时,二氧化铅电极应与外接电源的
2PbSO4 +2H2O。铅蓄电池充电时,二氧化铅电极应与外接电源的_______ (填“正极”或“负极”)相连接,该电极的电极反应式为_______ 。
(4)以铂阳极和石墨阴极设计电解池,通过电解NH4HSO4溶液产生(NH4)2S2O8,再与水反应得到H2O2,其中生成的NH4HSO4可以循环使用。
①阳极的电极反应式是_______
②制备H2O2的总反应方程式是_______ 。
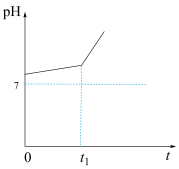
(5)用惰性电极电解含有NaHCO3的NaCl溶液,假设电解过程中产生的气体全部逸出,测得溶液pH变化如图所示。则在0→t1时间内,阳极反应式为_______ ,溶液pH升高比较缓慢的原因是(用离子方程式回答)_______ 。
(1)已知:
① 2CH3OH(1) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1 = – 1275.6 kJ/mol
② 2CO(g) + O2(g) = 2CO2(g) ΔH2 = – 566.0 kJ/mol
③ H2O(g) = H2O(1) ΔH3 = – 44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(2)利用电解法也可制得金属铅。将PbO溶解在HCl和NaCl的混合溶液中,得到含[PbC14]2-的电解液。用惰性电极电解Na2PbCl4溶液制得金属Pb,装置如下图所示。

a电极的名称是
(3)铅蓄电池是一种用途广泛的二次电池。铅蓄电池的电池反应通常表示如下: Pb+PbO2+2H2SO4
 2PbSO4 +2H2O。铅蓄电池充电时,二氧化铅电极应与外接电源的
2PbSO4 +2H2O。铅蓄电池充电时,二氧化铅电极应与外接电源的(4)以铂阳极和石墨阴极设计电解池,通过电解NH4HSO4溶液产生(NH4)2S2O8,再与水反应得到H2O2,其中生成的NH4HSO4可以循环使用。
①阳极的电极反应式是
②制备H2O2的总反应方程式是
(5)用惰性电极电解含有NaHCO3的NaCl溶液,假设电解过程中产生的气体全部逸出,测得溶液pH变化如图所示。则在0→t1时间内,阳极反应式为

您最近一年使用:0次
名校
解题方法
3 . 甲醇是一种可再生能源,用途广泛。请回答下列问题:
(1)一种用CO2生产甲醇燃料的反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH=-akJ•mol-1。
已知:CH3OH(g)=CH3OH(l) ΔH=-bkJ•mol-1;
2H2(g)+O2(g)=2H2O(g) ΔH=-ckJ•mol-1;
H2O(g)=H2O(l) ΔH=-dkJ•mol-1。
则表示CH3OH(l)摩尔燃烧焓的热化学方程式为________ 。
(2)用如图所示装置研究有关电化学问题,当闭合该装置的电键K时,观察到电流计的指针发生了偏转。请回答下列问题:
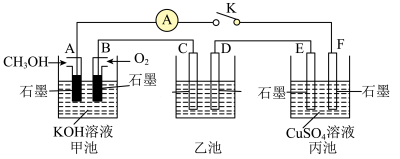
①A电极的电极反应式为________ ,C电极的电势________ (填“低于”或“高于”)D电极的电势。
②若在乙池中实现铁表面镀银,则D电极材料为________ ,乙池中的溶液为________ 。
③丙池中装有200mL1mol•L-1硫酸铜溶液,若B电极消耗3.36L(标准状况)气体,若要使电解质溶液恢复到电解前的状态,应加入________ (填字母)。
A.CuO B.Cu(OH)2 C.CuCO3 D.Cu2(OH)2CO3
(3)某研究者分别以甲醇和汽油做燃料,实验测得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如图所示。

根据图像分析,与汽油相比,甲醇作为燃料的优点是________ 。
(1)一种用CO2生产甲醇燃料的反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH=-akJ•mol-1。
已知:CH3OH(g)=CH3OH(l) ΔH=-bkJ•mol-1;
2H2(g)+O2(g)=2H2O(g) ΔH=-ckJ•mol-1;
H2O(g)=H2O(l) ΔH=-dkJ•mol-1。
则表示CH3OH(l)摩尔燃烧焓的热化学方程式为
(2)用如图所示装置研究有关电化学问题,当闭合该装置的电键K时,观察到电流计的指针发生了偏转。请回答下列问题:

①A电极的电极反应式为
②若在乙池中实现铁表面镀银,则D电极材料为
③丙池中装有200mL1mol•L-1硫酸铜溶液,若B电极消耗3.36L(标准状况)气体,若要使电解质溶液恢复到电解前的状态,应加入
A.CuO B.Cu(OH)2 C.CuCO3 D.Cu2(OH)2CO3
(3)某研究者分别以甲醇和汽油做燃料,实验测得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如图所示。

根据图像分析,与汽油相比,甲醇作为燃料的优点是
您最近一年使用:0次
解题方法
4 .  的资源化利用意义重大,其主要产品——甲醇可用于生产二甲醚,二甲醚在日用化工、制药、农药、染料、涂料等方面有广泛的用途。
的资源化利用意义重大,其主要产品——甲醇可用于生产二甲醚,二甲醚在日用化工、制药、农药、染料、涂料等方面有广泛的用途。
 催化加氢制甲醇主反应:
催化加氢制甲醇主反应:

副反应:

(1)已知
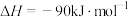 则
则
_______ 
(2)在 加氢制甲醇的体系中,下列说法错误的是
加氢制甲醇的体系中,下列说法错误的是_______
a.增大初始投料比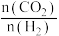 ,有利于提高
,有利于提高 的转化率
的转化率
b.当气体的平均摩尔质量保持不变时,说明反应体系已达平衡
c.平衡后,压缩容器体积,主反应平衡正向移动,副反应平衡不动
d.选用合适的催化剂可提高 的平衡转化率
的平衡转化率
(3)在密闭容器中,将物质的量之比为1∶3的 和
和 按一定流速通过反应器,
按一定流速通过反应器, 的平衡转化率和甲醇的选择性[甲醇的选择性
的平衡转化率和甲醇的选择性[甲醇的选择性 ]随温度的变化如图所示:
]随温度的变化如图所示:

①表示 选择性的是
选择性的是_______ ,290℃—360℃时催化剂活性受温度影响不大,说明290℃后曲线b升高的原因_______ 。
②在恒温恒压条件下达到平衡时,若 的转化率为40%,
的转化率为40%, 的选择性为75%,副反应的平衡常数
的选择性为75%,副反应的平衡常数
_______ (结果保留两位有效数字)(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)甲醇脱水可制得二甲醚:
 。实验测得:
。实验测得: ,
, ,
, 、
、 为速率常数。
为速率常数。 温度下,向2L恒容密闭容器中加入
温度下,向2L恒容密闭容器中加入 ,10min时达到平衡,
,10min时达到平衡, 的体积分数为25%,
的体积分数为25%, 平均反应速率为
平均反应速率为_______  ,当温度变为
,当温度变为 时,
时, ,则
,则
_______  (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。
 的资源化利用意义重大,其主要产品——甲醇可用于生产二甲醚,二甲醚在日用化工、制药、农药、染料、涂料等方面有广泛的用途。
的资源化利用意义重大,其主要产品——甲醇可用于生产二甲醚,二甲醚在日用化工、制药、农药、染料、涂料等方面有广泛的用途。 催化加氢制甲醇主反应:
催化加氢制甲醇主反应:

副反应:


(1)已知

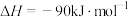 则
则

(2)在
 加氢制甲醇的体系中,下列说法错误的是
加氢制甲醇的体系中,下列说法错误的是a.增大初始投料比
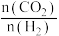 ,有利于提高
,有利于提高 的转化率
的转化率b.当气体的平均摩尔质量保持不变时,说明反应体系已达平衡
c.平衡后,压缩容器体积,主反应平衡正向移动,副反应平衡不动
d.选用合适的催化剂可提高
 的平衡转化率
的平衡转化率(3)在密闭容器中,将物质的量之比为1∶3的
 和
和 按一定流速通过反应器,
按一定流速通过反应器, 的平衡转化率和甲醇的选择性[甲醇的选择性
的平衡转化率和甲醇的选择性[甲醇的选择性 ]随温度的变化如图所示:
]随温度的变化如图所示:
①表示
 选择性的是
选择性的是②在恒温恒压条件下达到平衡时,若
 的转化率为40%,
的转化率为40%, 的选择性为75%,副反应的平衡常数
的选择性为75%,副反应的平衡常数
(4)甲醇脱水可制得二甲醚:
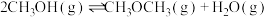
 。实验测得:
。实验测得: ,
, ,
, 、
、 为速率常数。
为速率常数。 温度下,向2L恒容密闭容器中加入
温度下,向2L恒容密闭容器中加入 ,10min时达到平衡,
,10min时达到平衡, 的体积分数为25%,
的体积分数为25%, 平均反应速率为
平均反应速率为 ,当温度变为
,当温度变为 时,
时, ,则
,则
 (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。
您最近一年使用:0次
5 . 甲烷在日常生活及有机合成中用途广泛,某研究小组研究甲烷在高温下气相裂解反应的原理及其应用。
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3kJ•mol-1
C2H2(g)+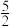 O2(g)=2CO2(g)+H2O(l) ΔH2=-1299.6kJ•mol-1
O2(g)=2CO2(g)+H2O(l) ΔH2=-1299.6kJ•mol-1
2H2(g)+O2(g)=2H2O(l) ΔH3=-571.6kJ•mol-1
则甲烷气相裂解反应:2CH4(g) C2H2(g)+3H2(g)的ΔH=
C2H2(g)+3H2(g)的ΔH=_____ 。
(2)该研究小组在研究过程中得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图所示。

①T1℃时,向2L恒容密闭容器中充入0.3molCH4,只发生反应2CH4(g) C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应达到平衡时,CH4的转化率为
C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应达到平衡时,CH4的转化率为____ 。
②对上述平衡状态,若改变温度至T2℃,经10s后再次达到平衡,c(CH4)=2c(C2H4),则10s内C2H4的平均反应速率v(C2H4)=___ ,上述变化过程中T1____ (填“>”或“<”)T2,判断理由是____ 。
③在①建立的平衡状态基础上,其他条件不变,再通入0.5molCH4,平衡将____ (填“不移动”、“正向移动”或“逆向移动”),与原平衡相比,CH4的平衡转化率____ (填“不变”、“变大”或“变小”)。
(3)若容器中发生反应2CH4(g) C2H2(g)+3H2(g),计算该反应在图中A点温度时的平衡常数Kp=
C2H2(g)+3H2(g),计算该反应在图中A点温度时的平衡常数Kp=____ Pa2(用平衡分压代替平衡浓度)。
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3kJ•mol-1
C2H2(g)+
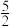 O2(g)=2CO2(g)+H2O(l) ΔH2=-1299.6kJ•mol-1
O2(g)=2CO2(g)+H2O(l) ΔH2=-1299.6kJ•mol-12H2(g)+O2(g)=2H2O(l) ΔH3=-571.6kJ•mol-1
则甲烷气相裂解反应:2CH4(g)
 C2H2(g)+3H2(g)的ΔH=
C2H2(g)+3H2(g)的ΔH=(2)该研究小组在研究过程中得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图所示。

①T1℃时,向2L恒容密闭容器中充入0.3molCH4,只发生反应2CH4(g)
 C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应达到平衡时,CH4的转化率为
C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应达到平衡时,CH4的转化率为②对上述平衡状态,若改变温度至T2℃,经10s后再次达到平衡,c(CH4)=2c(C2H4),则10s内C2H4的平均反应速率v(C2H4)=
③在①建立的平衡状态基础上,其他条件不变,再通入0.5molCH4,平衡将
(3)若容器中发生反应2CH4(g)
 C2H2(g)+3H2(g),计算该反应在图中A点温度时的平衡常数Kp=
C2H2(g)+3H2(g),计算该反应在图中A点温度时的平衡常数Kp=
您最近一年使用:0次
2022-10-19更新
|
601次组卷
|
3卷引用:山东师范大学附属中学2022-2023学年高二上学期第一次月考化学试题
6 . 甲烷(CH4)在生产生活中用途广泛,常用作燃料。利用CO、CO2与H2在催化剂作用下可以合成甲烷。回答下列问题:
(1)实验测得CO(g)与H2(g)反应生成CH4(g)和H2O(g)的反应中,每生成2.24L(标准状况)CH4(g),放出热量20.64kJ,则该反应的热化学方程式为_______ 。
(2)已知有关物质的化学键键能数据如下:
试计算反应CO2(g)+4H2(g)=CH4(g)+2H2O(g)的焓变等于_______ 。
(3)某研究小组采用甲烷燃料电池作为电源,电解饱和氯化钠溶液的原理如图所示。
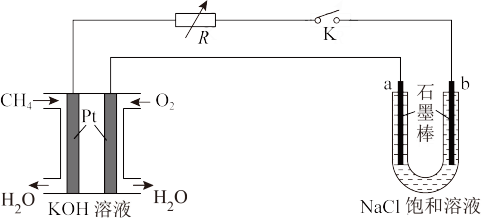
①甲烷燃料电池的负极反应为_______ 。
②闭合K后,a、b电极上均有气体产生,其中b电极的产物是_______ ,a电极的电极反应式为_______ 。
③若通入1LCH4(标准状况),且反应完全,则U型管中OH-的浓度理论上等于_______ mol·L-1(假设饱和氯化钠溶液的体积为VL,且通电前后溶液体积变化忽略不计)。
(1)实验测得CO(g)与H2(g)反应生成CH4(g)和H2O(g)的反应中,每生成2.24L(标准状况)CH4(g),放出热量20.64kJ,则该反应的热化学方程式为
(2)已知有关物质的化学键键能数据如下:
| 化学键 | H-H | C-O | C=O | C-H | H-O |
| 键能/kJ·mol-1 | 436 | 343 | 805 | 413 | 465 |
(3)某研究小组采用甲烷燃料电池作为电源,电解饱和氯化钠溶液的原理如图所示。

①甲烷燃料电池的负极反应为
②闭合K后,a、b电极上均有气体产生,其中b电极的产物是
③若通入1LCH4(标准状况),且反应完全,则U型管中OH-的浓度理论上等于
您最近一年使用:0次
名校
解题方法
7 .  是导致温室效应的主要气体,为减少
是导致温室效应的主要气体,为减少 对环境造成的影响,可采用以下方法将其资源化利用。回答下列问题:
对环境造成的影响,可采用以下方法将其资源化利用。回答下列问题:
(1)工业上用 与
与 反应合成甲醇(a和b均大于零):
反应合成甲醇(a和b均大于零):
①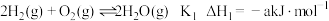 ;
;
②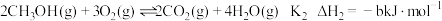 ;
;
③ 。
。
则
_______ (用含 的代数式表示),
的代数式表示),
_______  (用含a、b的代数式表示)。
(用含a、b的代数式表示)。
(2) 催化加氢合成乙烯:
催化加氢合成乙烯:
往某恒容密闭容器中,充入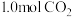 和
和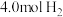 ,发生反应:
,发生反应: ,当反应达到平衡时,测得
,当反应达到平衡时,测得 的物质的量分数随温度的变化曲线如图所示:
的物质的量分数随温度的变化曲线如图所示:

①对于 ,下列说法正确的是
,下列说法正确的是_______ (填标号)。
A.该反应中反应物的总键能小于生成物的总键能
B.升高温度,该反应的 的值增大
的值增大
C.加入合适的催化剂,有利于提高 的转化率
的转化率
D.当混合气体的相对分子质量不再随时间而改变,则该反应达到平衡
②若反应达到平衡时,a点时容器内气体的总压强为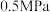 ,则该反应的平衡常数
,则该反应的平衡常数
_______  (列出计算式即可,用分压表示,分压=总压×物质的量分数)。
(列出计算式即可,用分压表示,分压=总压×物质的量分数)。
(3)草酸锌可应用于有机合成、电子工业等。工业上制取 的原理如图所示(电解液不参加反应):
的原理如图所示(电解液不参加反应):
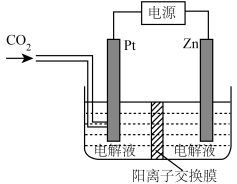
①该电池属于_______ (填“电解池”或“原电池”)。
②Pt电极上的电极反应式为_______ 。
③每转移0.2mol电子,此时消耗 的体积为
的体积为_______ L(标准状况下)。
(4) 用途广泛,写出基于其物理性质的一种用途:
用途广泛,写出基于其物理性质的一种用途:_______ 。
 是导致温室效应的主要气体,为减少
是导致温室效应的主要气体,为减少 对环境造成的影响,可采用以下方法将其资源化利用。回答下列问题:
对环境造成的影响,可采用以下方法将其资源化利用。回答下列问题:(1)工业上用
 与
与 反应合成甲醇(a和b均大于零):
反应合成甲醇(a和b均大于零):①
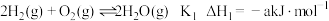 ;
;②
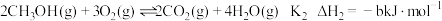 ;
;③
 。
。则

 的代数式表示),
的代数式表示),
 (用含a、b的代数式表示)。
(用含a、b的代数式表示)。(2)
 催化加氢合成乙烯:
催化加氢合成乙烯:往某恒容密闭容器中,充入
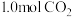 和
和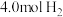 ,发生反应:
,发生反应: ,当反应达到平衡时,测得
,当反应达到平衡时,测得 的物质的量分数随温度的变化曲线如图所示:
的物质的量分数随温度的变化曲线如图所示:
①对于
 ,下列说法正确的是
,下列说法正确的是A.该反应中反应物的总键能小于生成物的总键能
B.升高温度,该反应的
 的值增大
的值增大C.加入合适的催化剂,有利于提高
 的转化率
的转化率D.当混合气体的相对分子质量不再随时间而改变,则该反应达到平衡
②若反应达到平衡时,a点时容器内气体的总压强为
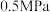 ,则该反应的平衡常数
,则该反应的平衡常数
 (列出计算式即可,用分压表示,分压=总压×物质的量分数)。
(列出计算式即可,用分压表示,分压=总压×物质的量分数)。(3)草酸锌可应用于有机合成、电子工业等。工业上制取
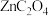 的原理如图所示(电解液不参加反应):
的原理如图所示(电解液不参加反应):
①该电池属于
②Pt电极上的电极反应式为
③每转移0.2mol电子,此时消耗
 的体积为
的体积为(4)
 用途广泛,写出基于其物理性质的一种用途:
用途广泛,写出基于其物理性质的一种用途:
您最近一年使用:0次
名校
解题方法
8 . 过氧化氢( )有广泛的用途。回答下列问题:
)有广泛的用途。回答下列问题:
(1)已知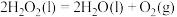
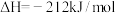

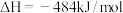

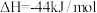
①请写出 与
与 反应生成
反应生成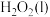 的热化学方程式
的热化学方程式_______ 。
②请分析该反应在_______ 条件下能自发进行(填“高温”或“低温”)。
(2)工业上用电解硫酸氢铵水溶液的方法制备过氧化氢,其反应原理为:
 ,
, 水解得
水解得
回答下列问题:
①电解硫酸氢铵溶液时,阳极的电极反应式为:_______ 。
②请写出 水解生成
水解生成 的离子方程式
的离子方程式_______ ,把 从产物中分离出来的操作名称为
从产物中分离出来的操作名称为_______ 。
 )有广泛的用途。回答下列问题:
)有广泛的用途。回答下列问题:(1)已知
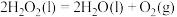
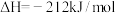

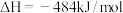

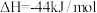
①请写出
 与
与 反应生成
反应生成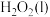 的热化学方程式
的热化学方程式②请分析该反应在
(2)工业上用电解硫酸氢铵水溶液的方法制备过氧化氢,其反应原理为:
 ,
, 水解得
水解得
回答下列问题:
①电解硫酸氢铵溶液时,阳极的电极反应式为:
②请写出
 水解生成
水解生成 的离子方程式
的离子方程式 从产物中分离出来的操作名称为
从产物中分离出来的操作名称为
您最近一年使用:0次
2022-11-11更新
|
239次组卷
|
2卷引用:山东省菏泽市郓城第一中学2022-2023学年高二上学期期中考试化学试题
解题方法
9 . 碘及其化合物有着多方面的用途,用化学反应原理研究碘及其化合物有重要意义。回答下列问题:
(1)一碘甲烷(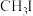 )热裂解可制取乙烯等低碳烯烃化工原料。一碘甲烷(
)热裂解可制取乙烯等低碳烯烃化工原料。一碘甲烷(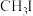 )热裂解时主要反应有:
)热裂解时主要反应有:
反应Ⅰ

反应Ⅱ

反应Ⅲ
 (298K)
(298K)
实验测得,反应Ⅰ、Ⅱ的 随温度的变化如图1所示,在体积为1L的密闭容器中,起始投料1mol
随温度的变化如图1所示,在体积为1L的密闭容器中,起始投料1mol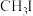 (g),反应温度对平衡体系中乙烯、丙烯和丁烯物质的量分数的影响如图2所示。
(g),反应温度对平衡体系中乙烯、丙烯和丁烯物质的量分数的影响如图2所示。

①298K时,反应
 ;
;
___________  。
。
②当体系温度高于600K时,乙烯的物质量分数随温度升高而显著增加的可能原因是___________ 。
③若维持体系温度为715K,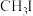 (g)的平衡转化率为
(g)的平衡转化率为___________ ,反应I以物质的量分数表示的平衡常数
___________ 。
(2)研究HI的分解与合成对提高反应Ⅰ中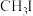 (g)的平衡转化率有重要意义。T℃,将amol
(g)的平衡转化率有重要意义。T℃,将amol (g)和amol
(g)和amol (g)置于已抽成真空的特制1L密闭容器中,40min时体系达到平衡,体系中存在如下反应关系:
(g)置于已抽成真空的特制1L密闭容器中,40min时体系达到平衡,体系中存在如下反应关系:
Ⅰ.

Ⅱ.

Ⅲ.

Ⅳ.

①则
___________ 。
②实验测得平衡体系总压强为 Pa,HI的分压为
Pa,HI的分压为 Pa,
Pa, 的分压为
的分压为 Pa,已知该反应的正反应速率为
Pa,已知该反应的正反应速率为 ,逆反应速率为
,逆反应速率为 ,其中k正、k逆为速率常数,x为物质量分数,若
,其中k正、k逆为速率常数,x为物质量分数,若 ,在t=40min时,v正=
,在t=40min时,v正=___________ 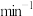 (用含b的代数式表示)。
(用含b的代数式表示)。
(1)一碘甲烷(
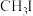 )热裂解可制取乙烯等低碳烯烃化工原料。一碘甲烷(
)热裂解可制取乙烯等低碳烯烃化工原料。一碘甲烷(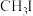 )热裂解时主要反应有:
)热裂解时主要反应有:反应Ⅰ


反应Ⅱ


反应Ⅲ

 (298K)
(298K)实验测得,反应Ⅰ、Ⅱ的
 随温度的变化如图1所示,在体积为1L的密闭容器中,起始投料1mol
随温度的变化如图1所示,在体积为1L的密闭容器中,起始投料1mol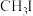 (g),反应温度对平衡体系中乙烯、丙烯和丁烯物质的量分数的影响如图2所示。
(g),反应温度对平衡体系中乙烯、丙烯和丁烯物质的量分数的影响如图2所示。
①298K时,反应

 ;
;
 。
。②当体系温度高于600K时,乙烯的物质量分数随温度升高而显著增加的可能原因是
③若维持体系温度为715K,
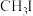 (g)的平衡转化率为
(g)的平衡转化率为
(2)研究HI的分解与合成对提高反应Ⅰ中
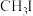 (g)的平衡转化率有重要意义。T℃,将amol
(g)的平衡转化率有重要意义。T℃,将amol (g)和amol
(g)和amol (g)置于已抽成真空的特制1L密闭容器中,40min时体系达到平衡,体系中存在如下反应关系:
(g)置于已抽成真空的特制1L密闭容器中,40min时体系达到平衡,体系中存在如下反应关系:Ⅰ.


Ⅱ.


Ⅲ.


Ⅳ.


①则

②实验测得平衡体系总压强为
 Pa,HI的分压为
Pa,HI的分压为 Pa,
Pa, 的分压为
的分压为 Pa,已知该反应的正反应速率为
Pa,已知该反应的正反应速率为 ,逆反应速率为
,逆反应速率为 ,其中k正、k逆为速率常数,x为物质量分数,若
,其中k正、k逆为速率常数,x为物质量分数,若 ,在t=40min时,v正=
,在t=40min时,v正=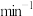 (用含b的代数式表示)。
(用含b的代数式表示)。
您最近一年使用:0次
10 . 甲醇是重要的化工原料,研究甲醇的制备及用途在工业上有重要的意义。
(1)一种重要的工业制备甲醇的反应为:
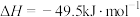
已知:①

②

计算反应②的
___________ 。
(2)对于反应 ,
,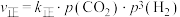 ,
,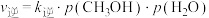 。其中
。其中 、
、 分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。在540K下,按初始投料比
分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。在540K下,按初始投料比 分别为3∶1、1∶1、1∶3,得到不同压强条件下
分别为3∶1、1∶1、1∶3,得到不同压强条件下 的平衡转化率关系如图所示:
的平衡转化率关系如图所示:

①比较a、b、c各曲线所表示的投料比大小顺序为___________ (用字母表示)。
②点N在线b上,计算540K的压强平衡常数
___________ (用平衡分压代替平衡浓度计算)。
③540K条件下,某容器测得某时刻 ,
,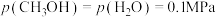 ,
, ,此时
,此时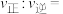
___________ 。
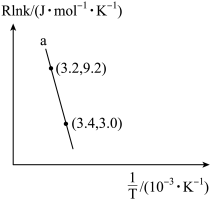
(3)甲醇催化可制取丙烯,反应为: ,反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为
,反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为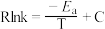 (
( 为活化能,k为速率常数,R和C为常数)。
为活化能,k为速率常数,R和C为常数)。
①该反应的活化能
___________  。
。
②当使用更高效催化剂时,在图中画出Rlnk与 关系的示意图
关系的示意图___________ 。
(4)在饱和的 电解液中,电解活化的
电解液中,电解活化的 也可以制备
也可以制备 。其原理如图所示,则阴极的电极反应式为
。其原理如图所示,则阴极的电极反应式为___________ 。

(1)一种重要的工业制备甲醇的反应为:

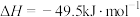
已知:①


②


计算反应②的

(2)对于反应
 ,
,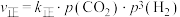 ,
,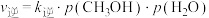 。其中
。其中 、
、 分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。在540K下,按初始投料比
分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。在540K下,按初始投料比 分别为3∶1、1∶1、1∶3,得到不同压强条件下
分别为3∶1、1∶1、1∶3,得到不同压强条件下 的平衡转化率关系如图所示:
的平衡转化率关系如图所示:
①比较a、b、c各曲线所表示的投料比大小顺序为
②点N在线b上,计算540K的压强平衡常数

③540K条件下,某容器测得某时刻
 ,
,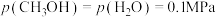 ,
, ,此时
,此时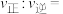
(3)甲醇催化可制取丙烯,反应为:
 ,反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为
,反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为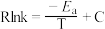 (
( 为活化能,k为速率常数,R和C为常数)。
为活化能,k为速率常数,R和C为常数)。①该反应的活化能

 。
。②当使用更高效催化剂时,在图中画出Rlnk与
 关系的示意图
关系的示意图
(4)在饱和的
 电解液中,电解活化的
电解液中,电解活化的 也可以制备
也可以制备 。其原理如图所示,则阴极的电极反应式为
。其原理如图所示,则阴极的电极反应式为
您最近一年使用:0次