名校
解题方法
1 . 研究反应过程的热量变化对于生产生活有重要意义。
Ⅰ.甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在一定条件下合成甲醇。请按要求回答下列问题:
(1)反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)在使用和未使用催化剂时,反应过程和能量的对应关系如图所示。下列说法正确的是
CH3OH(g)+H2O(g)在使用和未使用催化剂时,反应过程和能量的对应关系如图所示。下列说法正确的是___ (填字母代号)。

A.该可逆反应的正反应为吸热反应
B.断裂反应物中的化学键所吸收的总能量小于形成生成物中的化学键所释放的总能量
C.曲线b是使用了催化剂对应的曲线,且加入催化剂后,反应热变小
(2)CO、CO2和H2在合成过程中发生的主要反应如下:
①CO(g)+2H2(g) CH3OH(g) ΔH1=-99 kJ·mol-1
CH3OH(g) ΔH1=-99 kJ·mol-1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
③CO2(g)+H2(g) CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
则ΔH3=____ 。
(3)直接甲醇燃料电池(简称DMFC)由于其结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC的工作原理如图所示:
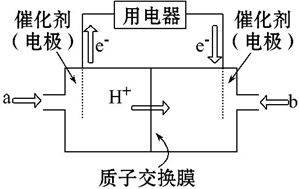
则通入a气体的电极是电池的____ (填“正”或“负”)极,其电极反应式为___ 。
Ⅱ.已知单质硫在通常条件下以S8(斜方硫)的形式存在,而在蒸气状态下,有S2、S4、S6及S8等多种同素异形体,其中S4、S6和S8具有相似的结构特点,其结构如图所示:

(1)在一定温度下,测得硫蒸气的平均摩尔质量为80 g·mol-1,则该蒸气中S2的体积分数不小于_____ 。
(2)若已知硫氧键的键能为d kJ·mol-1,氧氧键的键能为e kJ·mol-1,S(s)+O2(g)===SO2(g)ΔH=-a kJ·mol-1,则S8中硫硫键的键能为_____ 。
Ⅰ.甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在一定条件下合成甲醇。请按要求回答下列问题:
(1)反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)在使用和未使用催化剂时,反应过程和能量的对应关系如图所示。下列说法正确的是
CH3OH(g)+H2O(g)在使用和未使用催化剂时,反应过程和能量的对应关系如图所示。下列说法正确的是
A.该可逆反应的正反应为吸热反应
B.断裂反应物中的化学键所吸收的总能量小于形成生成物中的化学键所释放的总能量
C.曲线b是使用了催化剂对应的曲线,且加入催化剂后,反应热变小
(2)CO、CO2和H2在合成过程中发生的主要反应如下:
①CO(g)+2H2(g)
 CH3OH(g) ΔH1=-99 kJ·mol-1
CH3OH(g) ΔH1=-99 kJ·mol-1②CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1③CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3则ΔH3=
(3)直接甲醇燃料电池(简称DMFC)由于其结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC的工作原理如图所示:

则通入a气体的电极是电池的
Ⅱ.已知单质硫在通常条件下以S8(斜方硫)的形式存在,而在蒸气状态下,有S2、S4、S6及S8等多种同素异形体,其中S4、S6和S8具有相似的结构特点,其结构如图所示:

(1)在一定温度下,测得硫蒸气的平均摩尔质量为80 g·mol-1,则该蒸气中S2的体积分数不小于
(2)若已知硫氧键的键能为d kJ·mol-1,氧氧键的键能为e kJ·mol-1,S(s)+O2(g)===SO2(g)ΔH=-a kJ·mol-1,则S8中硫硫键的键能为
您最近一年使用:0次
解题方法
2 . 光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。

(1)实验室中常用来制备氯气的化学方程式为__________ 。
(2)工业上利用天然气(主要成分为 )与
)与 进行高温重整制备CO,已知
进行高温重整制备CO,已知 、
、 和CO的燃烧热(
和CO的燃烧热( )分别为
)分别为 、
、 、
、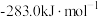 ,则生成1mol CO所需热量为
,则生成1mol CO所需热量为__________ (保留2位小数)。
(3)实验室中可用氯仿( )与双氧水直接反应制备光气,其反应的化学方程式为:
)与双氧水直接反应制备光气,其反应的化学方程式为:__________ 。
(4)右图是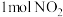 和1mol CO反应生成
和1mol CO反应生成 和NO过程中能量变化示意图,则该反应是
和NO过程中能量变化示意图,则该反应是______ (填“吸热”或“放热”)反应;若使用催化剂,则图中:
______ 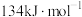 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
(5)已知:
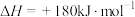

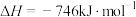
则反应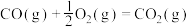 的
的
______ 
(6)已知 、
、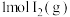 与
与 分子中化学键断裂时分别需要吸收的能量为436kJ、151kJ、299kJ,则HI分解生成
分子中化学键断裂时分别需要吸收的能量为436kJ、151kJ、299kJ,则HI分解生成 和
和 的热化学方程式为:
的热化学方程式为:______ 。

(1)实验室中常用来制备氯气的化学方程式为
(2)工业上利用天然气(主要成分为
 )与
)与 进行高温重整制备CO,已知
进行高温重整制备CO,已知 、
、 和CO的燃烧热(
和CO的燃烧热( )分别为
)分别为 、
、 、
、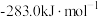 ,则生成1mol CO所需热量为
,则生成1mol CO所需热量为(3)实验室中可用氯仿(
 )与双氧水直接反应制备光气,其反应的化学方程式为:
)与双氧水直接反应制备光气,其反应的化学方程式为:(4)右图是
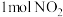 和1mol CO反应生成
和1mol CO反应生成 和NO过程中能量变化示意图,则该反应是
和NO过程中能量变化示意图,则该反应是
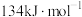 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。(5)已知:

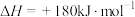

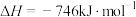
则反应
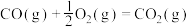 的
的

(6)已知
 、
、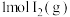 与
与 分子中化学键断裂时分别需要吸收的能量为436kJ、151kJ、299kJ,则HI分解生成
分子中化学键断裂时分别需要吸收的能量为436kJ、151kJ、299kJ,则HI分解生成 和
和 的热化学方程式为:
的热化学方程式为:
您最近一年使用:0次
解题方法
3 . 甲烷在日常生活及有机合成中用途广泛,某研究小组研究甲烷在高温下气相裂解反应的原理及其应用。
(1)已知:


则甲烷气相裂解反应: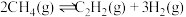 的
的 =
=________ 。
(2)该研究小组在研究过程中得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图所示。

① 时,向2L恒容密闭容器中充入0.3mol
时,向2L恒容密闭容器中充入0.3mol ,只发生反应
,只发生反应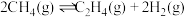 ,达到平衡时,测得
,达到平衡时,测得 。该反应达到平衡时,
。该反应达到平衡时, 的转化率为
的转化率为________ 。
②对上述平衡状态,若改变温度至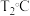 ,经10s后再次达到平衡,
,经10s后再次达到平衡, ,则10s内
,则10s内 的平均反应速率
的平均反应速率 =
=________ ,上述变化过程中T1________ (填“>”或“<”)T2,判断理由是________ 。
③在①建立的平衡状态基础上,其他条件不变,再通入0.5mol ,平衡将
,平衡将_________ (填“不移动”、“正向移动”或“逆向移动”),与原平衡相比, 的平衡转化率
的平衡转化率__________ (填“不变”、“变大”或“变小”)。
(3)若容器中发生反应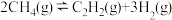 ,计算该反应在图中A点温度时的平衡常数Kp=
,计算该反应在图中A点温度时的平衡常数Kp=________________  (用平衡分压代替平衡浓度)。
(用平衡分压代替平衡浓度)。
(1)已知:



则甲烷气相裂解反应:
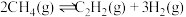 的
的 =
=(2)该研究小组在研究过程中得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图所示。

①
 时,向2L恒容密闭容器中充入0.3mol
时,向2L恒容密闭容器中充入0.3mol ,只发生反应
,只发生反应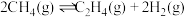 ,达到平衡时,测得
,达到平衡时,测得 。该反应达到平衡时,
。该反应达到平衡时, 的转化率为
的转化率为②对上述平衡状态,若改变温度至
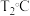 ,经10s后再次达到平衡,
,经10s后再次达到平衡, ,则10s内
,则10s内 的平均反应速率
的平均反应速率 =
=③在①建立的平衡状态基础上,其他条件不变,再通入0.5mol
 ,平衡将
,平衡将 的平衡转化率
的平衡转化率(3)若容器中发生反应
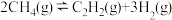 ,计算该反应在图中A点温度时的平衡常数Kp=
,计算该反应在图中A点温度时的平衡常数Kp= (用平衡分压代替平衡浓度)。
(用平衡分压代替平衡浓度)。
您最近一年使用:0次
4 . 甲醛(HCHO)俗称蚁醛,是一种重要的有机原料。
I.利用甲醇(CH3OH)制备甲醛
脱氢法:CH3OH(g)=HCHO(g)+H2(g)ΔH1=+92.09kJ·mol-1
氧化法:CH3OH(g)+ O2(g)=HCHO(g)+H2O(g)ΔH2
O2(g)=HCHO(g)+H2O(g)ΔH2
(1)已知:2H2(g)+O2(g)=2H2O(g)ΔH3=-483.64kJ·mol-1,则ΔH2=_______ 。
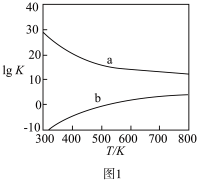
(2)图1为甲醇制备甲醛反应的lgK(K为平衡常数)随温度(T)的变化曲线。曲线_______ (填“a”或“b”)对应脱氢法,判断依据为_______ 。
II.甲醛的用途
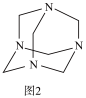
(3)将甲醛水溶液与氨水混合蒸发可制得乌洛托品(结构简式如图2),该物质在医药等工业中有广泛用途。若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为_______ 。
(4)将甲醛水溶液与硫酸镍(NiSO4)混合,可用于化学镀镍。若反应过程中有CO2产生,则该反应的离子方程式为_______ 。
III.甲醛的检测
(5)室内甲醛超标会危害人体健康,通过传感器可以监测空气中甲醛的含量。种燃料电池型甲醛气体传感器的原理如图3所示,则b极的电极反应式为_______ 。当电路中转移4×10-4mol电子时,传感器内参加反应的HCHO为_______ mg。

I.利用甲醇(CH3OH)制备甲醛
脱氢法:CH3OH(g)=HCHO(g)+H2(g)ΔH1=+92.09kJ·mol-1
氧化法:CH3OH(g)+
 O2(g)=HCHO(g)+H2O(g)ΔH2
O2(g)=HCHO(g)+H2O(g)ΔH2(1)已知:2H2(g)+O2(g)=2H2O(g)ΔH3=-483.64kJ·mol-1,则ΔH2=
(2)图1为甲醇制备甲醛反应的lgK(K为平衡常数)随温度(T)的变化曲线。曲线

II.甲醛的用途
(3)将甲醛水溶液与氨水混合蒸发可制得乌洛托品(结构简式如图2),该物质在医药等工业中有广泛用途。若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为

(4)将甲醛水溶液与硫酸镍(NiSO4)混合,可用于化学镀镍。若反应过程中有CO2产生,则该反应的离子方程式为
III.甲醛的检测
(5)室内甲醛超标会危害人体健康,通过传感器可以监测空气中甲醛的含量。种燃料电池型甲醛气体传感器的原理如图3所示,则b极的电极反应式为

您最近一年使用:0次
解题方法
5 . 甲醇是重要的化工原料,研究甲醇的制备及用途在工业上有重要的意义。
(1)一种重要的工业制备甲醇的反应为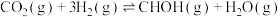 △H
△H
已知:①

②

试计算制备反应的△H=_______ 。
(2)在某恒温恒压容器中进行反应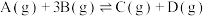 ,达到平衡时容器容积为1 L。A、B、C、D的物质的量依次为3 mol、1 mol、1 mol、1 mol;若往容器中再通入6 mol A,此时平衡
,达到平衡时容器容积为1 L。A、B、C、D的物质的量依次为3 mol、1 mol、1 mol、1 mol;若往容器中再通入6 mol A,此时平衡_______ (填“正向”“逆向”或“不”)移动,该反应的△H _______ (填“大于”或“小于”)0。
(3)对于反应 ,
,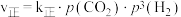 ,
, 。其中
。其中 、
、 分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。在540K下,按初始投料比
分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。在540K下,按初始投料比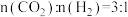 、
、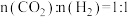 、
、 ,得到不同压强条件下
,得到不同压强条件下 的平衡转化率关系图:
的平衡转化率关系图:
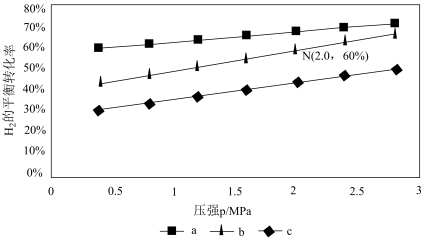
①比较a、b、c各曲线所表示的投料比大小顺序为_______ (用字母表示)。
②点N在线b上,计算540 K的压强平衡常数Kp=_______ (用平衡分压代替平衡浓度计算)。
③540K条件下,某容器测得某时刻 MPa,
MPa, MPa,
MPa,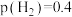 MPa,此时
MPa,此时
_______ 。
(4)甲醇催化可制取丙烯,反应为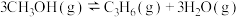 ,反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为
,反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为 (Ea为活化能,k为速率常数,R和C为常数)。
(Ea为活化能,k为速率常数,R和C为常数)。
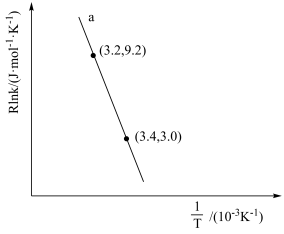
①该反应的活化能Ea=_______  。
。
②当使用更高效催化剂时,在图中画出 与
与 关系的示意图。
关系的示意图。_______
(1)一种重要的工业制备甲醇的反应为
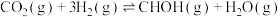 △H
△H已知:①


②


试计算制备反应的△H=
(2)在某恒温恒压容器中进行反应
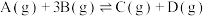 ,达到平衡时容器容积为1 L。A、B、C、D的物质的量依次为3 mol、1 mol、1 mol、1 mol;若往容器中再通入6 mol A,此时平衡
,达到平衡时容器容积为1 L。A、B、C、D的物质的量依次为3 mol、1 mol、1 mol、1 mol;若往容器中再通入6 mol A,此时平衡(3)对于反应
 ,
,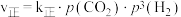 ,
, 。其中
。其中 、
、 分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。在540K下,按初始投料比
分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。在540K下,按初始投料比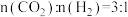 、
、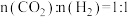 、
、 ,得到不同压强条件下
,得到不同压强条件下 的平衡转化率关系图:
的平衡转化率关系图:
①比较a、b、c各曲线所表示的投料比大小顺序为
②点N在线b上,计算540 K的压强平衡常数Kp=
③540K条件下,某容器测得某时刻
 MPa,
MPa, MPa,
MPa,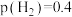 MPa,此时
MPa,此时
(4)甲醇催化可制取丙烯,反应为
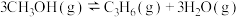 ,反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为
,反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为 (Ea为活化能,k为速率常数,R和C为常数)。
(Ea为活化能,k为速率常数,R和C为常数)。
①该反应的活化能Ea=
 。
。②当使用更高效催化剂时,在图中画出
 与
与 关系的示意图。
关系的示意图。
您最近一年使用:0次
2022-05-10更新
|
328次组卷
|
4卷引用:湖南省娄底市2022届高三上学期第二次模拟考试化学试题
湖南省娄底市2022届高三上学期第二次模拟考试化学试题湖南省株洲市北附高级中学2022-2023学年高三上学期第五次月考化学试题湖南省株洲市十三中2022-2023学年高三第五次月考化学试题(已下线)专题15 化学反应原理综合题-三年(2020-2022)高考真题分项汇编
6 . 砷(As)是第四周期ⅤA族元素,可以形成As2O3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图__ 。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式___ 。该反应需要在加压下进行,原因是___ 。
(3)已知:2As(s)+ H2(g)+2O2(g)=H3AsO4(s) △H1
H2(g)+2O2(g)=H3AsO4(s) △H1
H2(g)+ O2(g)=H2O(l) △H2
O2(g)=H2O(l) △H2
2As(s)+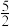 O2(g)=As2O5(s) △H3
O2(g)=As2O5(s) △H3
则反应As2O5(s)+3H2O(l)=2H3AsO4(s)的△H=__ 。
(4)298K时,将20mL3xmol•L-1Na3AsO3、20mL3xmol•L-1I2和20mLNaOH溶液混合,发生反应:AsO (aq)+I2(aq)+2OH-(aq)
(aq)+I2(aq)+2OH-(aq) AsO
AsO (aq)+2I-(aq)+H2O(1)。溶液中c(AsO
(aq)+2I-(aq)+H2O(1)。溶液中c(AsO )与反应时间
)与反应时间 的关系如图所示。
的关系如图所示。
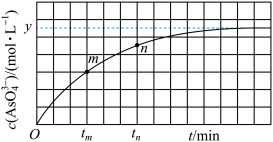
①下列可判断反应达到平衡的是__ (填字母代号)。
a.溶液的pH不再变化
b.v(I-)=2v(AsO )
)
c.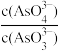 不再变化
不再变化
d.c(I-)=ymol•L-1
②tm时,v逆___ tn时v逆(填“大于”“小于”或“等于”),理由是__ 。
③若平衡时溶液的pH=14,则该反应的平衡常数K为___ 。
(1)画出砷的原子结构示意图
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式
(3)已知:2As(s)+
 H2(g)+2O2(g)=H3AsO4(s) △H1
H2(g)+2O2(g)=H3AsO4(s) △H1H2(g)+
 O2(g)=H2O(l) △H2
O2(g)=H2O(l) △H22As(s)+
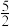 O2(g)=As2O5(s) △H3
O2(g)=As2O5(s) △H3则反应As2O5(s)+3H2O(l)=2H3AsO4(s)的△H=
(4)298K时,将20mL3xmol•L-1Na3AsO3、20mL3xmol•L-1I2和20mLNaOH溶液混合,发生反应:AsO
 (aq)+I2(aq)+2OH-(aq)
(aq)+I2(aq)+2OH-(aq) AsO
AsO (aq)+2I-(aq)+H2O(1)。溶液中c(AsO
(aq)+2I-(aq)+H2O(1)。溶液中c(AsO )与反应时间
)与反应时间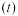 的关系如图所示。
的关系如图所示。
①下列可判断反应达到平衡的是
a.溶液的pH不再变化
b.v(I-)=2v(AsO
 )
)c.
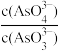 不再变化
不再变化d.c(I-)=ymol•L-1
②tm时,v逆
③若平衡时溶液的pH=14,则该反应的平衡常数K为
您最近一年使用:0次
解题方法
7 . 按要求回答下列问题:
I.2018年10月15日新华社报道:全国农村应当在“绿色生态·美丽多彩·低碳节能·循环发展”的理念引导下,更快更好地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设。可见“低碳循环”已经引起了国民的重视,试回答下列问题:
(1)煤的气化和液化可以提高燃料的利用率。
已知25℃、101 kPa时: ①C(s)+ O2(g)=CO(g) ΔH=−126.4 kJ∙mol−1
O2(g)=CO(g) ΔH=−126.4 kJ∙mol−1
②2H2(g)+O2(g)=2H2O(l) ΔH=−571.6 kJ∙mol−1 ③H2O(g)=H2O(l) ΔH=−44 kJ∙mol−1,则在25℃、101kPa时: C(s)和H2O(g)反应生成CO(g)和H2(g)的热化学方程式为___________
(2)高炉炼铁是CO气体的重要用途之一,其基本反应为:FeO(s)+CO(g) Fe(s)+CO2(g) ΔH>0
Fe(s)+CO2(g) ΔH>0
已知在1 100℃时,该反应的化学平衡常数K=0.263。1100℃时测得高炉中,c(CO2)=0.025 mol∙L−1,c(CO)=0.1 mol∙L−1,则在这种情况下,该反应向___________ (填“正”或 “逆”) 方向进行
(3)目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=−49.0 kJ∙mol−1,现向体积为2 L的容积固定的密闭容器中,充入2mol CO2和6 mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如下图所示
CH3OH(g)+H2O(g) ΔH=−49.0 kJ∙mol−1,现向体积为2 L的容积固定的密闭容器中,充入2mol CO2和6 mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如下图所示

从反应开始到平衡,氢气的平均反应速率υ(H2)=____________
(4)下列措施能使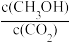 增大的是
增大的是___________ (填字母)
A.升高温度 B.若维持容器内压强不变,充入He(g)
C.再充入CO2 D.将H2O(g)从体系中分离
E.充入He(g),使体系压强增大 F.再充入H2
II.活性炭还原NO2的反应为2NO2(g)+2C(s) N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
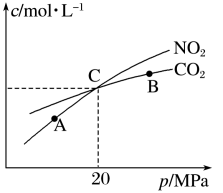
(5)A、B、C三点中NO2的转化率最低的是___________ (填“A”“B”或“C”)点
(6)计算C点时该反应的压强平衡常数Kp=___________ (Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
I.2018年10月15日新华社报道:全国农村应当在“绿色生态·美丽多彩·低碳节能·循环发展”的理念引导下,更快更好地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设。可见“低碳循环”已经引起了国民的重视,试回答下列问题:
(1)煤的气化和液化可以提高燃料的利用率。
已知25℃、101 kPa时: ①C(s)+
 O2(g)=CO(g) ΔH=−126.4 kJ∙mol−1
O2(g)=CO(g) ΔH=−126.4 kJ∙mol−1②2H2(g)+O2(g)=2H2O(l) ΔH=−571.6 kJ∙mol−1 ③H2O(g)=H2O(l) ΔH=−44 kJ∙mol−1,则在25℃、101kPa时: C(s)和H2O(g)反应生成CO(g)和H2(g)的热化学方程式为
(2)高炉炼铁是CO气体的重要用途之一,其基本反应为:FeO(s)+CO(g)
 Fe(s)+CO2(g) ΔH>0
Fe(s)+CO2(g) ΔH>0已知在1 100℃时,该反应的化学平衡常数K=0.263。1100℃时测得高炉中,c(CO2)=0.025 mol∙L−1,c(CO)=0.1 mol∙L−1,则在这种情况下,该反应向
(3)目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH=−49.0 kJ∙mol−1,现向体积为2 L的容积固定的密闭容器中,充入2mol CO2和6 mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如下图所示
CH3OH(g)+H2O(g) ΔH=−49.0 kJ∙mol−1,现向体积为2 L的容积固定的密闭容器中,充入2mol CO2和6 mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如下图所示
从反应开始到平衡,氢气的平均反应速率υ(H2)=
(4)下列措施能使
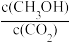 增大的是
增大的是A.升高温度 B.若维持容器内压强不变,充入He(g)
C.再充入CO2 D.将H2O(g)从体系中分离
E.充入He(g),使体系压强增大 F.再充入H2
II.活性炭还原NO2的反应为2NO2(g)+2C(s)
 N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
(5)A、B、C三点中NO2的转化率最低的是
(6)计算C点时该反应的压强平衡常数Kp=
您最近一年使用:0次
2021-03-10更新
|
159次组卷
|
2卷引用:湖南省邵阳市邵东创新实验学校2020-2021学年高二上学期期末考试化学(选考)试题
名校
8 . 甲醇、乙醇来源丰富、价格低廉、运输贮存方便,都是重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。
Ⅰ﹒用CO2生产甲醇、乙醇
(1)已知:H2的燃烧热为﹣285.8kJ/mol,CH3OH(l)的燃烧热为﹣725.8kJ/mol,CH3OH(g)═CH3OH(1)△H=﹣37.3kJ/mol,则CO2(g)+3H2(g)═CH3OH(g)+H2O(l)△H=_______ kJ/mol。
(2)为探究用CO2生产燃料甲醇的反应原理,在容积为2L的密闭容器中,充入1molCO2和3.25molH2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如图1所示。
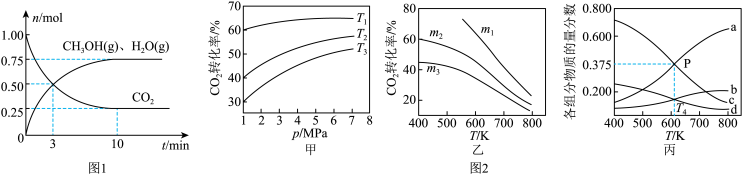
①从反应开始到平衡,氢气的平均反应速率v(H2)=_______ 。
②下列措施不能使CO2的平衡转化率增大的是_______ (填序号)。
A.在原容器中再充入1molCO2B.在原容器中再充入1molH2C.在原容器中充入1mol氦气
D.使用更有效的催化剂E.缩小容器的容积F.将水蒸气从体系中分离
(3)CO2也可通过催化加氢合成乙醇,其反应原理为2CO2(g)+6H2(g)═C2H5OH(g)+3H2O(g)△H<0。设m为起始时的投料比,即m= 。通过实验得到如图2所示图象。
。通过实验得到如图2所示图象。
①图甲中投料比相同,温度从高到低的顺序为_______ 。
②图乙中m1、m2、m3从大到小的顺序为_______ 。
③图丙表示在总压为5MPa的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系。T4温度时,该反应压强平衡常数Kp的计算式为_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,代入数据,不用计算)。
Ⅱ.甲醇的应用
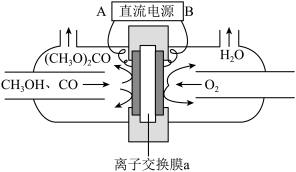
以甲醇和CO为原料通过电化学合成碳酸二甲酯的工作原理如图所示。离子交换膜a为_______ (填“阳膜”或“阴膜”),阳极的电极反应式为_______ 。
Ⅰ﹒用CO2生产甲醇、乙醇
(1)已知:H2的燃烧热为﹣285.8kJ/mol,CH3OH(l)的燃烧热为﹣725.8kJ/mol,CH3OH(g)═CH3OH(1)△H=﹣37.3kJ/mol,则CO2(g)+3H2(g)═CH3OH(g)+H2O(l)△H=
(2)为探究用CO2生产燃料甲醇的反应原理,在容积为2L的密闭容器中,充入1molCO2和3.25molH2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如图1所示。

①从反应开始到平衡,氢气的平均反应速率v(H2)=
②下列措施不能使CO2的平衡转化率增大的是
A.在原容器中再充入1molCO2B.在原容器中再充入1molH2C.在原容器中充入1mol氦气
D.使用更有效的催化剂E.缩小容器的容积F.将水蒸气从体系中分离
(3)CO2也可通过催化加氢合成乙醇,其反应原理为2CO2(g)+6H2(g)═C2H5OH(g)+3H2O(g)△H<0。设m为起始时的投料比,即m=
 。通过实验得到如图2所示图象。
。通过实验得到如图2所示图象。①图甲中投料比相同,温度从高到低的顺序为
②图乙中m1、m2、m3从大到小的顺序为
③图丙表示在总压为5MPa的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系。T4温度时,该反应压强平衡常数Kp的计算式为
Ⅱ.甲醇的应用
以甲醇和CO为原料通过电化学合成碳酸二甲酯的工作原理如图所示。离子交换膜a为

您最近一年使用:0次
2020-11-15更新
|
202次组卷
|
2卷引用:湖南省长沙市湖南师范大学附属中学2022-2023学年高三上学期月考(三)化学试题
名校
解题方法
9 . 运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.氨为重要的化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a. CH4(g)+H2O(g)⇌CO(g)+3H2(g) ∆H1=+216.4kJ/mol
b. CO(g)+H2O(g)⇌CO2(g)+H2(g) ∆H2=-41.2kJ/mol
则反应CH4(g)+2H2O(g)⇌CO2(g)+4H2(g) ∆H=_____________ 。
(2)起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。
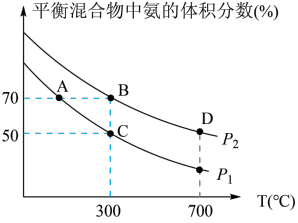
①恒压时,反应一定达到平衡状态的标志是_____________ (填序号)
A. 和
和 的转化率相等 B.反应体系密度保持不变
的转化率相等 B.反应体系密度保持不变
C. 保持不变 D.
保持不变 D.
②P1_____ P2 (填“<”或“>”或“=”或“不确定”,下同);反应的平衡常数:B点_______ D点。
③C点 的转化率为
的转化率为________ ;在A、B两点条件下,该反应从开始到平衡时生成氮气的平均速率:υ(A)__________ υ(B)。
I.氨为重要的化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a. CH4(g)+H2O(g)⇌CO(g)+3H2(g) ∆H1=+216.4kJ/mol
b. CO(g)+H2O(g)⇌CO2(g)+H2(g) ∆H2=-41.2kJ/mol
则反应CH4(g)+2H2O(g)⇌CO2(g)+4H2(g) ∆H=
(2)起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。

①恒压时,反应一定达到平衡状态的标志是
A.
 和
和 的转化率相等 B.反应体系密度保持不变
的转化率相等 B.反应体系密度保持不变C.
 保持不变 D.
保持不变 D.
②P1
③C点
 的转化率为
的转化率为
您最近一年使用:0次
10 . 按要求完成下列填空
Ⅰ.已知: ① 2C3H8(g) + 7O2(g) ===6CO(g) + 8H2O(l) ΔH=-2741.8 kJ/mol
② 2CO(g) + O2(g) ===2CO2(g) ΔH=-566 kJ/mol
(1)反应C3H8(g) + 5O2(g) ===3CO2(g) + 4H2O(l)的ΔH=___________________________________
(2)C3H8在不足量的氧气里燃烧,生成CO和CO2以及气态水,将所有的产物通入一个固定体积的密闭容器中,在一定条件下发生如下可逆反应:CO(g) + H2O(g) CO2(g) + H2(g) ΔH>0
CO2(g) + H2(g) ΔH>0
① 下列事实能说明该反应达到平衡的是___________ (填序号)
a.体系中的压强不发生变化 b.υ正(H2)=υ逆(CO)
c.混合气体的平均相对分子质量不发生变化 d.CO2的浓度不再发生变化
② 在某温度下,反应物的起始浓度分别为:c(CO)=1 mol/L, c(H2O)=2.4 mol/L; 达到平衡后,CO的转化率为60%,该反应在此温度下的平衡常数是___________
(3)熔融碳酸盐燃料电池的电解质为Li2CO3和 Na2CO3的混合物,燃料为CO,在工作过程中,电解质熔融液的组成、浓度都不变,写出负极发生的电极反应式_________________ 。
Ⅱ.氮化硅(Si3N4)是一种新型陶瓷材料,它可用石英与焦炭在高温的氮气流中反应制得:
____ SiO2 + C + N2 Si3N4 + CO 根据题意完成下列各题:
Si3N4 + CO 根据题意完成下列各题:
(1)配平上述化学反应方程式。
(2)为了保证石英和焦炭尽可能的转化,氮气要适当过量。某次反应用了30 mol氮气,反应生成了5 mol一氧化碳,则此时混合气体的平均摩尔质量是______________ 。
(3)氮化硅陶瓷的机械强度高,硬度接近于刚玉(A12O3),热稳定性好,化学性质稳定。以下用途正确的是__________ (填序号)
A.可以在冶金工业上制成坩埚、铝电解槽衬里等设备
B.在电子工业上制成耐高温的电的良导体
C.研发氮化硅的全陶发动机替代同类型金属发动机
D.氮化硅陶瓷的开发受到资源的限制,没有发展前途
Ⅰ.已知: ① 2C3H8(g) + 7O2(g) ===6CO(g) + 8H2O(l) ΔH=-2741.8 kJ/mol
② 2CO(g) + O2(g) ===2CO2(g) ΔH=-566 kJ/mol
(1)反应C3H8(g) + 5O2(g) ===3CO2(g) + 4H2O(l)的ΔH=
(2)C3H8在不足量的氧气里燃烧,生成CO和CO2以及气态水,将所有的产物通入一个固定体积的密闭容器中,在一定条件下发生如下可逆反应:CO(g) + H2O(g)
 CO2(g) + H2(g) ΔH>0
CO2(g) + H2(g) ΔH>0① 下列事实能说明该反应达到平衡的是
a.体系中的压强不发生变化 b.υ正(H2)=υ逆(CO)
c.混合气体的平均相对分子质量不发生变化 d.CO2的浓度不再发生变化
② 在某温度下,反应物的起始浓度分别为:c(CO)=1 mol/L, c(H2O)=2.4 mol/L; 达到平衡后,CO的转化率为60%,该反应在此温度下的平衡常数是
(3)熔融碳酸盐燃料电池的电解质为Li2CO3和 Na2CO3的混合物,燃料为CO,在工作过程中,电解质熔融液的组成、浓度都不变,写出负极发生的电极反应式
Ⅱ.氮化硅(Si3N4)是一种新型陶瓷材料,它可用石英与焦炭在高温的氮气流中反应制得:
 Si3N4 + CO 根据题意完成下列各题:
Si3N4 + CO 根据题意完成下列各题:(1)配平上述化学反应方程式。
(2)为了保证石英和焦炭尽可能的转化,氮气要适当过量。某次反应用了30 mol氮气,反应生成了5 mol一氧化碳,则此时混合气体的平均摩尔质量是
(3)氮化硅陶瓷的机械强度高,硬度接近于刚玉(A12O3),热稳定性好,化学性质稳定。以下用途正确的是
A.可以在冶金工业上制成坩埚、铝电解槽衬里等设备
B.在电子工业上制成耐高温的电的良导体
C.研发氮化硅的全陶发动机替代同类型金属发动机
D.氮化硅陶瓷的开发受到资源的限制,没有发展前途
您最近一年使用:0次



