甲醇、乙醇来源丰富、价格低廉、运输贮存方便,都是重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。
Ⅰ﹒用CO2生产甲醇、乙醇
(1)已知:H2的燃烧热为﹣285.8kJ/mol,CH3OH(l)的燃烧热为﹣725.8kJ/mol,CH3OH(g)═CH3OH(1)△H=﹣37.3kJ/mol,则CO2(g)+3H2(g)═CH3OH(g)+H2O(l)△H=_______ kJ/mol。
(2)为探究用CO2生产燃料甲醇的反应原理,在容积为2L的密闭容器中,充入1molCO2和3.25molH2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如图1所示。
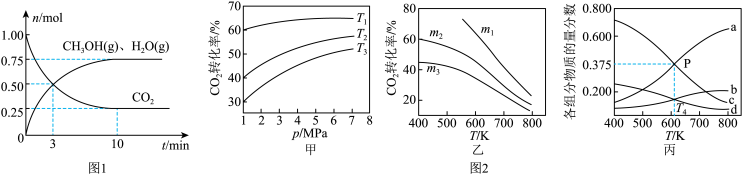
①从反应开始到平衡,氢气的平均反应速率v(H2)=_______ 。
②下列措施不能使CO2的平衡转化率增大的是_______ (填序号)。
A.在原容器中再充入1molCO2B.在原容器中再充入1molH2C.在原容器中充入1mol氦气
D.使用更有效的催化剂E.缩小容器的容积F.将水蒸气从体系中分离
(3)CO2也可通过催化加氢合成乙醇,其反应原理为2CO2(g)+6H2(g)═C2H5OH(g)+3H2O(g)△H<0。设m为起始时的投料比,即m= 。通过实验得到如图2所示图象。
。通过实验得到如图2所示图象。
①图甲中投料比相同,温度从高到低的顺序为_______ 。
②图乙中m1、m2、m3从大到小的顺序为_______ 。
③图丙表示在总压为5MPa的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系。T4温度时,该反应压强平衡常数Kp的计算式为_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,代入数据,不用计算)。
Ⅱ.甲醇的应用
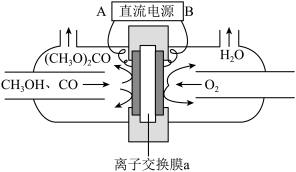
以甲醇和CO为原料通过电化学合成碳酸二甲酯的工作原理如图所示。离子交换膜a为_______ (填“阳膜”或“阴膜”),阳极的电极反应式为_______ 。
Ⅰ﹒用CO2生产甲醇、乙醇
(1)已知:H2的燃烧热为﹣285.8kJ/mol,CH3OH(l)的燃烧热为﹣725.8kJ/mol,CH3OH(g)═CH3OH(1)△H=﹣37.3kJ/mol,则CO2(g)+3H2(g)═CH3OH(g)+H2O(l)△H=
(2)为探究用CO2生产燃料甲醇的反应原理,在容积为2L的密闭容器中,充入1molCO2和3.25molH2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如图1所示。

①从反应开始到平衡,氢气的平均反应速率v(H2)=
②下列措施不能使CO2的平衡转化率增大的是
A.在原容器中再充入1molCO2B.在原容器中再充入1molH2C.在原容器中充入1mol氦气
D.使用更有效的催化剂E.缩小容器的容积F.将水蒸气从体系中分离
(3)CO2也可通过催化加氢合成乙醇,其反应原理为2CO2(g)+6H2(g)═C2H5OH(g)+3H2O(g)△H<0。设m为起始时的投料比,即m=
 。通过实验得到如图2所示图象。
。通过实验得到如图2所示图象。①图甲中投料比相同,温度从高到低的顺序为
②图乙中m1、m2、m3从大到小的顺序为
③图丙表示在总压为5MPa的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系。T4温度时,该反应压强平衡常数Kp的计算式为
Ⅱ.甲醇的应用
以甲醇和CO为原料通过电化学合成碳酸二甲酯的工作原理如图所示。离子交换膜a为

更新时间:2020-11-15 19:25:07
|
相似题推荐
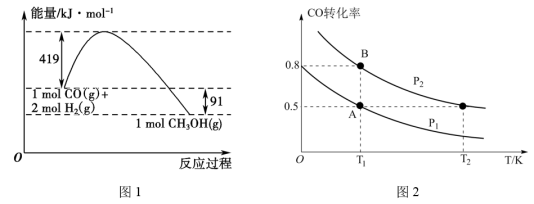
【推荐1】甲醇是重要的工业原料.煤化工可以利用煤炭制取水煤气从而合成甲醇:CO(g)+2H2(g) CH3OH(g)。常温常压下反应的能量变化如图1所示:
CH3OH(g)。常温常压下反应的能量变化如图1所示:
②
③CO(g)+ O2(g)=CO2(g) △H=-280kJ/mol
O2(g)=CO2(g) △H=-280kJ/mol
H2(g)+ O2(g)=H2O(l) △H=-284kJ/mol
O2(g)=H2O(l) △H=-284kJ/mol
H2O(l)=H2O(g) △H=+44kJ/mol
请回答下列问题:
(1)甲醇气体分解为CO和H2两种气体这一反应的活化能为__ kJ/mol;
(2)请写出表示气态甲醇燃烧热的热化学方程式__ ;
(3)H—O的键能x值为__ ;
(4)如图2:在一容积可变的密闭容器中充入10molCO气体和30molH2气体,当达到平衡状态A时,容器的体积为20L。如反应开始时仍充入10molCO和30molH2,则在平衡状态B时容器的体积V(B)=___ L;
(5)在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生该反应(起始温度和起始体积相同,反应物和生成物反应前后均为气态).相关数据如表所示:
则下列说法正确的是___ 。
A.V(甲)>V(丙)
B.K(乙)>K(丙)
C.c(乙)>c(甲)
D.v(甲)=v(丙)
 CH3OH(g)。常温常压下反应的能量变化如图1所示:
CH3OH(g)。常温常压下反应的能量变化如图1所示:
②
| 化学键 | H—H | H—O | O=O |
| 键能kJ/mol | 436 | x | 496 |
③CO(g)+
 O2(g)=CO2(g) △H=-280kJ/mol
O2(g)=CO2(g) △H=-280kJ/molH2(g)+
 O2(g)=H2O(l) △H=-284kJ/mol
O2(g)=H2O(l) △H=-284kJ/molH2O(l)=H2O(g) △H=+44kJ/mol
请回答下列问题:
(1)甲醇气体分解为CO和H2两种气体这一反应的活化能为
(2)请写出表示气态甲醇燃烧热的热化学方程式
(3)H—O的键能x值为
(4)如图2:在一容积可变的密闭容器中充入10molCO气体和30molH2气体,当达到平衡状态A时,容器的体积为20L。如反应开始时仍充入10molCO和30molH2,则在平衡状态B时容器的体积V(B)=
(5)在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生该反应(起始温度和起始体积相同,反应物和生成物反应前后均为气态).相关数据如表所示:
| 容器 | 甲 | 乙 | 丙 |
| 相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
| 反应物投料 | 1molCO、2molH2 | 1molCH3OH | 1molCH3OH |
| 平衡时容器体积 | V(甲) | V(乙) | V(丙) |
| 反应的平衡常数K | K(甲) | K(乙) | K(丙) |
| 平衡时CH3OH的浓度/mol•L-1 | C(甲) | C(乙) | C(丙) |
| 平衡时CH3OH的反应速率/mol•L-1•min-1 | v(甲) | v(乙) | v(丙) |
则下列说法正确的是
A.V(甲)>V(丙)
B.K(乙)>K(丙)
C.c(乙)>c(甲)
D.v(甲)=v(丙)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】 分子结构稳定,难以给出电子,较容易接受电子,较难活化。采用
分子结构稳定,难以给出电子,较容易接受电子,较难活化。采用 作为碳源,通过
作为碳源,通过 催化加氢方式,不仅可以减少温室气体的排放,还可以将
催化加氢方式,不仅可以减少温室气体的排放,还可以将 转化为高附加值的化学产品,具有重要的战略意义。
转化为高附加值的化学产品,具有重要的战略意义。
(1) 的结构与
的结构与 相似,写出
相似,写出 的电子式
的电子式_______ 。
(2)一种 直接加氢的反应机理如图a所示。
直接加氢的反应机理如图a所示。

①写出总反应的化学方程式_______ 。
②a、 也可以写成
也可以写成 (难溶),写出
(难溶),写出 溶于乙酸的离子方程式
溶于乙酸的离子方程式_______ ;
b、 比
比 更难溶,加热
更难溶,加热 的水溶液可以生成
的水溶液可以生成 ,写出反应的化学方程式
,写出反应的化学方程式_______ 。
(3)①已知:主反应 催化加氢制甲醇是放热反应
催化加氢制甲醇是放热反应

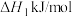

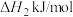
写出 催化加氢制甲醇的热化学方程式
催化加氢制甲醇的热化学方程式_______ ( 用含
用含 和
和 的代数式表示)。
的代数式表示)。
②已知
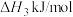 ,则
,则
_______  (填>、<或=)。
(填>、<或=)。
③我国科学家设计了离子液体电还原 合成
合成 工艺,写出碱性条件下
工艺,写出碱性条件下 生成甲醇的电极反应式
生成甲醇的电极反应式_______ 。
 分子结构稳定,难以给出电子,较容易接受电子,较难活化。采用
分子结构稳定,难以给出电子,较容易接受电子,较难活化。采用 作为碳源,通过
作为碳源,通过 催化加氢方式,不仅可以减少温室气体的排放,还可以将
催化加氢方式,不仅可以减少温室气体的排放,还可以将 转化为高附加值的化学产品,具有重要的战略意义。
转化为高附加值的化学产品,具有重要的战略意义。(1)
 的结构与
的结构与 相似,写出
相似,写出 的电子式
的电子式(2)一种
 直接加氢的反应机理如图a所示。
直接加氢的反应机理如图a所示。
①写出总反应的化学方程式
②a、
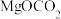 也可以写成
也可以写成 (难溶),写出
(难溶),写出 溶于乙酸的离子方程式
溶于乙酸的离子方程式b、
 比
比 更难溶,加热
更难溶,加热 的水溶液可以生成
的水溶液可以生成 ,写出反应的化学方程式
,写出反应的化学方程式(3)①已知:主反应
 催化加氢制甲醇是放热反应
催化加氢制甲醇是放热反应
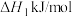

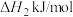
写出
 催化加氢制甲醇的热化学方程式
催化加氢制甲醇的热化学方程式 用含
用含 和
和 的代数式表示)。
的代数式表示)。②已知

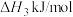 ,则
,则
 (填>、<或=)。
(填>、<或=)。③我国科学家设计了离子液体电还原
 合成
合成 工艺,写出碱性条件下
工艺,写出碱性条件下 生成甲醇的电极反应式
生成甲醇的电极反应式
您最近一年使用:0次
【推荐3】Cu的化合物在生活及科研中有重要作用,不同反应可制得不同状态的Cu2O
(1)科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂。
①在加热条件下用液态肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时放出N2。当收集的N2体积为3.36L(已换算为标准状况)时,可制备纳米级Cu2O的质量为________ ;
②一定温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.20 mol水蒸气,发生反应:
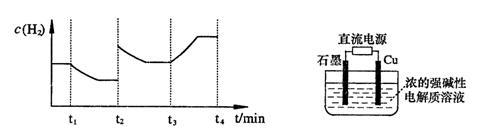
2H2O(g)===2H2(g)+O2(g)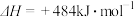 ;测得20 min时O2的物质的量为0.0016 mol,则前20 min的反应速率v(H2O)=
;测得20 min时O2的物质的量为0.0016 mol,则前20 min的反应速率v(H2O)=_________________ ;该温度下,反应的平衡常数表达式K=_________________ ;下图表示在t1时刻达到平衡后,只改变一个条件又达到平衡的不同时段内,H2的浓度随时间变化的情况,则t1时平衡的移动方向为______ ,t2时改变的条件可能为______________ ;若以K1、K2、K3分别表示t1时刻起改变条件的三个时间段内的平衡常数,t3时刻没有加入或减少体系中的任何物质,则K1、K2、K3的关系为________________ ;
(2)已知: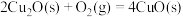 ΔH=-293kJ·mol-1
ΔH=-293kJ·mol-1
 ΔH=-221kJ·mol-1
ΔH=-221kJ·mol-1
请写出用足量炭粉还原CuO(s)制备Cu2O(s)的热化学方程式________ ;
(3)用电解法也可制备Cu2O。原理如右上图所示,则阳极电极反应可以表示为________ 。
(1)科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂。
①在加热条件下用液态肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时放出N2。当收集的N2体积为3.36L(已换算为标准状况)时,可制备纳米级Cu2O的质量为

②一定温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.20 mol水蒸气,发生反应:
2H2O(g)===2H2(g)+O2(g)
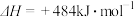 ;测得20 min时O2的物质的量为0.0016 mol,则前20 min的反应速率v(H2O)=
;测得20 min时O2的物质的量为0.0016 mol,则前20 min的反应速率v(H2O)=(2)已知:
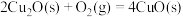 ΔH=-293kJ·mol-1
ΔH=-293kJ·mol-1 ΔH=-221kJ·mol-1
ΔH=-221kJ·mol-1请写出用足量炭粉还原CuO(s)制备Cu2O(s)的热化学方程式
(3)用电解法也可制备Cu2O。原理如右上图所示,则阳极电极反应可以表示为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】氢能是一种清洁能源,下列反应是目前大规模制取氢气的方法之一: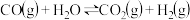
 ,在容积为2L的刚性容器中充入
,在容积为2L的刚性容器中充入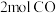 和
和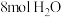 模拟上述反应,不同温度下反应的平衡常数K随温度变化如图所示,回答下列问题:
模拟上述反应,不同温度下反应的平衡常数K随温度变化如图所示,回答下列问题:

(1)该反应的
___________ 0(选填“>”或“<”),判断理由是___________ 。
(2)该反应的浓度平衡常数的表达式为
___________ 。
(3)判断该反应一定达到化学平衡状态的依据是___________(填字母)。
(4)下列有利于提高平衡时CO转化率的措施有___________(填字母)。
(5) 时,反应经2min后达平衡,则2min内用
时,反应经2min后达平衡,则2min内用 表示的反应速率
表示的反应速率
___________ 。达平衡后,若再向体系中充入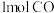 、
、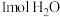 、
、 和
和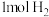 ,反应向
,反应向___________ (选填“正反应方向”或“逆反应方向”)进行。
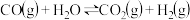
 ,在容积为2L的刚性容器中充入
,在容积为2L的刚性容器中充入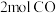 和
和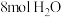 模拟上述反应,不同温度下反应的平衡常数K随温度变化如图所示,回答下列问题:
模拟上述反应,不同温度下反应的平衡常数K随温度变化如图所示,回答下列问题:
(1)该反应的

(2)该反应的浓度平衡常数的表达式为

(3)判断该反应一定达到化学平衡状态的依据是___________(填字母)。
A.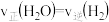 | B.容器内气体的压强不随时间而变化 |
| C.CO的物质的量不随时间而变化 | D.平衡常数K不变 |
| A.使用催化剂 | B.增大压强 |
| C.适当降低温度 | D.提高CO与 的投料比 的投料比 |
 时,反应经2min后达平衡,则2min内用
时,反应经2min后达平衡,则2min内用 表示的反应速率
表示的反应速率
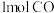 、
、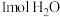 、
、 和
和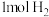 ,反应向
,反应向
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】环保是当今社会最重要的课题,故研究 NOx等大气污染物的处理具有重要意义。
(1)含氮化合物在生产、生命活动中有重要的作用。回答下列问题.
已知.4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH1=-a kJ·mol −1
2NO(g)+O2(g) 2NO2(g) ΔH2=-b kJ·mol −1
2NO2(g) ΔH2=-b kJ·mol −1
4NH3(g)+6NO(g)=5N2(g)+6H2O(g) ΔH3=-c kJ·mol −1
H2O(1)=H2O(g) ΔH4=+d kJ·mol −1
写出在 298K 时,NH3 燃烧的热化学方程式_____ 。
(2)已知 2NO(g) + O2(g) 2NO2(g) 的反应历程分两步进行,其反应过程能量变化如图
2NO2(g) 的反应历程分两步进行,其反应过程能量变化如图
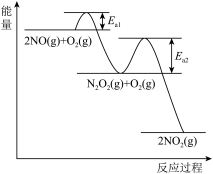
①2NO(g) N2O2(g) ν1正=k1正 c2(NO),ν1逆=k1逆 c(N2O2)
N2O2(g) ν1正=k1正 c2(NO),ν1逆=k1逆 c(N2O2)
②N2O2(g)+ O2(g) 2NO2 ν2正=k2正 c (N2O2)·c (O2) , ν2逆=k2逆 c2(NO2)
2NO2 ν2正=k2正 c (N2O2)·c (O2) , ν2逆=k2逆 c2(NO2)
2NO(g) + O2(g) 2NO2(g)反应的决速步骤是
2NO2(g)反应的决速步骤是 _____ (填“①”或“②”), 其判断理由是_____ 。
(3)2NO(g)+O2(g) 2NO2(g) 的平衡常数 K 与上述相关反应的速率常数 k1正、k1 逆、k2正、 k2 逆都有关,则 K=
2NO2(g) 的平衡常数 K 与上述相关反应的速率常数 k1正、k1 逆、k2正、 k2 逆都有关,则 K=_____ ;已知反应速率常数 k 随温度升高而增大, 若升高温度后 k2正、k2 逆分别增大 m 倍和 n 倍,则 m_____ n (填“>”、“<”或“=”);一定条件下,2NO (g)+O2(g) 2NO2 (g)达平衡后,升高到某温度,再达平衡后,ν2正较原平衡减小,根据上述速率方程分析,合理的解释是_________________ 。
(4)在恒容的密闭容器中充入一定量的 NO 和O2气体,保持其它条件不变,请画出该容器中N2O2体积分数随时间 t 变化曲线_____ 。
 。
。
(1)含氮化合物在生产、生命活动中有重要的作用。回答下列问题.
已知.4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH1=-a kJ·mol −1
2NO(g)+O2(g)
 2NO2(g) ΔH2=-b kJ·mol −1
2NO2(g) ΔH2=-b kJ·mol −14NH3(g)+6NO(g)=5N2(g)+6H2O(g) ΔH3=-c kJ·mol −1
H2O(1)=H2O(g) ΔH4=+d kJ·mol −1
写出在 298K 时,NH3 燃烧的热化学方程式
(2)已知 2NO(g) + O2(g)
 2NO2(g) 的反应历程分两步进行,其反应过程能量变化如图
2NO2(g) 的反应历程分两步进行,其反应过程能量变化如图
①2NO(g)
 N2O2(g) ν1正=k1正 c2(NO),ν1逆=k1逆 c(N2O2)
N2O2(g) ν1正=k1正 c2(NO),ν1逆=k1逆 c(N2O2)②N2O2(g)+ O2(g)
 2NO2 ν2正=k2正 c (N2O2)·c (O2) , ν2逆=k2逆 c2(NO2)
2NO2 ν2正=k2正 c (N2O2)·c (O2) , ν2逆=k2逆 c2(NO2) 2NO(g) + O2(g)
 2NO2(g)反应的决速步骤是
2NO2(g)反应的决速步骤是 (3)2NO(g)+O2(g)
 2NO2(g) 的平衡常数 K 与上述相关反应的速率常数 k1正、k1 逆、k2正、 k2 逆都有关,则 K=
2NO2(g) 的平衡常数 K 与上述相关反应的速率常数 k1正、k1 逆、k2正、 k2 逆都有关,则 K=(4)在恒容的密闭容器中充入一定量的 NO 和O2气体,保持其它条件不变,请画出该容器中N2O2体积分数随时间 t 变化曲线
 。
。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】煤炭燃烧时产生大量SO2、NO对环境造成很大污染,将煤进行气化和液化是减少污染的有效手段。
(1)煤的液化是现代能源工业中重点推广的能源综合利用方案,最常见的液化方法为用煤生产CH3OH。已知制备甲醇的有关化学反应及平衡常数如下:
i:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1
CH3OH(g)+H2O(g) △H1
ii:CO2(g)+H2(g) CO(g)+H2O(g) △H2=41.2kJ/mol
CO(g)+H2O(g) △H2=41.2kJ/mol
iii:CO(g)+2H2(g) CH3OH(g) △H3=-132.0kJ/mol
CH3OH(g) △H3=-132.0kJ/mol
850℃时,三个反应的平衡常数分别为K1=160、K2=243、K3=160。
①△H1=_______ ,该反应在_______ (填“高温”或“低温”)能自发进行。
②850℃时,在密闭容器中进行反应i,开始时只加入CO2、H2,反应10min后测得各组分的浓度如表。比较正、逆反应的速率的大小:v正_______ v逆(填“>”“<”或“=”)。
(2)在CO2利用的科研中,中科院天津工业生物所将H2与CO2反应合成甲醇,再由甲醇经若干酶促反应合成淀粉,首次在实验室实现二氧化碳到淀粉的从头合成。该研究成果在碳中和、碳排放、温室效应、粮食危机等方面有着重大意义。回答下列问题:
保持温度T不变,在一刚性密闭容器中,充入一定量的CO2和H2,同时发生反应i和ii,起始及达平衡时,容器内各气体的物质的量如表所示。
已知起始时总压强为1.5pkPa,平衡时体系总压强为pkPa,则表中n1=_______ ,反应i的平衡常数Kp=_______ 。(含p的式子表示)
(1)煤的液化是现代能源工业中重点推广的能源综合利用方案,最常见的液化方法为用煤生产CH3OH。已知制备甲醇的有关化学反应及平衡常数如下:
i:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1
CH3OH(g)+H2O(g) △H1ii:CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=41.2kJ/mol
CO(g)+H2O(g) △H2=41.2kJ/moliii:CO(g)+2H2(g)
 CH3OH(g) △H3=-132.0kJ/mol
CH3OH(g) △H3=-132.0kJ/mol850℃时,三个反应的平衡常数分别为K1=160、K2=243、K3=160。
①△H1=
②850℃时,在密闭容器中进行反应i,开始时只加入CO2、H2,反应10min后测得各组分的浓度如表。比较正、逆反应的速率的大小:v正
| 物质 | H2 | CO2 | CH3OH | H2O |
| 浓度/mol/L | 0.2 | 0.5 | 0.8 | 0.8 |
保持温度T不变,在一刚性密闭容器中,充入一定量的CO2和H2,同时发生反应i和ii,起始及达平衡时,容器内各气体的物质的量如表所示。
| CO2 | H2 | CH3OH | CO | H2O | |
| 起始量/mol | 4.0 | 8.0 | 0 | 0 | 0 |
| 平衡量/mol | n1 | 3.0 |
您最近一年使用:0次
【推荐1】印刷电路板废液主要含CuCl2、FeCl2以及少量的FeCl3等物质,以废液为原料制备CuSO4,实现资源回收再利用,流程如下图所示。
(1)粗CuSO4溶液的制备
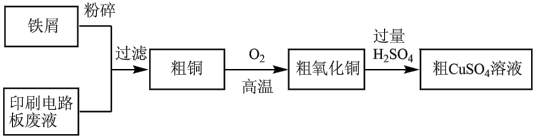
①上述流程中能加快反应速率的措施有___________ 。
②加入铁屑后,印刷电路板废液中发生的离子反应有___________ 。
(2)CuSO4溶液的精制
ⅰ.经检验,粗CuSO4溶液含有Fe2+。
ⅱ.向粗CuSO4溶液滴加3%的H2O2溶液,当溶液中Fe2+完全氧化后,加CuCO3粉末调节溶液的pH=4。
ⅲ.将溶液加热至沸,趁热减压过滤,得到精制CuSO4溶液。
①用离子方程式说明加入H2O2溶液的作用:___________ 。
②已知:25℃时,Ksp[Cu(OH)2]= 2.2×10-20,CuSO4饱和溶液中Cu2+的物质的量浓度为1.41 mol∙L-1。ⅱ中调节溶液pH=4,请结合计算说明此时Cu2+是否开始沉淀___________ 。
(3)工业生产中也可采用电解的方法由Cu制得CuSO4,如图所示
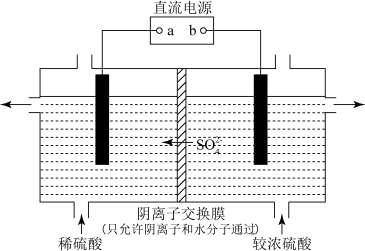
①与直流电源a端相连的电极材料是___________ (填“铜片”a或“石墨”)
②将进口处较浓硫酸替换成Na2SO4溶液进行实验,发现得到的CuSO4溶液pH比替换前升高,结合化学用语解释pH升高的原因是___________ 。
(1)粗CuSO4溶液的制备

①上述流程中能加快反应速率的措施有
②加入铁屑后,印刷电路板废液中发生的离子反应有
(2)CuSO4溶液的精制
ⅰ.经检验,粗CuSO4溶液含有Fe2+。
ⅱ.向粗CuSO4溶液滴加3%的H2O2溶液,当溶液中Fe2+完全氧化后,加CuCO3粉末调节溶液的pH=4。
ⅲ.将溶液加热至沸,趁热减压过滤,得到精制CuSO4溶液。
①用离子方程式说明加入H2O2溶液的作用:
②已知:25℃时,Ksp[Cu(OH)2]= 2.2×10-20,CuSO4饱和溶液中Cu2+的物质的量浓度为1.41 mol∙L-1。ⅱ中调节溶液pH=4,请结合计算说明此时Cu2+是否开始沉淀
(3)工业生产中也可采用电解的方法由Cu制得CuSO4,如图所示

①与直流电源a端相连的电极材料是
②将进口处较浓硫酸替换成Na2SO4溶液进行实验,发现得到的CuSO4溶液pH比替换前升高,结合化学用语解释pH升高的原因是
您最近一年使用:0次
【推荐2】二氧化硫是大气污染物,利用SO2→CaSO4→CaS转化可实现变废为宝。
回答下列问题:
(1)已知:Ⅰ.C(s)+CO2(g)=2CO(g) △H1=+172kJ·mol-1;
Ⅱ.CaSO4(s)+2C(s)=2CO2(g)+CaS(s) △H2=+226kJ·mol-1。
若某反应的平衡常数表达式为K=c4(CO),请结合反应Ⅰ、Ⅱ写出此反应的热化学方程式:_____________ 。
(2)向体积为2L的恒容密闭容器中充入1molSO2、4molCO和催化剂,发生反应
SO2(g)+2CO(g) 2CO2(g)+S(g) △H,测得温度对SO2的转化率及催化剂效率的影响如图1所示:
2CO2(g)+S(g) △H,测得温度对SO2的转化率及催化剂效率的影响如图1所示:
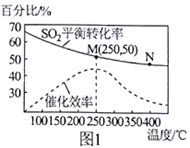
①该反应的△H__________ 0(填“>”或“<”, 下同 );图 中M、N两点的平衡常数:KM_____ KN。
②M点时的化学平衡常数K=____________ 。
(3)向浓度均为0.01mol·L-1的Na2SO4和Na2CO3混合溶液中滴加氯化钙溶液,测得分散系中两种酸根离子的浓度随c(Ca2+ )的变化如图2所示[已知:Ksp(CaCO3)=3×10-9]:
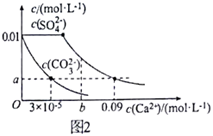
①图中 a=_____________ 。
②该温度下,Ksp(CaSO4)=________________ 。
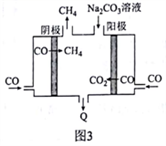
(4)某研究小组设计图3所示装置将副产品CO转化为CH4和Q。该电解总反应的离子方程式为_____________________________ 。
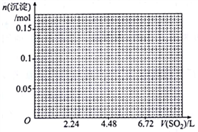
(5)标准状况下,向1L含NaOH、Ca(OH)2各0.1mol的溶液中不断通入SO2至过量,请画出生成沉淀的物质的量(mol)与通入SO2体积(L)的关系图。______
回答下列问题:
(1)已知:Ⅰ.C(s)+CO2(g)=2CO(g) △H1=+172kJ·mol-1;
Ⅱ.CaSO4(s)+2C(s)=2CO2(g)+CaS(s) △H2=+226kJ·mol-1。
若某反应的平衡常数表达式为K=c4(CO),请结合反应Ⅰ、Ⅱ写出此反应的热化学方程式:
(2)向体积为2L的恒容密闭容器中充入1molSO2、4molCO和催化剂,发生反应
SO2(g)+2CO(g)
 2CO2(g)+S(g) △H,测得温度对SO2的转化率及催化剂效率的影响如图1所示:
2CO2(g)+S(g) △H,测得温度对SO2的转化率及催化剂效率的影响如图1所示:
①该反应的△H
②M点时的化学平衡常数K=
(3)向浓度均为0.01mol·L-1的Na2SO4和Na2CO3混合溶液中滴加氯化钙溶液,测得分散系中两种酸根离子的浓度随c(Ca2+ )的变化如图2所示[已知:Ksp(CaCO3)=3×10-9]:

①图中 a=
②该温度下,Ksp(CaSO4)=
(4)某研究小组设计图3所示装置将副产品CO转化为CH4和Q。该电解总反应的离子方程式为

(5)标准状况下,向1L含NaOH、Ca(OH)2各0.1mol的溶液中不断通入SO2至过量,请画出生成沉淀的物质的量(mol)与通入SO2体积(L)的关系图。

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】尿素[CO(NH2)2]合成方法的发展体现了化学科学与技术的不断进步。
(1)德国化学家韦勒(F. Wohler)首次在实验室里用无机物合成了尿素[CO(NH2)2],打破了无机物和有机物之间的界限。尿素分子中σ键和π键个数之比为___________ ,尿素中碳原子的杂化轨道类型为___________ 。
(2)二十世纪初,工业上以CO2和NH3为原料在一定温度和压强下合成尿素。反应分为两步:ⅰ.CO2和NH3生成H2NCOONH4;ⅱ。H2NCOONH4分解生成尿素。
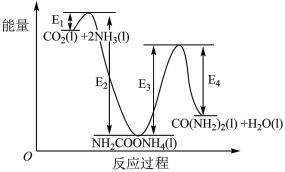
结合反应过程中能量变化示意图,下列说法正确的是___________ (填字母)。
a.活化能:反应ⅰ<反应ⅱ
b.CO2(l) +2NH3(l)= H2NCOONH4(l) △H=+(E2-E1)kJ/mol
c. H2NCOONH4(l)=CO(NH2)2(l)+ H2O(1) △H=+(E3- E4)kJ/mol
d.对反应体系加热,可加快反应速率和提高尿素的产率
(3)近年研究发现,电催化CO2和含氮物质( 等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的KNO3溶液通入CO2至饱和,在电极上反应生成CO(NH2)2,电解原理如图所示(阴、阳极区溶液均为KNO3溶液)。
等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的KNO3溶液通入CO2至饱和,在电极上反应生成CO(NH2)2,电解原理如图所示(阴、阳极区溶液均为KNO3溶液)。

①电解池中电极X应接直流电源的___________ 极。
②电解过程中生成尿素的电极反应式是___________ 。
(4)尿素样品含氮量的测定方法如下。
已知:溶液中c( )不能直接用NaOH溶液准确滴定。
)不能直接用NaOH溶液准确滴定。
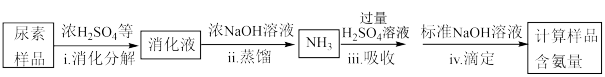
①消化液中的含氮粒子是___________ 。
②下列装置,可以完成蒸馏操作的是___________ (填字母)。
A. B.
B.  C.
C.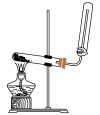 D.
D. 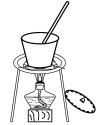
③步骤iv中标准NaOH溶液的浓度和消耗的体积分别为c和V,计算样品含氮量还需要的实验数据有___________ 。
(1)德国化学家韦勒(F. Wohler)首次在实验室里用无机物合成了尿素[CO(NH2)2],打破了无机物和有机物之间的界限。尿素分子中σ键和π键个数之比为
(2)二十世纪初,工业上以CO2和NH3为原料在一定温度和压强下合成尿素。反应分为两步:ⅰ.CO2和NH3生成H2NCOONH4;ⅱ。H2NCOONH4分解生成尿素。

结合反应过程中能量变化示意图,下列说法正确的是
a.活化能:反应ⅰ<反应ⅱ
b.CO2(l) +2NH3(l)= H2NCOONH4(l) △H=+(E2-E1)kJ/mol
c. H2NCOONH4(l)=CO(NH2)2(l)+ H2O(1) △H=+(E3- E4)kJ/mol
d.对反应体系加热,可加快反应速率和提高尿素的产率
(3)近年研究发现,电催化CO2和含氮物质(
 等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的KNO3溶液通入CO2至饱和,在电极上反应生成CO(NH2)2,电解原理如图所示(阴、阳极区溶液均为KNO3溶液)。
等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的KNO3溶液通入CO2至饱和,在电极上反应生成CO(NH2)2,电解原理如图所示(阴、阳极区溶液均为KNO3溶液)。
①电解池中电极X应接直流电源的
②电解过程中生成尿素的电极反应式是
(4)尿素样品含氮量的测定方法如下。
已知:溶液中c(
 )不能直接用NaOH溶液准确滴定。
)不能直接用NaOH溶液准确滴定。
①消化液中的含氮粒子是
②下列装置,可以完成蒸馏操作的是
A.
 B.
B.  C.
C. D.
D. 
③步骤iv中标准NaOH溶液的浓度和消耗的体积分别为c和V,计算样品含氮量还需要的实验数据有
您最近一年使用:0次



