尿素[CO(NH2)2]合成方法的发展体现了化学科学与技术的不断进步。
(1)德国化学家韦勒(F. Wohler)首次在实验室里用无机物合成了尿素[CO(NH2)2],打破了无机物和有机物之间的界限。尿素分子中σ键和π键个数之比为___________ ,尿素中碳原子的杂化轨道类型为___________ 。
(2)二十世纪初,工业上以CO2和NH3为原料在一定温度和压强下合成尿素。反应分为两步:ⅰ.CO2和NH3生成H2NCOONH4;ⅱ。H2NCOONH4分解生成尿素。
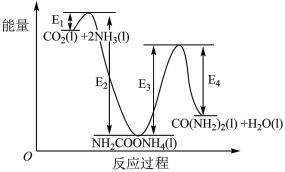
结合反应过程中能量变化示意图,下列说法正确的是___________ (填字母)。
a.活化能:反应ⅰ<反应ⅱ
b.CO2(l) +2NH3(l)= H2NCOONH4(l) △H=+(E2-E1)kJ/mol
c. H2NCOONH4(l)=CO(NH2)2(l)+ H2O(1) △H=+(E3- E4)kJ/mol
d.对反应体系加热,可加快反应速率和提高尿素的产率
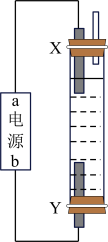
(3)近年研究发现,电催化CO2和含氮物质( 等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的KNO3溶液通入CO2至饱和,在电极上反应生成CO(NH2)2,电解原理如图所示(阴、阳极区溶液均为KNO3溶液)。
等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的KNO3溶液通入CO2至饱和,在电极上反应生成CO(NH2)2,电解原理如图所示(阴、阳极区溶液均为KNO3溶液)。

①电解池中电极X应接直流电源的___________ 极。
②电解过程中生成尿素的电极反应式是___________ 。
(4)尿素样品含氮量的测定方法如下。
已知:溶液中c( )不能直接用NaOH溶液准确滴定。
)不能直接用NaOH溶液准确滴定。
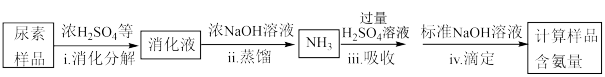
①消化液中的含氮粒子是___________ 。
②下列装置,可以完成蒸馏操作的是___________ (填字母)。
A. B.
B. 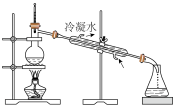 C.
C.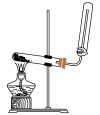 D.
D. 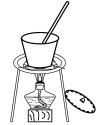
③步骤iv中标准NaOH溶液的浓度和消耗的体积分别为c和V,计算样品含氮量还需要的实验数据有___________ 。
(1)德国化学家韦勒(F. Wohler)首次在实验室里用无机物合成了尿素[CO(NH2)2],打破了无机物和有机物之间的界限。尿素分子中σ键和π键个数之比为
(2)二十世纪初,工业上以CO2和NH3为原料在一定温度和压强下合成尿素。反应分为两步:ⅰ.CO2和NH3生成H2NCOONH4;ⅱ。H2NCOONH4分解生成尿素。

结合反应过程中能量变化示意图,下列说法正确的是
a.活化能:反应ⅰ<反应ⅱ
b.CO2(l) +2NH3(l)= H2NCOONH4(l) △H=+(E2-E1)kJ/mol
c. H2NCOONH4(l)=CO(NH2)2(l)+ H2O(1) △H=+(E3- E4)kJ/mol
d.对反应体系加热,可加快反应速率和提高尿素的产率
(3)近年研究发现,电催化CO2和含氮物质(
 等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的KNO3溶液通入CO2至饱和,在电极上反应生成CO(NH2)2,电解原理如图所示(阴、阳极区溶液均为KNO3溶液)。
等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的KNO3溶液通入CO2至饱和,在电极上反应生成CO(NH2)2,电解原理如图所示(阴、阳极区溶液均为KNO3溶液)。
①电解池中电极X应接直流电源的
②电解过程中生成尿素的电极反应式是
(4)尿素样品含氮量的测定方法如下。
已知:溶液中c(
 )不能直接用NaOH溶液准确滴定。
)不能直接用NaOH溶液准确滴定。
①消化液中的含氮粒子是
②下列装置,可以完成蒸馏操作的是
A.
 B.
B.  C.
C. D.
D. 
③步骤iv中标准NaOH溶液的浓度和消耗的体积分别为c和V,计算样品含氮量还需要的实验数据有
更新时间:2023-11-30 20:13:26
|
相似题推荐
【推荐1】随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点
(1)氨氮是造成水体富营养化的重要因素之一,用次氯酸钠水解生成的次氯酸将水中的氨氮(用NH3表示)转化为氮气除去,其相关反应的主要热化学方程式如下:
反应①:NH3(aq)+HClO(aq)= NH2Cl(aq)+H2O(l)△H1= akJ•mol﹣1
反应②:NH2Cl(aq)+HClO(aq)= NHCl2(aq)+H2O(I)△H2= bkJ•mol﹣1
反应③:2NHCl2(aq)+H2O(l)= N2(g)+HClO(aq)+3HCl(aq)△H3= ckJ•mol﹣1
① 2NH3(aq)+3HClO(aq)= N2(g)+3H2O(I)+3HCl(aq)的△H=______ 。
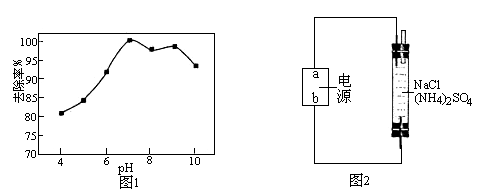
② 溶液pH对次氯酸钠去除氨氮有较大的影响(如图1所示)。在pH较低时溶液中有无色无味的气体生成,氨氮去除效率较低,其原因是_________________ 。
③ 用电化学法也可以去除废水中氨氮.在蒸馏水中加入硫酸铵用惰性电极直接电解发现氨氮去除效率极低,但在溶液中再加入一定量的氯化钠后,去除效率可以大大提高。反应装置如图2所示,b为电极__ 极,电解时阴极的电极反应式为_____________ 。
(2)“低碳经济”正成为科学家研究的主要课题。
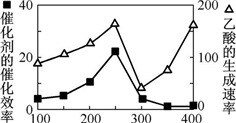
① 以二氧化钛表面覆盖Cu2Al2O4 为催化剂,可以将CO2 和CH4 直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如右图所示。250~300 ℃时,温度升高而乙酸的生成速率降低的原因是__________________ 。
② 为了提高该反应中CO2的转化率,可以采取的措施是_____________ 。(写一条即可)
(1)氨氮是造成水体富营养化的重要因素之一,用次氯酸钠水解生成的次氯酸将水中的氨氮(用NH3表示)转化为氮气除去,其相关反应的主要热化学方程式如下:
反应①:NH3(aq)+HClO(aq)= NH2Cl(aq)+H2O(l)△H1= akJ•mol﹣1
反应②:NH2Cl(aq)+HClO(aq)= NHCl2(aq)+H2O(I)△H2= bkJ•mol﹣1
反应③:2NHCl2(aq)+H2O(l)= N2(g)+HClO(aq)+3HCl(aq)△H3= ckJ•mol﹣1
① 2NH3(aq)+3HClO(aq)= N2(g)+3H2O(I)+3HCl(aq)的△H=
② 溶液pH对次氯酸钠去除氨氮有较大的影响(如图1所示)。在pH较低时溶液中有无色无味的气体生成,氨氮去除效率较低,其原因是
③ 用电化学法也可以去除废水中氨氮.在蒸馏水中加入硫酸铵用惰性电极直接电解发现氨氮去除效率极低,但在溶液中再加入一定量的氯化钠后,去除效率可以大大提高。反应装置如图2所示,b为电极

(2)“低碳经济”正成为科学家研究的主要课题。
① 以二氧化钛表面覆盖Cu2Al2O4 为催化剂,可以将CO2 和CH4 直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如右图所示。250~300 ℃时,温度升高而乙酸的生成速率降低的原因是
② 为了提高该反应中CO2的转化率,可以采取的措施是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】已知汽车尾气中的主要污染物为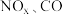 、超细颗粒(
、超细颗粒(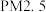 )等有害物质.目前,已研究出了多种消除汽车尾气污染的方法.
)等有害物质.目前,已研究出了多种消除汽车尾气污染的方法.
(1)工业上可采用 和
和 合成甲醇,发生反应为(Ⅰ)
合成甲醇,发生反应为(Ⅰ)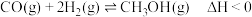
在恒容密闭容器里按体积比为 充入一氧化碳和氢气,一定条件下反应达到平衡状态.当改变反应的
充入一氧化碳和氢气,一定条件下反应达到平衡状态.当改变反应的某一个 条件后,下列变化能说明平衡一定 向正反应方向移动的是___________ .
A.正反应速率先增大后减小 B.逆反应速率先增大后减小
C.化学平衡常数K值增大 D.反应物的体积百分含量增大
E.混合气体的密度减小 F.氢气的转化率减小
(2)①汽车在行驶过程中有如下反应发生:i.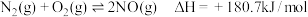
ii.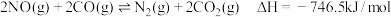
写出表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为_____________________________________________ .
②在汽车上安装三元催化转化器可实现反应:
(Ⅱ)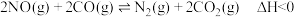 .
.
则该反应在___________ (填高温、低温或任何温度)下能自发进行.
(3)将 和
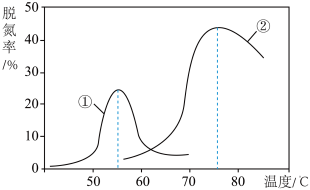
和 以一定的流速通过两种不同的催化剂进行反应(Ⅱ),经过相同时间内测量逸出气体中
以一定的流速通过两种不同的催化剂进行反应(Ⅱ),经过相同时间内测量逸出气体中 的含量,从而确定尾气脱氮率(脱氮率即
的含量,从而确定尾气脱氮率(脱氮率即 的转化率),结果如图所示.以下说法正确的是___________
的转化率),结果如图所示.以下说法正确的是___________
(4)用焦炭还原 的反应为:
的反应为: ,在恒温条件下,
,在恒温条件下,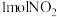 和足量C发生该反应,测得平衡时
和足量C发生该反应,测得平衡时 和
和 的物质的量浓度与平衡总压的关系如图所示:
的物质的量浓度与平衡总压的关系如图所示:
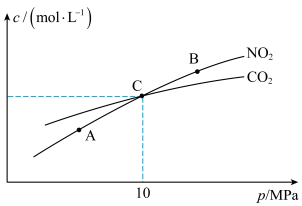
①A、B两点的浓度平衡常数关系: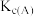
___________ 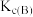 (填“<”或“>”或“=”).
(填“<”或“>”或“=”).
②A、B、C三点中 的转化率最高的是
的转化率最高的是___________ (填“A”或“B”或“C”)点.
③计算C点时该反应的压强平衡常数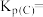
___________ ( 是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(5)在汽车尾气的净化装置中 和
和 发生如下反应:
发生如下反应: .实验测得,
.实验测得,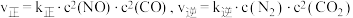 (
( 为速率常数,只与温度有关).
为速率常数,只与温度有关).
①达到平衡后,仅升高温度, 增大的倍数
增大的倍数___________ (填“>”、“<”或“=”) 增大的倍数.
增大的倍数.
②若在 的密闭容器中充入
的密闭容器中充入 和
和 ,在一定温度下达到平衡时,
,在一定温度下达到平衡时, 的转化率为40%,则
的转化率为40%,则
___________ (保留2位有效数字).
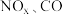 、超细颗粒(
、超细颗粒( )等有害物质.目前,已研究出了多种消除汽车尾气污染的方法.
)等有害物质.目前,已研究出了多种消除汽车尾气污染的方法.(1)工业上可采用
 和
和 合成甲醇,发生反应为(Ⅰ)
合成甲醇,发生反应为(Ⅰ)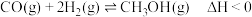
在恒容密闭容器里按体积比为
 充入一氧化碳和氢气,一定条件下反应达到平衡状态.当改变反应的
充入一氧化碳和氢气,一定条件下反应达到平衡状态.当改变反应的A.正反应速率先增大后减小 B.逆反应速率先增大后减小
C.化学平衡常数K值增大 D.反应物的体积百分含量增大
E.混合气体的密度减小 F.氢气的转化率减小
(2)①汽车在行驶过程中有如下反应发生:i.
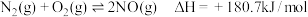
ii.
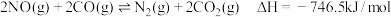
写出表示
 燃烧热的热化学方程式为
燃烧热的热化学方程式为②在汽车上安装三元催化转化器可实现反应:
(Ⅱ)
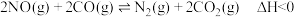 .
.则该反应在
(3)将
 和
和 以一定的流速通过两种不同的催化剂进行反应(Ⅱ),经过相同时间内测量逸出气体中
以一定的流速通过两种不同的催化剂进行反应(Ⅱ),经过相同时间内测量逸出气体中 的含量,从而确定尾气脱氮率(脱氮率即
的含量,从而确定尾气脱氮率(脱氮率即 的转化率),结果如图所示.以下说法正确的是___________
的转化率),结果如图所示.以下说法正确的是___________
| A.第②种催化剂比第①种催化剂脱氮率高 |
| B.相同条件下,改变压强对脱氮率没有影响 |
| C.曲线①、②最高点表示此时平衡转化率最高 |
D.两种催化剂分别适宜于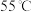 和 和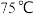 左右脱氮 左右脱氮 |
(4)用焦炭还原
 的反应为:
的反应为: ,在恒温条件下,
,在恒温条件下,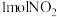 和足量C发生该反应,测得平衡时
和足量C发生该反应,测得平衡时 和
和 的物质的量浓度与平衡总压的关系如图所示:
的物质的量浓度与平衡总压的关系如图所示:
①A、B两点的浓度平衡常数关系:
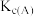
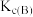 (填“<”或“>”或“=”).
(填“<”或“>”或“=”).②A、B、C三点中
 的转化率最高的是
的转化率最高的是③计算C点时该反应的压强平衡常数
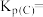
 是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).(5)在汽车尾气的净化装置中
 和
和 发生如下反应:
发生如下反应: .实验测得,
.实验测得,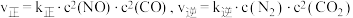 (
( 为速率常数,只与温度有关).
为速率常数,只与温度有关).①达到平衡后,仅升高温度,
 增大的倍数
增大的倍数 增大的倍数.
增大的倍数.②若在
 的密闭容器中充入
的密闭容器中充入 和
和 ,在一定温度下达到平衡时,
,在一定温度下达到平衡时, 的转化率为40%,则
的转化率为40%,则
您最近一年使用:0次
【推荐3】“碳中和”引起各国的高度重视,正成为科学家研究的主要课题,利用 催化加氢制二甲醚,可以实现
催化加氢制二甲醚,可以实现 的再利用,涉及以下主要反应:
的再利用,涉及以下主要反应:
Ⅰ.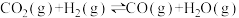

Ⅱ.

相关物质及能量变化的示意图如图所示。
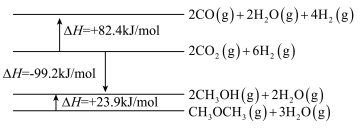
(1)反应Ⅱ的 =
=___________ ,该反应在___________ (填“高温”“低温”或“任何温度”)下能自发进行。
(2)恒压条件下, 、
、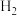 起始量相等时,
起始量相等时, 的平衡转化率和
的平衡转化率和 的选择性随温度变化如图所示。已知:
的选择性随温度变化如图所示。已知: 的选择性
的选择性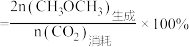
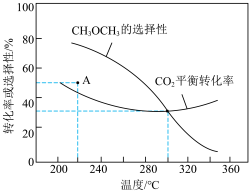
①高于300℃, 的平衡转化率随温度升高而上升的原因是
的平衡转化率随温度升高而上升的原因是___________ 。
②300℃时,反应Ⅱ的平衡常数表达式:K=___________ ,通入 、
、 各1mol,平衡时
各1mol,平衡时 的选择性、
的选择性、 的平衡转化率都为30%,平衡时生成
的平衡转化率都为30%,平衡时生成 的物质的量为
的物质的量为___________ mol。
③220℃时,不改变反应时间和温度,一定能提高 的选择性的措施有
的选择性的措施有___________ (任写一种)
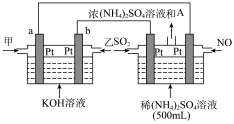
(3)利用 燃料电池电解,可将雾霾中的NO、
燃料电池电解,可将雾霾中的NO、 分别转化为
分别转化为 和
和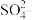 ,如图装置所示,则a极发生的电极反应式为
,如图装置所示,则a极发生的电极反应式为___________ 。
 催化加氢制二甲醚,可以实现
催化加氢制二甲醚,可以实现 的再利用,涉及以下主要反应:
的再利用,涉及以下主要反应:Ⅰ.
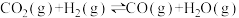

Ⅱ.


相关物质及能量变化的示意图如图所示。

(1)反应Ⅱ的
 =
=(2)恒压条件下,
 、
、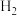 起始量相等时,
起始量相等时, 的平衡转化率和
的平衡转化率和 的选择性随温度变化如图所示。已知:
的选择性随温度变化如图所示。已知: 的选择性
的选择性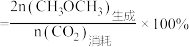

①高于300℃,
 的平衡转化率随温度升高而上升的原因是
的平衡转化率随温度升高而上升的原因是②300℃时,反应Ⅱ的平衡常数表达式:K=
 、
、 各1mol,平衡时
各1mol,平衡时 的选择性、
的选择性、 的平衡转化率都为30%,平衡时生成
的平衡转化率都为30%,平衡时生成 的物质的量为
的物质的量为③220℃时,不改变反应时间和温度,一定能提高
 的选择性的措施有
的选择性的措施有(3)利用
 燃料电池电解,可将雾霾中的NO、
燃料电池电解,可将雾霾中的NO、 分别转化为
分别转化为 和
和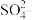 ,如图装置所示,则a极发生的电极反应式为
,如图装置所示,则a极发生的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】Ⅰ、(1)惰性电极电解硫酸铜溶液的化学方程式_____________________________ 。
(2)惰性电极电解饱和食盐水的化学方程式_____________________________ 。
Ⅱ、某小组同学认为,如果模拟工业上用离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
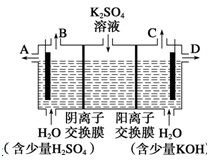
(3)该电解槽的阳极反应式为________________________________ 。此时通过阴离子交换膜的离子数________ (填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
(4)制得的氢氧化钾溶液从出口________ (填写“A”、“B”、“C”或“D”)导出。
(5)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的反应式为____________________________________________________ 。
(2)惰性电极电解饱和食盐水的化学方程式
Ⅱ、某小组同学认为,如果模拟工业上用离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。

(3)该电解槽的阳极反应式为
(4)制得的氢氧化钾溶液从出口
(5)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】Ⅰ.氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过氨热分解法制氢气。相关化学键的键能数据如下表:
一定温度下,利用催化剂将 分解为
分解为 和
和 。回答下列问题:
。回答下列问题:
(1)反应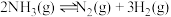

_______  。
。
(2)已知该反应的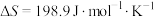 ,在下列哪些温度下反应能自发进行?_______(填标号)
,在下列哪些温度下反应能自发进行?_______(填标号)
Ⅱ.设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。回答下列问题:
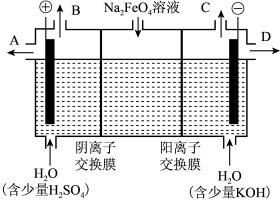
(3)该电解槽的阳极反应式为_______ 。
(4)制得的氢氧化钾溶液从出口_______ (填“A”、“B”、“C”或“D”)导出。
| 化学键 |  |  |  |
键能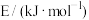 | 946 | 436.0 | 390.8 |
一定温度下,利用催化剂将
 分解为
分解为 和
和 。回答下列问题:
。回答下列问题:(1)反应
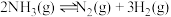

 。
。(2)已知该反应的
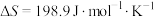 ,在下列哪些温度下反应能自发进行?_______(填标号)
,在下列哪些温度下反应能自发进行?_______(填标号)| A.298K | B.398K | C.498K | D.598K |
Ⅱ.设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。回答下列问题:

(3)该电解槽的阳极反应式为
(4)制得的氢氧化钾溶液从出口
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】B、N、F、Ga、As是新一代太阳能电池、半导体材料中含有的主要元素。回答下列问题:
(1)基态Ga原子的核外电子排布式是__________ ,基态Ga原子核外电子占据最高能级的电子云轮廓图为________ 。
(2)在第四周期中,与基态As原子核外未成对电子数目相同的元素为__________ 。
(3)NF3的立体构型为_______ 。N2F2分子中各原子都满足8电子结构,分子中σ键和π键的个数比为______ ,氮原子的杂化轨道类型为__________ 。
(4)B、Al、Ga单质的熔点依次为2300°C,660°C,29.8°C,解释熔点产生差异的原因______ 。
(5)由B、N、F组成的某离子化合物中,B、N、F的原子个数比为1:1:8,其阴、阳离子互为等电子体,该化合物中的阳离子、阴离子符号分别为__________ 。
(6)GaAs晶体结构如图所示。
①图中As原子的坐标参数为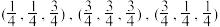 ,
,_______ 。
②已知晶胞中相邻且最近的Ga、As原子的核间距为acm,NA为阿伏加 德罗常数的值,晶体的密度为___________ g/cm3(填写表达式)。

(1)基态Ga原子的核外电子排布式是
(2)在第四周期中,与基态As原子核外未成对电子数目相同的元素为
(3)NF3的立体构型为
(4)B、Al、Ga单质的熔点依次为2300°C,660°C,29.8°C,解释熔点产生差异的原因
(5)由B、N、F组成的某离子化合物中,B、N、F的原子个数比为1:1:8,其阴、阳离子互为等电子体,该化合物中的阳离子、阴离子符号分别为
(6)GaAs晶体结构如图所示。
①图中As原子的坐标参数为
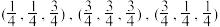 ,
,②已知晶胞中相邻且最近的Ga、As原子的核间距为acm,NA为阿伏加 德罗常数的值,晶体的密度为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】二甲基亚砜(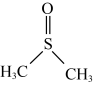 )是一种重要的非质子极性溶剂。铬和锰等过渡金属卤化物在二甲基亚砜中有一定溶解度,故可以应用在有机电化学中。回答下列问题:
)是一种重要的非质子极性溶剂。铬和锰等过渡金属卤化物在二甲基亚砜中有一定溶解度,故可以应用在有机电化学中。回答下列问题:
(1)基态 原子的价电子排布图(轨道表示式)为
原子的价电子排布图(轨道表示式)为_______ 。
(2)铬和锰基态原子核外未成对电子数之比为_______ 。
(3)已知:二甲基亚砜能够与水和丙酮(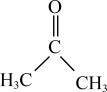 )分别以任意比互溶。
)分别以任意比互溶。
①二甲基亚砜分子中硫原子的杂化类型为_______ 。
②丙酮分子中各原子电负性由大到小的顺序为_______ 。
③二甲基亚砜易溶于水,原因可能为_______ 。
(4) 的结构有三种,且铬的配位数均为6,等物质的量的三种物质电离出的氯离子数目之比为
的结构有三种,且铬的配位数均为6,等物质的量的三种物质电离出的氯离子数目之比为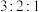 ,对应的颜色分别为紫色、浅绿色和蓝绿色。其中浅绿色的结构中配离子的化学式为
,对应的颜色分别为紫色、浅绿色和蓝绿色。其中浅绿色的结构中配离子的化学式为_______ ,该分子内的作用力不可能含有_______ (填序号)。
A.离子键 B.共价键 C.金属键 D.配位键 E.氢键 F.范德华力
(5)已知硫化锰( )晶胞如图所示,该晶胞参数
)晶胞如图所示,该晶胞参数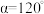 ,
,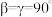 。
。
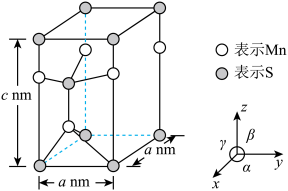
①该晶体中,锰原子周围的硫原子数目为_______ 。
②空间利用率指的是构成晶体的原子、离子或分子在整个晶体空间中所占有的体积百分比。已知锰和硫的原子半径分别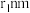 和
和 ,该晶体中原子的空间利用率为(列出计算式即可)
,该晶体中原子的空间利用率为(列出计算式即可)_______ 。
 )是一种重要的非质子极性溶剂。铬和锰等过渡金属卤化物在二甲基亚砜中有一定溶解度,故可以应用在有机电化学中。回答下列问题:
)是一种重要的非质子极性溶剂。铬和锰等过渡金属卤化物在二甲基亚砜中有一定溶解度,故可以应用在有机电化学中。回答下列问题:(1)基态
 原子的价电子排布图(轨道表示式)为
原子的价电子排布图(轨道表示式)为(2)铬和锰基态原子核外未成对电子数之比为
(3)已知:二甲基亚砜能够与水和丙酮(
 )分别以任意比互溶。
)分别以任意比互溶。①二甲基亚砜分子中硫原子的杂化类型为
②丙酮分子中各原子电负性由大到小的顺序为
③二甲基亚砜易溶于水,原因可能为
(4)
 的结构有三种,且铬的配位数均为6,等物质的量的三种物质电离出的氯离子数目之比为
的结构有三种,且铬的配位数均为6,等物质的量的三种物质电离出的氯离子数目之比为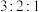 ,对应的颜色分别为紫色、浅绿色和蓝绿色。其中浅绿色的结构中配离子的化学式为
,对应的颜色分别为紫色、浅绿色和蓝绿色。其中浅绿色的结构中配离子的化学式为A.离子键 B.共价键 C.金属键 D.配位键 E.氢键 F.范德华力
(5)已知硫化锰(
 )晶胞如图所示,该晶胞参数
)晶胞如图所示,该晶胞参数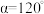 ,
,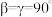 。
。
①该晶体中,锰原子周围的硫原子数目为
②空间利用率指的是构成晶体的原子、离子或分子在整个晶体空间中所占有的体积百分比。已知锰和硫的原子半径分别
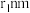 和
和 ,该晶体中原子的空间利用率为(列出计算式即可)
,该晶体中原子的空间利用率为(列出计算式即可)
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】我国科学家制备了一种ZnPc/C60太阳能电池,其结构示意图如下。
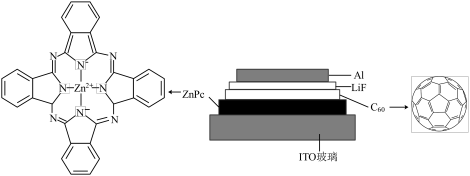
(1)铝元素属于_____________ 区(填“s”“d”“ ”或“p”)。
”或“p”)。
(2)C60分子中60个碳原子都是等价的,均以近似_____________ 杂化的方式形成3个不共平面的σ键,余下的1个p轨道电子互相重叠形成闭壳层电子结构,π电子云分布在C60分子笼的内外层表面上。循环伏安测试表明:C60在溶液中可以逐步可逆地接受6个电子形成负离子,却很难失去电子变为阳离子。
(3)①ZnPc中Zn2+的价层电子排布式是_____________ 。
②ZnPc中存在配位键的原因是_____________ 。
(4)某溶剂中,ZnPc可以和C60形成分子间电荷转移复合物,反应方程式可表示为:ZnPc+C60 ZnPc-C60,不同温度下生成电荷转移复合物的平衡常数如下表。
ZnPc-C60,不同温度下生成电荷转移复合物的平衡常数如下表。
反应:ZnPc+C60 ZnPc-C60△H
ZnPc-C60△H_____________ 0(填“>”或“<”),ZnPc-C60中ZnPc是电子_____________ (填“给体”或“受体”)。
(5)LiF晶体结构属于氯化钠型,其晶胞结构如图所示。
①LiF的熔点和沸点比NaCl的高,请解释原因_____________ 。
②LiF晶体的密度约为2.6g/cm3,LiF晶胞的体积约为_____________ cm3(计算结果保留一位有效数字)。


(1)铝元素属于
 ”或“p”)。
”或“p”)。(2)C60分子中60个碳原子都是等价的,均以近似
(3)①ZnPc中Zn2+的价层电子排布式是
②ZnPc中存在配位键的原因是
(4)某溶剂中,ZnPc可以和C60形成分子间电荷转移复合物,反应方程式可表示为:ZnPc+C60
 ZnPc-C60,不同温度下生成电荷转移复合物的平衡常数如下表。
ZnPc-C60,不同温度下生成电荷转移复合物的平衡常数如下表。温度 | 生成ZnPc-C60的K |
24℃ | 1.2329 |
44℃ | 0.9674 |
64℃ | 0.4923 |
 ZnPc-C60△H
ZnPc-C60△H(5)LiF晶体结构属于氯化钠型,其晶胞结构如图所示。
①LiF的熔点和沸点比NaCl的高,请解释原因
②LiF晶体的密度约为2.6g/cm3,LiF晶胞的体积约为

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】乙酸乙酯是一种重要的化工原料,广泛用于药物染料、香料等工业。查阅资料得到下列数据:
请回答以下问题:
(1)实验室常用下图装置来制备乙酸乙酯。
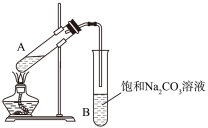
①配制反应混合液时,乙醇、冰醋酸和浓硫酸的混合顺序是________ ;浓硫酸对反应有催化作用,但加入的浓硫酸不能太多也不能太少,原因是________ 。
②防止加热时液体暴沸,需要在试管加入碎瓷片,如果加热一段时间后发现忘记了加碎瓷片,应该采取的正确操作是________ 。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
③实验中饱和碳酸钠溶液的作用是________ 。
(2)产品纯化。分液法从试管B中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,首先向乙酸乙酯中加入无水氯化钙,除去________ (填名称);然后再加入无水硫酸钠除去水,最后进行________ (填操作名称),得到较纯净的乙酸乙酯。
(3)该实验中用30 g乙酸与46 g乙醇反应,如果实际得到的乙酸乙酯的质量是30.8 g,则该实验中乙酸乙酯的产率是________ 。(产率指的是某种生成物的实际产量与理论产量的比值)
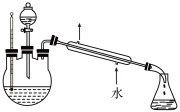
(4)另一化学小组设计下图所示的装置制取乙酸乙酯(铁架台、铁夹、加热装置均已略去)。此装置和上图装置相比的优点是________ (写出一条即可)。
| 物质 | 沸点/℃ | 密度/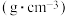 | 相对分子质量 | 水溶性 |
| 乙醇 | 78.0 | 0.8 | 46 | 互溶 |
| 乙酸 | 118.0 | 1.1 | 60 | 可溶 |
| 乙酸乙酯 | 77.5 | 0.9 | 88 | 微溶 |
| 乙醚 | 34.6℃ | 0.7 | 74 | 微溶 |
| 浓硫酸(98%) | 338.0 | 1.8 | 98 | 易溶 |
| 无水氯化钙 | 可与乙醇形成难溶于水的CaCl2·6C2H5OH | |||
(1)实验室常用下图装置来制备乙酸乙酯。

①配制反应混合液时,乙醇、冰醋酸和浓硫酸的混合顺序是
②防止加热时液体暴沸,需要在试管加入碎瓷片,如果加热一段时间后发现忘记了加碎瓷片,应该采取的正确操作是
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
③实验中饱和碳酸钠溶液的作用是
(2)产品纯化。分液法从试管B中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,首先向乙酸乙酯中加入无水氯化钙,除去
(3)该实验中用30 g乙酸与46 g乙醇反应,如果实际得到的乙酸乙酯的质量是30.8 g,则该实验中乙酸乙酯的产率是
(4)另一化学小组设计下图所示的装置制取乙酸乙酯(铁架台、铁夹、加热装置均已略去)。此装置和上图装置相比的优点是

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】I.亚硫酸盐是一种常见的食品添加剂。
为检验某食品中亚硫酸盐含量(通常以1kg样品中含 的质量计),某研究小组同学设计了如下实验方案。
的质量计),某研究小组同学设计了如下实验方案。
a.称取样品Wg;
b.向样品中加入足量稀硫酸;
c.将b中产生的 用足量
用足量 溶液吸收;
溶液吸收;
d.将c所得硫酸溶液用氢氧化钠标准液滴定;
e.数据处理。
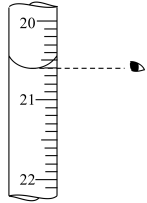
(1)步骤d中可选用的指示剂为___________ 。下图显示滴定终点时,滴定管(量程为25mL)读数为___________ 。 的质量是
的质量是___________ g(用含W、V的代数式表示)。
(3)步骤d中的下列操作会造成该实验亚硫酸盐含量测定结果偏低的有___________ (填序号)。
①量取一定体积待测硫酸溶液前,酸式滴定管未用待测硫酸溶液润洗
②装入氢氧化钠标准液前,碱式滴定管未用氢氧化钠标准液润洗
③滴定开始读数时仰视读数
II.
(4)绿色电源“直接二甲醚(CH3OCH3)燃料电池”的工作原理如图所示:___________ ,
B电极的电极反应式是___________ 。
(5)以KOH溶液为离子导体,组成 清洁燃料电池的总反应式为
清洁燃料电池的总反应式为_______ 。
为检验某食品中亚硫酸盐含量(通常以1kg样品中含
 的质量计),某研究小组同学设计了如下实验方案。
的质量计),某研究小组同学设计了如下实验方案。a.称取样品Wg;
b.向样品中加入足量稀硫酸;
c.将b中产生的
 用足量
用足量 溶液吸收;
溶液吸收;d.将c所得硫酸溶液用氢氧化钠标准液滴定;
e.数据处理。
(1)步骤d中可选用的指示剂为
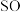 的质量是
的质量是(3)步骤d中的下列操作会造成该实验亚硫酸盐含量测定结果偏低的有
①量取一定体积待测硫酸溶液前,酸式滴定管未用待测硫酸溶液润洗
②装入氢氧化钠标准液前,碱式滴定管未用氢氧化钠标准液润洗
③滴定开始读数时仰视读数
II.
(4)绿色电源“直接二甲醚(CH3OCH3)燃料电池”的工作原理如图所示:

B电极的电极反应式是
(5)以KOH溶液为离子导体,组成
 清洁燃料电池的总反应式为
清洁燃料电池的总反应式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
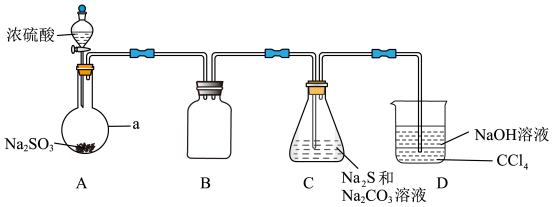
【推荐3】硫代硫酸钠(Na2S2O3)是一种重要的化工产品。某研究小组制备硫代硫酸钠晶体(Na2S2O3·5H2O)的实验装置如图所示(省略夹持装置):
【查阅资料】
Ⅰ.Na2S2O3·5H2O是无色晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成;
Ⅱ.向Na2CO3和Na2S混合液中通入SO2可制得Na2S2O3。
根据题意,填写下列空白。
(1)仪器a的名称是___ ;B的作用是___ 。
(2)C中反应氧化剂与还原剂的物质的量之比为___ 。
(3)该实验制取的产品中常含有少量Na2SO3和Na2SO4杂质。为了检验产品中是否含有这两种杂质,某小组设计了以下实验方案(所需试剂从稀硝酸、稀硫酸、稀盐酸、蒸馏水中选择),请将方案补充完整。
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,过滤、洗涤后,向沉淀中滴加足量的___ (填试剂名称),若___ (填实验现象),则可以确定产品中含有Na2SO3和Na2SO4。
(4)称取样品137.5g配成500mL溶液。取50mL溶液,向其中加入足量稀硫酸,充分反应(S2O +2H+=S↓+SO2↑+H2O),静置、过滤、洗涤、干燥、称量得沉淀1.6g。
+2H+=S↓+SO2↑+H2O),静置、过滤、洗涤、干燥、称量得沉淀1.6g。
准确配制500mL溶液所需仪器有:天平、药匙、烧杯、玻璃棒、___ 、___ 。经计算,样品中硫代硫酸晶体的百分含量为___ 。(保留三位有效数字)

【查阅资料】
Ⅰ.Na2S2O3·5H2O是无色晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成;
Ⅱ.向Na2CO3和Na2S混合液中通入SO2可制得Na2S2O3。
根据题意,填写下列空白。
(1)仪器a的名称是
(2)C中反应氧化剂与还原剂的物质的量之比为
(3)该实验制取的产品中常含有少量Na2SO3和Na2SO4杂质。为了检验产品中是否含有这两种杂质,某小组设计了以下实验方案(所需试剂从稀硝酸、稀硫酸、稀盐酸、蒸馏水中选择),请将方案补充完整。
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,过滤、洗涤后,向沉淀中滴加足量的
(4)称取样品137.5g配成500mL溶液。取50mL溶液,向其中加入足量稀硫酸,充分反应(S2O
 +2H+=S↓+SO2↑+H2O),静置、过滤、洗涤、干燥、称量得沉淀1.6g。
+2H+=S↓+SO2↑+H2O),静置、过滤、洗涤、干燥、称量得沉淀1.6g。准确配制500mL溶液所需仪器有:天平、药匙、烧杯、玻璃棒、
您最近一年使用:0次