解题方法
1 . 乙酸乙酯在工业上有着广泛的用途。科学家以乙烯、乙酸为原料,杂多酸作催化剂制备乙酸乙酯,反应原理为CH2=CH2(g)+CH3COOH(g) CH3COOC2H5(l)
CH3COOC2H5(l)
(1)回答下列问题:
I.2C(s)+2H2(g) CH2=CH2(g) △H1=+52.3
CH2=CH2(g) △H1=+52.3
Ⅱ.2C(s)+2H2(g)+O2(g) CH3COOH(g) △H2=-436.4
CH3COOH(g) △H2=-436.4
Ⅲ.4C(s)+4H2(g)+O2(g CH3COOC2H5(l) △H3=-463.2
CH3COOC2H5(l) △H3=-463.2
以乙烯(g)、乙酸(g)为原料制备乙酸乙酯(l)的反应的热化学方程式为_____ 。
(2)一定条件下,在一个密闭容器中,通入各1mol的乙烯和乙酸气体,发生上述反应。
①若保持温度和压强不变,下列描述能说明反应已达化学平衡的是_____ (填字母)。
A.单位时间内,消耗乙烯和生成乙酸的物质的量相同
B.容器内混合气体的密度不再变化
C. 不再变化
不再变化
D.体系中乙烯和乙酸的转化率相等
②分别在压强P1、P2下,相同时间内测得乙酸乙酯的产率随温度的变化如图。

P1_____ P2(填“>”或“<”),理由是_____ 。A点后乙酸乙酯产率随温度升高反而下降的原因可能是_____ 。A点该反应的压强平衡常数Kp=_____ (用含P1的代数式表示)。
(3)科学家设想通过电化学方法实现乙烯的转化,其原理如图所示(均为惰性电极)。图中b极为_____ 极,M极上的电极反应式为_____ 。

 CH3COOC2H5(l)
CH3COOC2H5(l)(1)回答下列问题:
I.2C(s)+2H2(g)
 CH2=CH2(g) △H1=+52.3
CH2=CH2(g) △H1=+52.3
Ⅱ.2C(s)+2H2(g)+O2(g)
 CH3COOH(g) △H2=-436.4
CH3COOH(g) △H2=-436.4
Ⅲ.4C(s)+4H2(g)+O2(g
 CH3COOC2H5(l) △H3=-463.2
CH3COOC2H5(l) △H3=-463.2
以乙烯(g)、乙酸(g)为原料制备乙酸乙酯(l)的反应的热化学方程式为
(2)一定条件下,在一个密闭容器中,通入各1mol的乙烯和乙酸气体,发生上述反应。
①若保持温度和压强不变,下列描述能说明反应已达化学平衡的是
A.单位时间内,消耗乙烯和生成乙酸的物质的量相同
B.容器内混合气体的密度不再变化
C.
 不再变化
不再变化D.体系中乙烯和乙酸的转化率相等
②分别在压强P1、P2下,相同时间内测得乙酸乙酯的产率随温度的变化如图。

P1
(3)科学家设想通过电化学方法实现乙烯的转化,其原理如图所示(均为惰性电极)。图中b极为

您最近一年使用:0次
名校
解题方法
2 . 一碳产品是石油的良好替代品,一碳化学与绿色化工结合可以实现经济与环境的协调发展。甲醇-水蒸气重整制氢方法是目前比较成熟的制氢方法,且具有良好的应用前景。甲醇-水蒸气重整制氢的部分反应过程如图1所示:
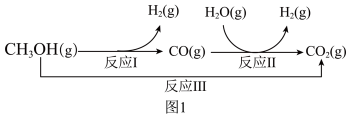
(1)已知一定条件下
反应I:CH3OH(g) ⇌CO(g)+2H2(g) ΔH1=+90.7kJ·mol-1
反应II:H2O(g)+CO(g) ⇌H2(g)+CO2(g) ΔH2=-41.2kJ·mol-1
反应III:CH3OH(g)+H2O(g) ⇌CO2(g)+3H2(g) ΔH3
该条件下反应III的ΔH3=_______ 。
(2)已知反应II在进气比[n(CO):n(H2O)]不同时,在不同温度(T1、T2)下,测得相应的CO的平衡转化率如图2所示。
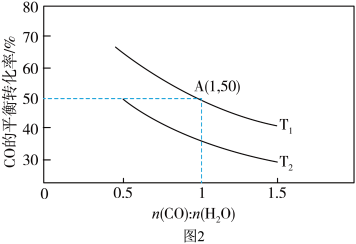
①比较T1、T2的大小,T1_______ T2(填“>”“<”或“=”)。原因为: _______
②T1温度时,按下表数据开始反应建立平衡:
应进行到t时刻时,判断v(正)、v(逆)的大小关系为断v(正)_______ v(逆(填“>“<”或“=”)。
(3)CO2在生产中有着广泛的用途。在弱酸性溶液中,电解活化CO2可以制备乙醇,原理如图所示。
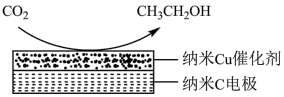
CO2参与反应的一极为_______ (填“阴极”或“阳极”),电极反应式是_______ 。

(1)已知一定条件下
反应I:CH3OH(g) ⇌CO(g)+2H2(g) ΔH1=+90.7kJ·mol-1
反应II:H2O(g)+CO(g) ⇌H2(g)+CO2(g) ΔH2=-41.2kJ·mol-1
反应III:CH3OH(g)+H2O(g) ⇌CO2(g)+3H2(g) ΔH3
该条件下反应III的ΔH3=
(2)已知反应II在进气比[n(CO):n(H2O)]不同时,在不同温度(T1、T2)下,测得相应的CO的平衡转化率如图2所示。

①比较T1、T2的大小,T1
②T1温度时,按下表数据开始反应建立平衡:
| CO | H2O | H2 | CO2 | |
| 起始浓度/(mol·L-1) | 2 | 1 | 0 | 0 |
| t时刻浓度/(mol·L-1) | 1.5 | 0.5 | 0.5 | 0.5 |
(3)CO2在生产中有着广泛的用途。在弱酸性溶液中,电解活化CO2可以制备乙醇,原理如图所示。
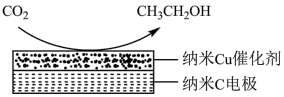
CO2参与反应的一极为
您最近一年使用:0次
解题方法
3 . 砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式_______ 。该反应需要在加压下进行,原因是_______ 。
(2)已知:As(s)+ H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+ O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
2As(s)+ O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =_______ 。
(3)298 K时,将20 mL 3x mol·L−1 Na3AsO3、20 mL 3x mol·L−1 I2和20 mL NaOH溶液混合,发生反应: (aq)+I2(aq)+2OH−(aq)
(aq)+I2(aq)+2OH−(aq)
 (aq)+2I−(aq)+ H2O(l)。溶液中c(
(aq)+2I−(aq)+ H2O(l)。溶液中c( )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
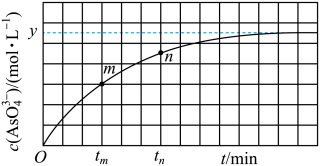
①下列可判断反应达到平衡的是_______ (填标号)。
a.溶液的pH不再变化 b.v(I−)=2v( )
)
c. c( )/c(
)/c( )不再变化 d. c(I−)=y mol·L−1
)不再变化 d. c(I−)=y mol·L−1
②tm时v逆_______ tn时v逆(填“大于”“小于”或“等于”),理由是_______ 。
③tm若平衡时溶液的pH=14,则该反应的平衡常数K为_______ 。
(1)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式
(2)已知:As(s)+
 H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1H2(g)+
 O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH22As(s)+
 O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =
(3)298 K时,将20 mL 3x mol·L−1 Na3AsO3、20 mL 3x mol·L−1 I2和20 mL NaOH溶液混合,发生反应:
 (aq)+I2(aq)+2OH−(aq)
(aq)+I2(aq)+2OH−(aq)
 (aq)+2I−(aq)+ H2O(l)。溶液中c(
(aq)+2I−(aq)+ H2O(l)。溶液中c( )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
①下列可判断反应达到平衡的是
a.溶液的pH不再变化 b.v(I−)=2v(
 )
)c. c(
 )/c(
)/c( )不再变化 d. c(I−)=y mol·L−1
)不再变化 d. c(I−)=y mol·L−1②tm时v逆
③tm若平衡时溶液的pH=14,则该反应的平衡常数K为
您最近一年使用:0次
4 . 一碳产品是石油的良好替代品,一碳化学与绿色化工结合可以实现经济与环境的协调发展。甲醇-水蒸气重整制氢方法是目前比较成熟的制氢方法,且具有良好的应用前景。甲醇-水蒸气重整制氢的部分反应过程如图1所示:

(1)已知一定条件下
反应I:CH3OH(g) CO(g)+2H2(g) ΔH1=+90.7kJ·mol-1
CO(g)+2H2(g) ΔH1=+90.7kJ·mol-1
反应II:H2O(g)+CO(g) H2(g)+CO2(g) ΔH2=-41.2kJ·mol-1
H2(g)+CO2(g) ΔH2=-41.2kJ·mol-1
反应III:CH3OH(g)+H2O(g) CO2(g)+3H2(g) ΔH3
CO2(g)+3H2(g) ΔH3
该条件下反应III的ΔH3=_______ 。
(2)已知反应II在进气比[n(CO):n(H2O)]不同时,在不同温度(T1、T2)下,测得相应的CO的平衡转化率如图2所示。

①比较T1、T2的大小,T1_______ T2(填“>”“<”或“=”)。
②A点对应的化学平衡常数是_______ 。
③T1温度时,按下表数据开始反应建立平衡:
反应进行到t时刻时,判断v(正)、v(逆)的大小关系为断v(正)_______ v(逆(填“>“<”或“=”)。
④当不同的进气比达到相同的CO平衡转化率时,对应的反应温度和进气比的关系是_______ 。
(3)CO2在生产中有着广泛的用途。经CO2饱和处理的KHCO3,弱酸性溶液中,电解活化CO2可以制备乙醇,原理如图所示。

CO2参与反应的一极为_______ (填“阴极”或“阳极”),电极反应式是_______ 。

(1)已知一定条件下
反应I:CH3OH(g)
 CO(g)+2H2(g) ΔH1=+90.7kJ·mol-1
CO(g)+2H2(g) ΔH1=+90.7kJ·mol-1反应II:H2O(g)+CO(g)
 H2(g)+CO2(g) ΔH2=-41.2kJ·mol-1
H2(g)+CO2(g) ΔH2=-41.2kJ·mol-1反应III:CH3OH(g)+H2O(g)
 CO2(g)+3H2(g) ΔH3
CO2(g)+3H2(g) ΔH3该条件下反应III的ΔH3=
(2)已知反应II在进气比[n(CO):n(H2O)]不同时,在不同温度(T1、T2)下,测得相应的CO的平衡转化率如图2所示。

①比较T1、T2的大小,T1
②A点对应的化学平衡常数是
③T1温度时,按下表数据开始反应建立平衡:
| CO | H2O | H2 | CO2 | |
| 起始浓度/(mol·L-1) | 2 | 1 | 0 | 0 |
| t时刻浓度/(mol·L-1) | 1.5 | 0.5 | 0.5 | 0.5 |
④当不同的进气比达到相同的CO平衡转化率时,对应的反应温度和进气比的关系是
(3)CO2在生产中有着广泛的用途。经CO2饱和处理的KHCO3,弱酸性溶液中,电解活化CO2可以制备乙醇,原理如图所示。

CO2参与反应的一极为
您最近一年使用:0次
5 . CaS在环境保护、制备电致发光材料等方面用途非常广泛。回答下列问题:
(1)制取CaS的反应如下:
反应(I):CaSO4(s)+2C(s) CaS(s)+2CO2(g) △H1
CaS(s)+2CO2(g) △H1
反应(II):CaCO3(s)+H2S(g) CaS(s)+H2O(g)+CO2(g) △H2=+165kJ·mol-1
CaS(s)+H2O(g)+CO2(g) △H2=+165kJ·mol-1
①若在恒温恒容密闭容器中只发生反应(I),达到平衡时向容器中通入少量CO2,则反应再次达到平衡时c(CO2)将___ (填“增大”“减小”或“不变”)。
②已知下列热化学方程式:.
i:S2(g)+CaSO4(s) CaS(g)+2SO2(g) △H=+240.4kJ·mol-1
CaS(g)+2SO2(g) △H=+240.4kJ·mol-1
ii:2SO2(g)+4CO(g)=S2(g)+4CO2(g) △H=+16.0kJ·mol-1
iii:C(s)+CO2(g)=2CO(g) △H=+172.5kJ·mol-1
则反应(I)的△H1=___ kJ·mol-1。
③反应(II)的△S___ (填“>”“<”或“=”)0。若反应(II)在恒温恒容密闭容器中进行,能说明该反应已达到平衡状态的是___ (填字母)。
A.v(H2O)正=v(CO2)正
B.容器中气体总压强不再随时间变化
C.容器中同时存在H2S(g)、CO2(g)和H2O(g)
D.单位时间内断裂H-S键与断裂C=O键数目相等
(2)CaS能被许多物质氧化,有关反应的lgKp与温度关系如图(Kp为以分压表示的平衡常数;分压=总压×物质的量分数;图中数据由压强单位为kPa得出)。
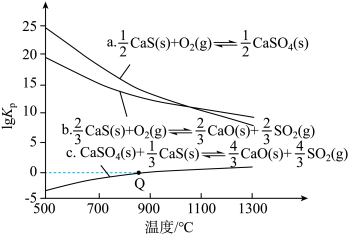
①属于吸热反应的是___ (填“a”“b”或“c”)。
②相同温度下,反应a、b、c的lgKp(a)、lgKp(b)、lgKp(c)之间满足的关系是lgKp(c)=___ 。
③反应c在Q点时:p(SO2)=___ kPa,以浓度表示的平衡常数Kc=___ Kp[用R、T表示;已知气体的压强、体积、温度满足pV=nRT(n为气体的物质的量,R为恒量)]。
(1)制取CaS的反应如下:
反应(I):CaSO4(s)+2C(s)
 CaS(s)+2CO2(g) △H1
CaS(s)+2CO2(g) △H1反应(II):CaCO3(s)+H2S(g)
 CaS(s)+H2O(g)+CO2(g) △H2=+165kJ·mol-1
CaS(s)+H2O(g)+CO2(g) △H2=+165kJ·mol-1①若在恒温恒容密闭容器中只发生反应(I),达到平衡时向容器中通入少量CO2,则反应再次达到平衡时c(CO2)将
②已知下列热化学方程式:.
i:S2(g)+CaSO4(s)
 CaS(g)+2SO2(g) △H=+240.4kJ·mol-1
CaS(g)+2SO2(g) △H=+240.4kJ·mol-1ii:2SO2(g)+4CO(g)=S2(g)+4CO2(g) △H=+16.0kJ·mol-1
iii:C(s)+CO2(g)=2CO(g) △H=+172.5kJ·mol-1
则反应(I)的△H1=
③反应(II)的△S
A.v(H2O)正=v(CO2)正
B.容器中气体总压强不再随时间变化
C.容器中同时存在H2S(g)、CO2(g)和H2O(g)
D.单位时间内断裂H-S键与断裂C=O键数目相等
(2)CaS能被许多物质氧化,有关反应的lgKp与温度关系如图(Kp为以分压表示的平衡常数;分压=总压×物质的量分数;图中数据由压强单位为kPa得出)。

①属于吸热反应的是
②相同温度下,反应a、b、c的lgKp(a)、lgKp(b)、lgKp(c)之间满足的关系是lgKp(c)=
③反应c在Q点时:p(SO2)=
您最近一年使用:0次
6 . 运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.氨为重要的化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a. CH4(g)+H2O(g)⇌CO(g)+3H2(g) ∆H1=+216.4kJ/mol
b. CO(g)+H2O(g)⇌CO2(g)+H2(g) ∆H2=-41.2kJ/mol
则反应CH4(g)+2H2O(g)⇌CO2(g)+4H2(g) ∆H=___ 。
(2)起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。
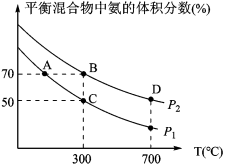
①恒压时,反应一定达到平衡状态的标志是___ (填序号)
A. N2和H2的转化率相等 B. 反应体系密度保持不变
C. 保持不变 D.
保持不变 D.  =2
=2
②P1___ P2 (填“>”“=”或“<”,下同);反应的平衡常数:B点___ D点。
③C点H2的转化率为__ ;
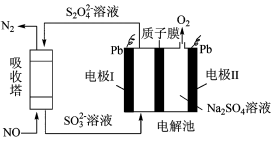
Ⅱ.用间接电化学法去除烟气中NO的原理如图所示。
(3)已知阴极室溶液呈酸性,则阴极的电极反应式为____ 。反应过程中通过质子膜的H+为2mol时,吸收塔中生成的气体在标准状况下的体积为____ L。
I.氨为重要的化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a. CH4(g)+H2O(g)⇌CO(g)+3H2(g) ∆H1=+216.4kJ/mol
b. CO(g)+H2O(g)⇌CO2(g)+H2(g) ∆H2=-41.2kJ/mol
则反应CH4(g)+2H2O(g)⇌CO2(g)+4H2(g) ∆H=
(2)起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。

①恒压时,反应一定达到平衡状态的标志是
A. N2和H2的转化率相等 B. 反应体系密度保持不变
C.
 保持不变 D.
保持不变 D.  =2
=2②P1
③C点H2的转化率为
Ⅱ.用间接电化学法去除烟气中NO的原理如图所示。
(3)已知阴极室溶液呈酸性,则阴极的电极反应式为

您最近一年使用:0次
2019-10-01更新
|
265次组卷
|
2卷引用:广西自治区桂林市第十八中学2020届高三上学期第二次月考理综化学试题



