名校
解题方法
1 . 氯乙烯是用途广泛的石油化工产品,工业上常利用乙烯氧氯化法生产:

已知:ⅰ.
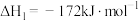
ⅱ.
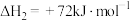
ⅲ.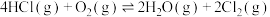
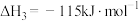
回答下列问题:
(1)
___________  。
。
(2)已知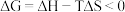 ,反应可自发进行。若
,反应可自发进行。若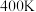 时反应ⅱ中
时反应ⅱ中 ,此时反应ⅱ
,此时反应ⅱ___________ (“能”或“不能”)自发进行。
(3)为提高反应ⅱ中氯乙烯的平衡产率,可采取的措施有___________ 。
a.加入合适的催化剂 b.升高温度 c.增大压强 d.及时氧化
(4)向 密闭容器中初始投入
密闭容器中初始投入 、
、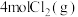 和
和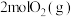 发生乙烯氧氯化反应,不同温度下测得反应在平衡时
发生乙烯氧氯化反应,不同温度下测得反应在平衡时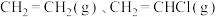 、
、 三种组分的体积分数随温度的变化如图1所示。
三种组分的体积分数随温度的变化如图1所示。___________ 和___________ 的体积分数随温度的变化。
②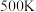 时反应进行到
时反应进行到 达到平衡,
达到平衡, 内用
内用 的浓度变化表示的
的浓度变化表示的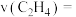
___________ ,该反应的平衡常数
___________ 。
(5)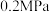 时,控制进料浓度
时,控制进料浓度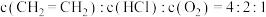 。容器中发生反应
。容器中发生反应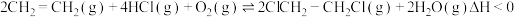 ,不同温度对
,不同温度对 的平衡转化率和催化剂的催化效率的影响如图2所示。(备注:催化效率是指催化剂转化反应物为生成物的能力,通常通过产物的选择性和反应速率来衡量。图2中通过
的平衡转化率和催化剂的催化效率的影响如图2所示。(备注:催化效率是指催化剂转化反应物为生成物的能力,通常通过产物的选择性和反应速率来衡量。图2中通过 转化为
转化为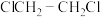 的转化率大小来体现)
的转化率大小来体现)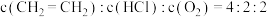 ,所得
,所得 的平衡转化率曲线应在点M的
的平衡转化率曲线应在点M的___________ (填“上”或“下”)方。
②因受现有工业设备限制,需保持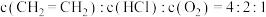 不变,在235℃、
不变,在235℃、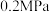 下,若要进一步增大
下,若要进一步增大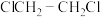 的选择性,可选择从
的选择性,可选择从___________ 方向进一步展开研究。

已知:ⅰ.

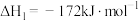
ⅱ.

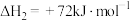
ⅲ.
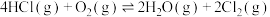
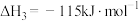
回答下列问题:
(1)

 。
。(2)已知
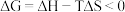 ,反应可自发进行。若
,反应可自发进行。若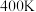 时反应ⅱ中
时反应ⅱ中 ,此时反应ⅱ
,此时反应ⅱ(3)为提高反应ⅱ中氯乙烯的平衡产率,可采取的措施有
a.加入合适的催化剂 b.升高温度 c.增大压强 d.及时氧化

(4)向
 密闭容器中初始投入
密闭容器中初始投入 、
、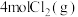 和
和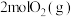 发生乙烯氧氯化反应,不同温度下测得反应在平衡时
发生乙烯氧氯化反应,不同温度下测得反应在平衡时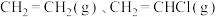 、
、 三种组分的体积分数随温度的变化如图1所示。
三种组分的体积分数随温度的变化如图1所示。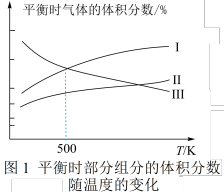
②
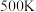 时反应进行到
时反应进行到 达到平衡,
达到平衡, 内用
内用 的浓度变化表示的
的浓度变化表示的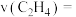

(5)
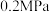 时,控制进料浓度
时,控制进料浓度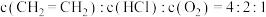 。容器中发生反应
。容器中发生反应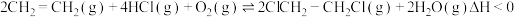 ,不同温度对
,不同温度对 的平衡转化率和催化剂的催化效率的影响如图2所示。(备注:催化效率是指催化剂转化反应物为生成物的能力,通常通过产物的选择性和反应速率来衡量。图2中通过
的平衡转化率和催化剂的催化效率的影响如图2所示。(备注:催化效率是指催化剂转化反应物为生成物的能力,通常通过产物的选择性和反应速率来衡量。图2中通过 转化为
转化为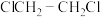 的转化率大小来体现)
的转化率大小来体现)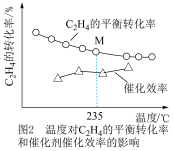
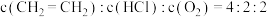 ,所得
,所得 的平衡转化率曲线应在点M的
的平衡转化率曲线应在点M的②因受现有工业设备限制,需保持
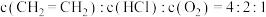 不变,在235℃、
不变,在235℃、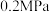 下,若要进一步增大
下,若要进一步增大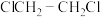 的选择性,可选择从
的选择性,可选择从
您最近一年使用:0次
2 . 工业上先将金红石 (TiO2)转化为 ,然后可制得在医疗等领域具有重要用途的钛(Ti)。按要求回答下列问题。
,然后可制得在医疗等领域具有重要用途的钛(Ti)。按要求回答下列问题。
(1)钛的价层电子排布式为___________ ;预测钛元素的最高化合价为___________ 。
(2)已知在一定条件下如下反应的热化学方程式及平衡常数:
ⅰ. ;
;
ⅱ. ;
;
ⅲ.碳氯化法: ;
;
①
___________ ;
___________ (用含 的代数式表示)。
的代数式表示)。
②反应ⅲ自发进行的条件为___________ (填“低温”“高温”或“任意温度”)。
③在反应ⅰ中加入石墨制备 ,用平衡移动原理分析其目的:
,用平衡移动原理分析其目的:___________ 。
(3)在 的密闭容器中,投入一定量的
的密闭容器中,投入一定量的 、C、
、C、 ,进行反应ⅲ的模拟实验。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
,进行反应ⅲ的模拟实验。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。

①设 时平衡体系气体总物质的量为n,反应
时平衡体系气体总物质的量为n,反应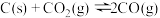 的平衡常数的值
的平衡常数的值
___________ (用含n、V的代数式表示)。
②在200℃平衡时 几乎完全转化为
几乎完全转化为 。但实际生产
。但实际生产 采用1000℃左右的反应温度,其理由是
采用1000℃左右的反应温度,其理由是___________ 。
(4)写出有利于加快反应ⅲ速率的一条措施:___________ 。
 ,然后可制得在医疗等领域具有重要用途的钛(Ti)。按要求回答下列问题。
,然后可制得在医疗等领域具有重要用途的钛(Ti)。按要求回答下列问题。(1)钛的价层电子排布式为
(2)已知在一定条件下如下反应的热化学方程式及平衡常数:
ⅰ.
 ;
;
ⅱ.
 ;
;
ⅲ.碳氯化法:
 ;
;
①


 的代数式表示)。
的代数式表示)。②反应ⅲ自发进行的条件为
③在反应ⅰ中加入石墨制备
 ,用平衡移动原理分析其目的:
,用平衡移动原理分析其目的:(3)在
 的密闭容器中,投入一定量的
的密闭容器中,投入一定量的 、C、
、C、 ,进行反应ⅲ的模拟实验。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
,进行反应ⅲ的模拟实验。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
①设
 时平衡体系气体总物质的量为n,反应
时平衡体系气体总物质的量为n,反应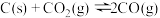 的平衡常数的值
的平衡常数的值
②在200℃平衡时
 几乎完全转化为
几乎完全转化为 。但实际生产
。但实际生产 采用1000℃左右的反应温度,其理由是
采用1000℃左右的反应温度,其理由是(4)写出有利于加快反应ⅲ速率的一条措施:
您最近一年使用:0次
解题方法
3 . 碳一物质(CO、CO2、CH4、CH3OH等)在合成工业中有重要用途。回答下列问题:
(1)已知相关化学键的键能数据如下表:
某反应的化学平衡常数表达式为K=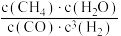 ,写出该反应的热化学方程式:
,写出该反应的热化学方程式:_______ ;该反应在_______ (填“高温”或“低温”)下更易自发进行。
(2)一定温度下,在2L容积不变的密闭容器中,充入1molCO2(g)和3molH2(g)发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49kJ·mol-1,反应5min时达到平衡,测得该过程中放出热量为19.6kJ。
CH3OH(g)+H2O(g) ΔH=-49kJ·mol-1,反应5min时达到平衡,测得该过程中放出热量为19.6kJ。
①容器中混合气体平衡时的总压强与起始的总压强之比为_______ ;0~5min内,用CO2来表示反应的平均反应速率是_______ 。
②此温度下该反应的平衡常数K=_______ (保留两位有效数字)。
(3)科研人员通过反复实验发现:用惰性电极进行电解时,CO2可以在酸性水溶液中生成乙醇,则生成乙醇的反应发生在_______ (填“阴”或“阳”)极,写出该电极的反应式:_______ 。
(1)已知相关化学键的键能数据如下表:
| 化学键 | C≡O | H-H | H-C | H-O |
| E/(kJ·mol-1) | 1072 | 436 | 414 | 465 |
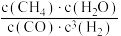 ,写出该反应的热化学方程式:
,写出该反应的热化学方程式:(2)一定温度下,在2L容积不变的密闭容器中,充入1molCO2(g)和3molH2(g)发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH=-49kJ·mol-1,反应5min时达到平衡,测得该过程中放出热量为19.6kJ。
CH3OH(g)+H2O(g) ΔH=-49kJ·mol-1,反应5min时达到平衡,测得该过程中放出热量为19.6kJ。①容器中混合气体平衡时的总压强与起始的总压强之比为
②此温度下该反应的平衡常数K=
(3)科研人员通过反复实验发现:用惰性电极进行电解时,CO2可以在酸性水溶液中生成乙醇,则生成乙醇的反应发生在
您最近一年使用:0次
解题方法
4 . 甲醇( )是一种可再生能源,在日用化工、制药、农药等方面均有广泛用途。催化合成甲醇的反应为
)是一种可再生能源,在日用化工、制药、农药等方面均有广泛用途。催化合成甲醇的反应为 。回答下列问题:
。回答下列问题:
(1)已知反应①: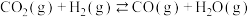
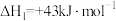
反应②:
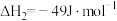
则

_______  。
。
(2)某温度下,向2L恒容密闭容器中充入1 mol CO和2 mol ,加入催化剂反应合成
,加入催化剂反应合成 ,测得
,测得 的物质的员随时间(t)的变化如下表:
的物质的员随时间(t)的变化如下表:
①0〜20min内,用 表示该反应的平均速率为
表示该反应的平均速率为_______ ;
②CO的平衡转化率为_______ ;
③该温度下的平衡常数K=_______ 。
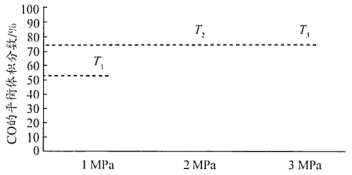
(3)在不同温度和压强下发生反应: ,测得平衡时CO的体积分数(%)与温度(T)和压强的关系如图所示,判断T1、T2、T3由大到小的顺序为
,测得平衡时CO的体积分数(%)与温度(T)和压强的关系如图所示,判断T1、T2、T3由大到小的顺序为____ ,理由是____ 。
 )是一种可再生能源,在日用化工、制药、农药等方面均有广泛用途。催化合成甲醇的反应为
)是一种可再生能源,在日用化工、制药、农药等方面均有广泛用途。催化合成甲醇的反应为 。回答下列问题:
。回答下列问题:(1)已知反应①:
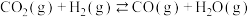
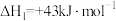
反应②:

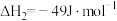
则


 。
。(2)某温度下,向2L恒容密闭容器中充入1 mol CO和2 mol
 ,加入催化剂反应合成
,加入催化剂反应合成 ,测得
,测得 的物质的员随时间(t)的变化如下表:
的物质的员随时间(t)的变化如下表:| t/min | 0 | 5 | 10 | 15 | 20 | 25 |
 /mol /mol | 1.00 | 0.79 | 0.63 | 0.54 | 0.50 | 0.50 |
①0〜20min内,用
 表示该反应的平均速率为
表示该反应的平均速率为②CO的平衡转化率为
③该温度下的平衡常数K=
(3)在不同温度和压强下发生反应:
 ,测得平衡时CO的体积分数(%)与温度(T)和压强的关系如图所示,判断T1、T2、T3由大到小的顺序为
,测得平衡时CO的体积分数(%)与温度(T)和压强的关系如图所示,判断T1、T2、T3由大到小的顺序为
您最近一年使用:0次
5 . 氧化铝在工业生产中有多种用途。请根据信息回答:
(1)以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN)
已知:2Al2O3(s)=4Al(g)+3O2(g)△H1=+3351 kJ·mol-1
2C(s)+O2(g)=2CO(g);△H2=-221 kJ·mol-1
2Al(g)+N2(g)=2AlN(s)△H3=-318 kJ·mol-1
则碳热还原法合成AlN的热化学方程式为_____ 。
(2)电解氧化铝生产铝时,阳极产生的副产物CO2,可通过CO2甲烷化再利用,反应原理为:CO2(g)+4H2(g) CH4(g)+2H2O(g)△H4。
CH4(g)+2H2O(g)△H4。
常压下以Ru/TiO2作催化剂,在恒容且容积相同的不同容器中,分别充入10mol CO2和H2的混合气体(体积比1:4)于不同温度下进行反应,第tmin时分别测定CH4的体积分数 ,并绘成如图甲所示曲线。
,并绘成如图甲所示曲线。

①A、B、C、D、E五点中,尚未达到平衡的点是___ ,该反应的△H4__ 0(填“>”或“<”)。
②350℃时,在2L恒容密闭容器中测得CO2的平衡转化率如图乙所示,则前10 min的平均反应速率v(CO2)=___ ;平衡常数为____

(3)据文献报道,科学家利用氮化镓材料与铜组成如图所示的人工光合系统装置,成功地以CO2和H2O为原料合成了CH4。
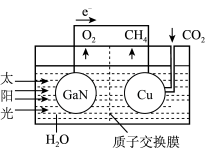
①写山铜电极表面的电极反应式____ 。
②为提高该人工光合系统的工作效率,可向装置中加入少量__ (选填“盐酸”或“硫酸”)。
(1)以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN)
已知:2Al2O3(s)=4Al(g)+3O2(g)△H1=+3351 kJ·mol-1
2C(s)+O2(g)=2CO(g);△H2=-221 kJ·mol-1
2Al(g)+N2(g)=2AlN(s)△H3=-318 kJ·mol-1
则碳热还原法合成AlN的热化学方程式为
(2)电解氧化铝生产铝时,阳极产生的副产物CO2,可通过CO2甲烷化再利用,反应原理为:CO2(g)+4H2(g)
 CH4(g)+2H2O(g)△H4。
CH4(g)+2H2O(g)△H4。常压下以Ru/TiO2作催化剂,在恒容且容积相同的不同容器中,分别充入10mol CO2和H2的混合气体(体积比1:4)于不同温度下进行反应,第tmin时分别测定CH4的体积分数
 ,并绘成如图甲所示曲线。
,并绘成如图甲所示曲线。
①A、B、C、D、E五点中,尚未达到平衡的点是
②350℃时,在2L恒容密闭容器中测得CO2的平衡转化率如图乙所示,则前10 min的平均反应速率v(CO2)=

(3)据文献报道,科学家利用氮化镓材料与铜组成如图所示的人工光合系统装置,成功地以CO2和H2O为原料合成了CH4。

①写山铜电极表面的电极反应式
②为提高该人工光合系统的工作效率,可向装置中加入少量
您最近一年使用:0次



