1 . 天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
(1)①已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ∆H1;
CO(g)+H2O(g)=CO2(g)+H2(g) ∆H2;
2CO(g)+O2(g)=2CO2(g) ∆H3;
则CO2(g)+CH4(g)=2CO(g)+2H2(g)的∆H=___________ 。
②天然气中的少量H2S杂质常用氨水吸收,产物为NH4HS。向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式___________ 。
(2)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g) 2CO(g)+2H2(g)。该反应的平衡常数表达式为
2CO(g)+2H2(g)。该反应的平衡常数表达式为___________ ;在密闭容器中通入物质的量浓度均为0.1 mol/L的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如图20-1所示。则压强P1___________ P2(填“大于”或“小于");压强为P2时,在Y点:v(正)___________ v(逆)(填“大于”“小于”或“等于”)。
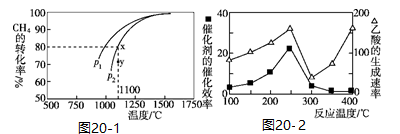
(3)CH4和CO2合成乙酸,某工业生产中以CuAlO2为合成的催化剂,在不同温度下催化剂的催化效率与乙酸的生成速率如图20-2所示。250℃~300℃时,温度升高而乙酸的生成速率降低的原因是___________ ,将CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,其离子方程式为___________ 。
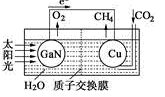
(4)科学家用氮化镓材料与铜组装如下图所示人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.写出铜电极表面的电极反应式___________ 。
(1)①已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ∆H1;
CO(g)+H2O(g)=CO2(g)+H2(g) ∆H2;
2CO(g)+O2(g)=2CO2(g) ∆H3;
则CO2(g)+CH4(g)=2CO(g)+2H2(g)的∆H=
②天然气中的少量H2S杂质常用氨水吸收,产物为NH4HS。向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式
(2)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g)
 2CO(g)+2H2(g)。该反应的平衡常数表达式为
2CO(g)+2H2(g)。该反应的平衡常数表达式为
(3)CH4和CO2合成乙酸,某工业生产中以CuAlO2为合成的催化剂,在不同温度下催化剂的催化效率与乙酸的生成速率如图20-2所示。250℃~300℃时,温度升高而乙酸的生成速率降低的原因是
(4)科学家用氮化镓材料与铜组装如下图所示人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.写出铜电极表面的电极反应式

您最近一年使用:0次
解题方法
2 . 金属镁是一种活泼的常见金属,用途广泛。在25℃,101kPa条件下。有关物质的能量如下表所示(X2表示任意卤素单质):
回答下列问题:
(1)镁与卤素单质的反应属于_______ (“放热”或“吸热”)反应。
(2)镁与卤素单质反应的生成物中,热稳定性最差的是_________ 。
(3)镁与液溴反应的热化学方程式为________ 。
(4)反应F2(g)+MgCl2(s)=MgF2(s)+Cl2(g)的△H=_______ kJ·mol-1。
物质 | Mg | X2 | MgF2 | MgCl2 | MgBr2 | MgI2 |
能量/kJ‧mol-1 | 0 | 0 | -1124 | -641.3 | -524 | -364 |
回答下列问题:
(1)镁与卤素单质的反应属于
(2)镁与卤素单质反应的生成物中,热稳定性最差的是
(3)镁与液溴反应的热化学方程式为
(4)反应F2(g)+MgCl2(s)=MgF2(s)+Cl2(g)的△H=
您最近一年使用:0次
2020-07-31更新
|
65次组卷
|
2卷引用:江苏省南通市海安县2020-2021学年高二上学期第一次月考化学试题
解题方法
3 . 金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在Z-X-X-K]密闭容器中用H2还原WO3可得到金属钨,其总反应为:WO3 (s) + 3H2 (g)  W (s) + 3H2O (g)
W (s) + 3H2O (g)
请回答下列问题:
(1)上述反应的化学平衡常数表达式为___________________________ 。
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为____________ 。
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:

第一阶段反应的化学方程式为___________________________ ;假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为____________________________________ 。
(4)已知:温度过高时,WO2 (s)转变为WO2 (g);
WO2 (s) + 2H2 (g) W (s) + 2H2O (g);ΔH = +66.0 kJ·mol-1
W (s) + 2H2O (g);ΔH = +66.0 kJ·mol-1
WO2 (g) + 2H2 W (s) + 2H2O (g);ΔH = -137.9 kJ·mol-1
W (s) + 2H2O (g);ΔH = -137.9 kJ·mol-1
则WO2 (s) WO2 (g) 的ΔH =
WO2 (g) 的ΔH = ______________________ 。
 W (s) + 3H2O (g)
W (s) + 3H2O (g) 请回答下列问题:
(1)上述反应的化学平衡常数表达式为
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:

第一阶段反应的化学方程式为
(4)已知:温度过高时,WO2 (s)转变为WO2 (g);
WO2 (s) + 2H2 (g)
 W (s) + 2H2O (g);ΔH = +66.0 kJ·mol-1
W (s) + 2H2O (g);ΔH = +66.0 kJ·mol-1 WO2 (g) + 2H2
 W (s) + 2H2O (g);ΔH = -137.9 kJ·mol-1
W (s) + 2H2O (g);ΔH = -137.9 kJ·mol-1 则WO2 (s)
 WO2 (g) 的ΔH =
WO2 (g) 的ΔH =
您最近一年使用:0次



