解题方法
1 . 硫酸厂尾气中含有大量SO2,回收并综合利用SO2对环境保护有重要意义。
(1)利用氨水吸收烟气中的SO2可转化为(NH4)2SO4。相关反应的主要热化学方程式如下:
SO2(g)+NH3•H2O(aq)=NH4HSO3(aq) ΔH1=akJ•mol-1
NH3•H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(aq)+H2O(l) ΔH2=bkJ•mol-1
2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) ΔH3=ckJ•mol-1
①反应2SO2(g)+4NH3•H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)的ΔH=________ kJ•mol-1
②空气氧化NH4HSO3的速率随温度的变化如图1所示,当温度超过60℃时,(NH4)2SO3氧化速率下降的原因可能是________ 。研究发现,在500℃下硫酸铵分解过程中得到4种产物,其含氮物质随时间变化关系如图2所示。写出该条件下硫酸铵分解的化学方程式:____________ 。

(2)工业上利用SO2尾气可制备亚硫酰氯(SOCl2)。SOCl2是一种发烟液体,易水解,可用于农药、医药、染料、电池等生产,其制备原理为:S(s)+2Cl2(g)+SO2(g)⇌2SOCl2(g)。
①该反应的平衡常数表达式为____ 。
②用SOCl2与A1Cl3•6H2O混合共热,可得到无水A1Cl3,原因是________ 。
(3)用电解法处理含有SO2尾气的装置如图所示(电极材料均为惰性电极)。该装置中的离子交换膜为___ 离子交换膜(填“阴”或“阳”);阴极的电极反应式为__ 。

(1)利用氨水吸收烟气中的SO2可转化为(NH4)2SO4。相关反应的主要热化学方程式如下:
SO2(g)+NH3•H2O(aq)=NH4HSO3(aq) ΔH1=akJ•mol-1
NH3•H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(aq)+H2O(l) ΔH2=bkJ•mol-1
2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) ΔH3=ckJ•mol-1
①反应2SO2(g)+4NH3•H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)的ΔH=
②空气氧化NH4HSO3的速率随温度的变化如图1所示,当温度超过60℃时,(NH4)2SO3氧化速率下降的原因可能是

(2)工业上利用SO2尾气可制备亚硫酰氯(SOCl2)。SOCl2是一种发烟液体,易水解,可用于农药、医药、染料、电池等生产,其制备原理为:S(s)+2Cl2(g)+SO2(g)⇌2SOCl2(g)。
①该反应的平衡常数表达式为
②用SOCl2与A1Cl3•6H2O混合共热,可得到无水A1Cl3,原因是
(3)用电解法处理含有SO2尾气的装置如图所示(电极材料均为惰性电极)。该装置中的离子交换膜为

您最近一年使用:0次
名校
解题方法
2 . 用甲醇(CH3OH)制备一些高附加值产品,是目前研究的热点。
(1)甲醇和水蒸气经催化重整可制得氢气,反应主要过程如下:
反应Ⅰ. CH3OH(g)+H2O(g) 3H2(g)+CO2(g) △H1
3H2(g)+CO2(g) △H1
反应Ⅱ. H2(g)+CO2(g) H2O(g)+CO(g) △H2= a kJ·mol-1
H2O(g)+CO(g) △H2= a kJ·mol-1
反应Ⅲ. CH3OH(g) 2H2(g)+CO(g) △H3= b kJ·mol-1
2H2(g)+CO(g) △H3= b kJ·mol-1
反应Ⅳ. 2CH3OH(g) 2H2O(g)+C2H4(g) △H4= c kJ·mol-1
2H2O(g)+C2H4(g) △H4= c kJ·mol-1
①△H1=______ kJ·mol-1 。
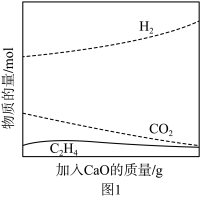
②工业上采用CaO吸附增强制氢的方法,可以有效提高反应Ⅰ氢气的产率,如图1,请分析加入CaO提高氢气产率的原因:______ 。
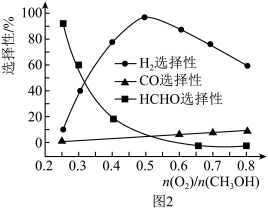
③在一定条件下用氧气催化氧化甲醇制氢气,原料气中 对反应的选择性影响如题图2所示(选择性越大表示生成的该物质越多)。制备H2时最好控制
对反应的选择性影响如题图2所示(选择性越大表示生成的该物质越多)。制备H2时最好控制 =
=______ ,当 = 0.25时,CH3OH和O2发生的主要反应方程式为
= 0.25时,CH3OH和O2发生的主要反应方程式为______ 。
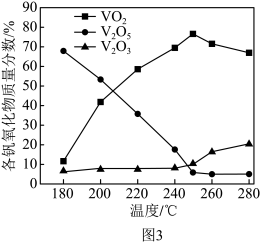
(2)以V2O5为原料,采用微波辅热-甲醇还原法可制备VO2,在微波功率1000kW下,取相同质量的反应物放入反应釜中,改变反应温度,保持反应时间为90min,反应温度对各钒氧化物质量分数的影响曲线如图3所示,温度高于250℃时,VO2的质量分数下降的原因是______ 。
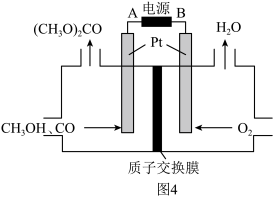
(3)以甲醇为原料,可以通过电化学方法合成碳酸二甲酯[(CH3O)2CO],工作原理如图4所示。
①电源的负极为______ (填“A”或“B”)。
②阳极的电极反应式为______ 。
(1)甲醇和水蒸气经催化重整可制得氢气,反应主要过程如下:
反应Ⅰ. CH3OH(g)+H2O(g)
 3H2(g)+CO2(g) △H1
3H2(g)+CO2(g) △H1反应Ⅱ. H2(g)+CO2(g)
 H2O(g)+CO(g) △H2= a kJ·mol-1
H2O(g)+CO(g) △H2= a kJ·mol-1反应Ⅲ. CH3OH(g)
 2H2(g)+CO(g) △H3= b kJ·mol-1
2H2(g)+CO(g) △H3= b kJ·mol-1 反应Ⅳ. 2CH3OH(g)
 2H2O(g)+C2H4(g) △H4= c kJ·mol-1
2H2O(g)+C2H4(g) △H4= c kJ·mol-1①△H1=
②工业上采用CaO吸附增强制氢的方法,可以有效提高反应Ⅰ氢气的产率,如图1,请分析加入CaO提高氢气产率的原因:

③在一定条件下用氧气催化氧化甲醇制氢气,原料气中
 对反应的选择性影响如题图2所示(选择性越大表示生成的该物质越多)。制备H2时最好控制
对反应的选择性影响如题图2所示(选择性越大表示生成的该物质越多)。制备H2时最好控制 =
= = 0.25时,CH3OH和O2发生的主要反应方程式为
= 0.25时,CH3OH和O2发生的主要反应方程式为
(2)以V2O5为原料,采用微波辅热-甲醇还原法可制备VO2,在微波功率1000kW下,取相同质量的反应物放入反应釜中,改变反应温度,保持反应时间为90min,反应温度对各钒氧化物质量分数的影响曲线如图3所示,温度高于250℃时,VO2的质量分数下降的原因是

(3)以甲醇为原料,可以通过电化学方法合成碳酸二甲酯[(CH3O)2CO],工作原理如图4所示。
①电源的负极为
②阳极的电极反应式为

您最近一年使用:0次
2020-01-19更新
|
315次组卷
|
3卷引用:江苏省无锡市普通高中2019-2020学年高三上学期期终调研试化学试题
名校
3 . H2、CO、CH4、CH3OH等都是重要的能源,也是重要为化工原料。
(1)已知25℃,1.01×105Pa时,8.0g CH4完全燃烧生成二氧化碳气体和液态水放出444.8kJ热量。写出该反应的热化学反应方程式:___________________________________________ 。
(2)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量及有效地开发利用CO2,工业上可以用CO2来生产燃料甲醇。在体积为2L的密闭容器中,充入lmol CO2和3mol H2,一定条件下发生反应:CO2(g) + 3H2(g) CH3OH(g) + H2O(g)。经测得CO2和CH3OH(g)的物质的量随时间变化如图所示。
CH3OH(g) + H2O(g)。经测得CO2和CH3OH(g)的物质的量随时间变化如图所示。

①从反应开始到平衡,CO2的平均反应速率v(CO2)=___________________ 。
②达到平衡时,H2的转化率为__________ 。
③该反应的平衡常数K=___________________ (表达式)。
④下列措施不能提高反应速率的是__________ 。
A.升高温度 B.加入催化剂 C.增大压强 D.及时分离出CH3OH
(3)工业上也用CO和H2为原料制备CH3OH,反应方程式为:CO(g) + 2H2(g) CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是______ 。
A.反应中CO与CH3OH的物质的量之比为1:1
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗1 mol CO,同时生成1 mol CH3OH
D.CH3OH的质量分数在混合气体中保持不变
E.混合气体的密度保持不变
(1)已知25℃,1.01×105Pa时,8.0g CH4完全燃烧生成二氧化碳气体和液态水放出444.8kJ热量。写出该反应的热化学反应方程式:
(2)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量及有效地开发利用CO2,工业上可以用CO2来生产燃料甲醇。在体积为2L的密闭容器中,充入lmol CO2和3mol H2,一定条件下发生反应:CO2(g) + 3H2(g)
 CH3OH(g) + H2O(g)。经测得CO2和CH3OH(g)的物质的量随时间变化如图所示。
CH3OH(g) + H2O(g)。经测得CO2和CH3OH(g)的物质的量随时间变化如图所示。
①从反应开始到平衡,CO2的平均反应速率v(CO2)=
②达到平衡时,H2的转化率为
③该反应的平衡常数K=
④下列措施不能提高反应速率的是
A.升高温度 B.加入催化剂 C.增大压强 D.及时分离出CH3OH
(3)工业上也用CO和H2为原料制备CH3OH,反应方程式为:CO(g) + 2H2(g)
 CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是A.反应中CO与CH3OH的物质的量之比为1:1
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗1 mol CO,同时生成1 mol CH3OH
D.CH3OH的质量分数在混合气体中保持不变
E.混合气体的密度保持不变
您最近一年使用:0次
2018-07-24更新
|
328次组卷
|
4卷引用:【全国市级联考】江苏省无锡市普通高中2017-2018学年高一下学期期末考试化学试题
【全国市级联考】江苏省无锡市普通高中2017-2018学年高一下学期期末考试化学试题【全国百强校】内蒙古集宁一中(西校区)2017-2018学年高一下学期期末考试化学试题(已下线)【新东方】高中化学140(已下线)2022年浙江1月高考真题变式题(26-31)
12-13高三上·江苏无锡·期末
解题方法
4 . 臭氧可用于净化空气,饮用水消毒,处理工业废物和作为漂白剂。
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如6Ag(s)+O3(g)=3Ag2O(s);△H=-235.8kJ·mol-1,已知2Ag2O(s)=4Ag(s)+O2(g);△H=+62.2kJ·mol-1,则O3转化为O2的热化学方程式为_________ 。
(2)臭氧在水中易分解,臭氧的浓度减少一半所需的时间如下图所示。

pH增大能加速O3分解,表明对O3分解起催化作用的是_________ 。
(3)电解法臭氧发生器具有臭氧浓度高、成分纯净、在水中溶解度高的优势,在医疗、食品加工与养殖业及家庭方面具有广泛应用前景。科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧。臭氧在阳极周围的水中产生,其电极反应式为_______ ;阴极附近的氧气则生成过氧化氢,其电极反应式为_______ 。
(4)为测定大气中臭氧(O3)含量,将0℃、1.01×105Pa的空气VL慢慢通过足量KI溶液,使臭氧完全反应;然后将所得溶液用amL cmol/L的Na2S2O2溶液进行滴定恰好到达终点。
①O3与KI溶液反应生成两种单质,则反应的化学方程式_______ 。
②空气中臭氧的体积分数为_______ 。(已知:2Na2S2+I2=Na2S4O6+2NaI)
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如6Ag(s)+O3(g)=3Ag2O(s);△H=-235.8kJ·mol-1,已知2Ag2O(s)=4Ag(s)+O2(g);△H=+62.2kJ·mol-1,则O3转化为O2的热化学方程式为
(2)臭氧在水中易分解,臭氧的浓度减少一半所需的时间如下图所示。

pH增大能加速O3分解,表明对O3分解起催化作用的是
(3)电解法臭氧发生器具有臭氧浓度高、成分纯净、在水中溶解度高的优势,在医疗、食品加工与养殖业及家庭方面具有广泛应用前景。科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧。臭氧在阳极周围的水中产生,其电极反应式为
(4)为测定大气中臭氧(O3)含量,将0℃、1.01×105Pa的空气VL慢慢通过足量KI溶液,使臭氧完全反应;然后将所得溶液用amL cmol/L的Na2S2O2溶液进行滴定恰好到达终点。
①O3与KI溶液反应生成两种单质,则反应的化学方程式
②空气中臭氧的体积分数为
您最近一年使用:0次



