1 . 利用 制甲醇具有重要意义。其过程可能发生的反应如下:
制甲醇具有重要意义。其过程可能发生的反应如下:
反应1: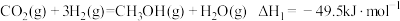
反应2:
反应3: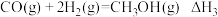
(1)
_______ 
(2)恒容条件下,下列有利于提高 平衡产率的条件是_______。
平衡产率的条件是_______。
(3)控制一定压强,通入 和
和 ,反应
,反应 后,
后, 转化率
转化率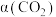 、
、 产率
产率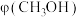 及
及 产率
产率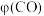 随温度变化曲线如图。
随温度变化曲线如图。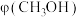 先升高后降低的原因是
先升高后降低的原因是_______ 。
②260℃时,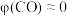 (认为此时只发生反应1),
(认为此时只发生反应1),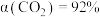 ,气体总体积为
,气体总体积为 ,则该温度下反应1的平衡常数
,则该温度下反应1的平衡常数
_______ (列出代数式即可),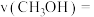
_______ (列出代数式即可)。
③280℃时, ,
, ,则反应2的平衡常数
,则反应2的平衡常数
_______ (列出代数式即可)。
(4)学界关于反应2产生的 能否发生反应3存在争议。科学家利用
能否发生反应3存在争议。科学家利用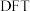 模拟
模拟 催化剂表面合成
催化剂表面合成 的两种不同路径,其决速步及活化能
的两种不同路径,其决速步及活化能 分别如下。
分别如下。
路径1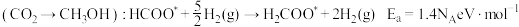
路径2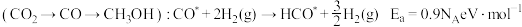
由此分析,200~260℃时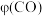 降低的原因是
降低的原因是_______ 。
 制甲醇具有重要意义。其过程可能发生的反应如下:
制甲醇具有重要意义。其过程可能发生的反应如下:反应1:
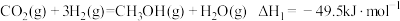
反应2:

反应3:
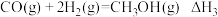
(1)


(2)恒容条件下,下列有利于提高
 平衡产率的条件是_______。
平衡产率的条件是_______。| A.使用催化剂 | B.调整 和 和 的投料比由1∶1至1∶3 的投料比由1∶1至1∶3 |
| C.增大反应物总压 | D.通入稀有气体 |
 和
和 ,反应
,反应 后,
后, 转化率
转化率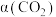 、
、 产率
产率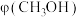 及
及 产率
产率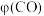 随温度变化曲线如图。
随温度变化曲线如图。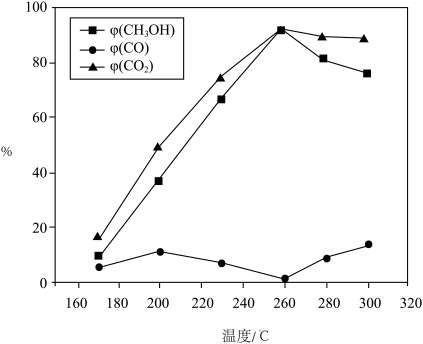
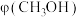 先升高后降低的原因是
先升高后降低的原因是②260℃时,
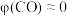 (认为此时只发生反应1),
(认为此时只发生反应1),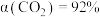 ,气体总体积为
,气体总体积为 ,则该温度下反应1的平衡常数
,则该温度下反应1的平衡常数
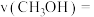
③280℃时,
 ,
, ,则反应2的平衡常数
,则反应2的平衡常数
(4)学界关于反应2产生的
 能否发生反应3存在争议。科学家利用
能否发生反应3存在争议。科学家利用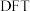 模拟
模拟 催化剂表面合成
催化剂表面合成 的两种不同路径,其决速步及活化能
的两种不同路径,其决速步及活化能 分别如下。
分别如下。路径1
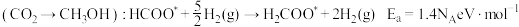
路径2
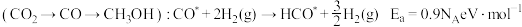
由此分析,200~260℃时
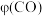 降低的原因是
降低的原因是
您最近一年使用:0次
解题方法
2 . 填空。
(1)25℃、101kPa时,26gC2H2气体完全燃烧生成二氧化碳气体和液态水放出1299.6kJ的热,写出该反应的热化学方程式_______ 。
(2)研究NO2、SO2等大气污染气体的处理方法具有重要的意义。
已知:①2SO2(g)+O2(g)⇌2SO3(g) ∆H1=-196kJ∙mol-1
②2NO(g)+O2(g)⇌2NO2(g) ∆H2=-113.0kJ∙mol-1
则反应NO2(g)+SO2(g)⇌SO3(g)+NO(g)的∆H=_______ kJ∙mol-1。
(3)已知拆开1mol下列气态分子形成独立的气态原子时需要的能量数据如表。
则N2(g)+O2(g)=2NO(g) ΔH=_______ kJ·mol-1。
(1)25℃、101kPa时,26gC2H2气体完全燃烧生成二氧化碳气体和液态水放出1299.6kJ的热,写出该反应的热化学方程式
(2)研究NO2、SO2等大气污染气体的处理方法具有重要的意义。
已知:①2SO2(g)+O2(g)⇌2SO3(g) ∆H1=-196kJ∙mol-1
②2NO(g)+O2(g)⇌2NO2(g) ∆H2=-113.0kJ∙mol-1
则反应NO2(g)+SO2(g)⇌SO3(g)+NO(g)的∆H=
(3)已知拆开1mol下列气态分子形成独立的气态原子时需要的能量数据如表。
| 物质 | N2 | O2 | NO |
| 能量(kJ·mol-1) | 946 | 498 | 632 |
您最近一年使用:0次
2022-12-22更新
|
472次组卷
|
2卷引用:福建省泉州市第六中学2021-2022学年高二上学期期中模块测试化学试题



