名校
1 . 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)如图是 (g)和
(g)和 (g)反应生成1mol
(g)反应生成1mol (g)过程中能量的变化示意图,请写出
(g)过程中能量的变化示意图,请写出 和
和 反应的热化学方程式∶
反应的热化学方程式∶___________
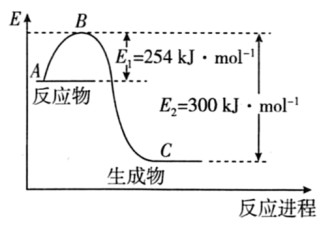
(2)若已知下列数据∶
试根据表中及图中数据计算N-H的键能∶___________ kJ·mol-1
(3)用 催化还原NOx还可以消除氮氧化物的污染。已知:
催化还原NOx还可以消除氮氧化物的污染。已知:
 ①
①
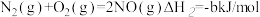 ②
②
若1mol 还原NO至
还原NO至 ,则该反应过程中的反应热△H3
,则该反应过程中的反应热△H3___________ kJ/mol(用含a、b的式子表示)。
(4)捕碳技术(主要指捕获 )在降低温室气体排放中具有重要的作用。目前
)在降低温室气体排放中具有重要的作用。目前 和
和 已经被用作工业捕碳剂,它们与
已经被用作工业捕碳剂,它们与 可发生如下可逆反应:
可发生如下可逆反应:
反应I: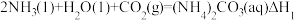
反应II: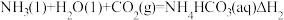
反应Ⅲ: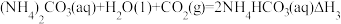
则△H3与△H1、△H2之间的关系是△H3=___________ 。
(1)如图是
 (g)和
(g)和 (g)反应生成1mol
(g)反应生成1mol (g)过程中能量的变化示意图,请写出
(g)过程中能量的变化示意图,请写出 和
和 反应的热化学方程式∶
反应的热化学方程式∶
(2)若已知下列数据∶
| 化学键 | H-H | N=N |
| 键能/kJ·mol-1 | 435 | 943 |
试根据表中及图中数据计算N-H的键能∶
(3)用
 催化还原NOx还可以消除氮氧化物的污染。已知:
催化还原NOx还可以消除氮氧化物的污染。已知: ①
①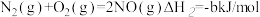 ②
②若1mol
 还原NO至
还原NO至 ,则该反应过程中的反应热△H3
,则该反应过程中的反应热△H3(4)捕碳技术(主要指捕获
 )在降低温室气体排放中具有重要的作用。目前
)在降低温室气体排放中具有重要的作用。目前 和
和 已经被用作工业捕碳剂,它们与
已经被用作工业捕碳剂,它们与 可发生如下可逆反应:
可发生如下可逆反应:反应I:
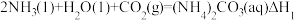
反应II:
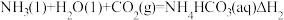
反应Ⅲ:
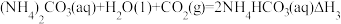
则△H3与△H1、△H2之间的关系是△H3=
您最近一年使用:0次
2021-06-20更新
|
1307次组卷
|
7卷引用:四川省成都市实验外国语学校(西区)2019-2020 学年高二上学期期中考试化学试题
四川省成都市实验外国语学校(西区)2019-2020 学年高二上学期期中考试化学试题(已下线)第1章 化学反应与能量(选拔卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)四川省攀枝花市成都外国语学校2021-2022学年高二上学期10月月考化学试题(已下线)1.2 反应热的计算(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)江苏省连云港市厉庄高级中学2022-2023学年高三上学期第一次质量检测化学试题江苏省常熟市王淦昌高级中学2022-2023学年高二上学期10月月考化学试卷新疆维吾尔自治区伊犁哈萨克自治州新源县第二中学2021-2022学年高三上学期第二次月考化学试题
名校
解题方法
2 . (1)由氢气和氧气反应生成1 mol水蒸气放热241.8 kJ,写出该反应的热化学方程式:_______ 。若1g水蒸气转化成液态水放热2.444kJ,则反应H2(g)+ O2(g)=H2O(l)的ΔH=
O2(g)=H2O(l)的ΔH=_______ kJ/mol。氢气的燃烧热为_______ kJ/mol。
(2)火箭发射时可用肼(N2H4)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气。已知:N2(g)+2O2(g)=2NO2(g) ΔH=+67.7 kJ/mol;N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534 kJ/mol;则N2H4和NO2反应的热化学方程式为_______ 。
 O2(g)=H2O(l)的ΔH=
O2(g)=H2O(l)的ΔH=(2)火箭发射时可用肼(N2H4)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气。已知:N2(g)+2O2(g)=2NO2(g) ΔH=+67.7 kJ/mol;N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534 kJ/mol;则N2H4和NO2反应的热化学方程式为
您最近一年使用:0次
20-21高二上·全国·课时练习
解题方法
3 . 采用科学技术减少氮氧化物等物质的排放可促进社会主义生态文明建设。
用CH4催化还原氮氧化物的相关热化学方程式如下:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(1)∆H=-662kJ•mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(l)∆H=-1248kJ•mol-1
反应CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)∆H=_____ kJ•mol-1
用CH4催化还原氮氧化物的相关热化学方程式如下:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(1)∆H=-662kJ•mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(l)∆H=-1248kJ•mol-1
反应CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)∆H=
您最近一年使用:0次
解题方法
4 . (1)在化工生产过程中,少量CO的存在会引起催化剂中毒。为了防止催化剂中毒,常用 将CO氧化,
将CO氧化, 被还原为S。
被还原为S。
已知:
①
②
③
则 氧化CO的热化学方程式为
氧化CO的热化学方程式为___________ 。
(2)用 将HCl转化为
将HCl转化为 的过程如图所示。
的过程如图所示。

其中,过程①的热化学方程式为 ,过程②生成1mol
,过程②生成1mol 的反应焓变为
的反应焓变为 ,则由
,则由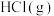 生成
生成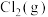 的热化学方程式为
的热化学方程式为__________ 。(反应焓变用 和
和 表示)。
表示)。
(3)已知:
① ;
;
② 。
。
写出由 和
和 生成
生成 的热化学方程式:
的热化学方程式:__________ 。
(4)工业上可通过天然气跟水蒸气反应制取 ,有关反应的能量变化如图所示,则该反应的
,有关反应的能量变化如图所示,则该反应的
_________ (用含a、b、c的式子表示)。

 将CO氧化,
将CO氧化, 被还原为S。
被还原为S。已知:
①

②

③

则
 氧化CO的热化学方程式为
氧化CO的热化学方程式为(2)用
 将HCl转化为
将HCl转化为 的过程如图所示。
的过程如图所示。
其中,过程①的热化学方程式为
 ,过程②生成1mol
,过程②生成1mol 的反应焓变为
的反应焓变为 ,则由
,则由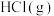 生成
生成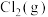 的热化学方程式为
的热化学方程式为 和
和 表示)。
表示)。(3)已知:
①
 ;
;②
 。
。写出由
 和
和 生成
生成 的热化学方程式:
的热化学方程式:(4)工业上可通过天然气跟水蒸气反应制取
 ,有关反应的能量变化如图所示,则该反应的
,有关反应的能量变化如图所示,则该反应的

您最近一年使用:0次
5 . (1)工业上利用天然气(主要成分为 )与
)与 进行高温重整制备CO的化学方程式为
进行高温重整制备CO的化学方程式为 ,已知
,已知 、
、 和CO的燃烧热分别为
和CO的燃烧热分别为 、
、 和
和 ,则生成
,则生成 (标准状况)CO所需的热量为
(标准状况)CO所需的热量为__________ 。
(2)已知将 氧化为
氧化为 的
的 ,单质硫的燃烧热为
,单质硫的燃烧热为 ,计算由
,计算由 生成
生成 的
的
_________ (需写出计算过程)。
 )与
)与 进行高温重整制备CO的化学方程式为
进行高温重整制备CO的化学方程式为 ,已知
,已知 、
、 和CO的燃烧热分别为
和CO的燃烧热分别为 、
、 和
和 ,则生成
,则生成 (标准状况)CO所需的热量为
(标准状况)CO所需的热量为(2)已知将
 氧化为
氧化为 的
的 ,单质硫的燃烧热为
,单质硫的燃烧热为 ,计算由
,计算由 生成
生成 的
的
您最近一年使用:0次
解题方法
6 . (1)已知:

则反应 的
的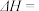
_____  。
。
(2) 催化重整反应为
催化重整反应为 。
。
已知:


该催化重整反应的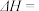
_____  。
。
(3) 在催化剂作用下发生反应:
在催化剂作用下发生反应:


则反应 的
的 为
为______  。
。
(4)用水吸收 的相关热化学方程式如下:
的相关热化学方程式如下:


反应 的
的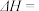
______ 


则反应
 的
的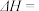
 。
。(2)
 催化重整反应为
催化重整反应为 。
。已知:



该催化重整反应的
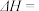
 。
。(3)
 在催化剂作用下发生反应:
在催化剂作用下发生反应:

则反应
 的
的 为
为 。
。(4)用水吸收
 的相关热化学方程式如下:
的相关热化学方程式如下:

反应
 的
的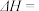

您最近一年使用:0次
解题方法
7 . (1) 催化重整不仅可以得到合成气(CO和
催化重整不仅可以得到合成气(CO和 ),还对温室气体的减排具有重要意义。回答下列问题:
),还对温室气体的减排具有重要意义。回答下列问题:
 催化重整反应为
催化重整反应为 。
。
已知: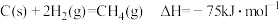
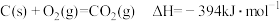
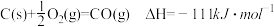
该催化重整反应的
________  。
。
(2)三氯氢硅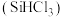 是制备硅烷、多晶硅的重要原料。回答下列问题:
是制备硅烷、多晶硅的重要原料。回答下列问题:
① 在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成
在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成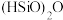 等,写出该反应的化学方程式:
等,写出该反应的化学方程式:_________ 。
② 在催化剂作用下发生反应:
在催化剂作用下发生反应:


则反应 的
的 为
为________  。
。
 催化重整不仅可以得到合成气(CO和
催化重整不仅可以得到合成气(CO和 ),还对温室气体的减排具有重要意义。回答下列问题:
),还对温室气体的减排具有重要意义。回答下列问题: 催化重整反应为
催化重整反应为 。
。已知:
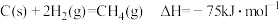
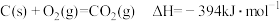
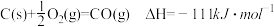
该催化重整反应的

 。
。(2)三氯氢硅
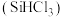 是制备硅烷、多晶硅的重要原料。回答下列问题:
是制备硅烷、多晶硅的重要原料。回答下列问题:①
 在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成
在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成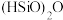 等,写出该反应的化学方程式:
等,写出该反应的化学方程式:②
 在催化剂作用下发生反应:
在催化剂作用下发生反应:

则反应
 的
的 为
为 。
。
您最近一年使用:0次
2020高三·全国·专题练习
8 . CH4—CO2催化重整反应为CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol-1
C(s)+ O2(g)=CO(g) ΔH=-111 kJ·mol-1
O2(g)=CO(g) ΔH=-111 kJ·mol-1
该催化重整反应的ΔH=____ kJ·mol-1。
已知:C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol-1
C(s)+
 O2(g)=CO(g) ΔH=-111 kJ·mol-1
O2(g)=CO(g) ΔH=-111 kJ·mol-1该催化重整反应的ΔH=
您最近一年使用:0次
2020-05-29更新
|
959次组卷
|
10卷引用:专题九 化学能与热能(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训
(已下线)专题九 化学能与热能(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训(已下线)专题6.1 化学能与热能(练)——2020年高考化学一轮复习讲练测(已下线)专题6.1 化学能与热能(讲)——2020年高考化学一轮复习讲练测高中必刷题高二选择性必修1第一章 化学反应的热效应 第一章素养检测广西岑溪市第一中学2020-2021学年高二9月月考化学试题(已下线)第19讲 化学能与热能 (精讲)——2021年高考化学一轮复习讲练测(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点17 化学反应的热效应-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)1.2.2 化学反应焓变的计算-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)
9 . 氧气是一种清洁能源,氧气的制取与储存是氢能源利用领域的研究热点。
已知:CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH=206.2 kJ•
CH4(g)+CO2(g)=2CO(g)+2H2(g)ΔH=247.4 kJ•
2H2S(g)=2H2(g)+S2(g)ΔH=169.8 kJ•
以甲烷为原料制取氢气是工业上常用的制氢方法。CH4与 H2O(g)反应生成CO2(g)和 H2(g)的热化学方程式为_______ 。
已知:CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH=206.2 kJ•

CH4(g)+CO2(g)=2CO(g)+2H2(g)ΔH=247.4 kJ•

2H2S(g)=2H2(g)+S2(g)ΔH=169.8 kJ•

以甲烷为原料制取氢气是工业上常用的制氢方法。CH4与 H2O(g)反应生成CO2(g)和 H2(g)的热化学方程式为
您最近一年使用:0次
名校
解题方法
10 . 随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。
(1)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用如下方法合成甲醇:
方法一 CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
方法二 CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
在25 ℃、101 kPa下,1g液态甲醇完全燃烧放热22.68 kJ,写出甲醇燃烧热的热化学方程式:_________________ 。
(2)金属钛冶炼过程中其中一步反应是将原料金红石转化:
TiO2(金红石)+2C+2Cl2 TiCl4+2CO
TiCl4+2CO
已知:C(s)+O2(g)=CO2(g) ΔH=﹣393.5kJ/mol
2CO(g)+O2(g)=2CO2(g) ΔH=﹣566 kJ/mol
TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ΔH=+141 kJ/mol
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=_______________________ 。
(3)臭氧可用于净化空气,饮用水消毒,处理工业废物和作为漂白剂。臭氧几乎可与除铂、金、铱、氟以外的所有单质反应如6Ag(s)+O3(g)=3Ag2O(s) ΔH=﹣235.8 kJ/mol,
已知:2Ag2O(s)=4Ag(s)+O2(g) ΔH= +62.2 kJ/mol,则O3转化为O2的热化学方程式为________________ 。
(1)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用如下方法合成甲醇:
方法一 CO(g)+2H2(g)
 CH3OH(g)
CH3OH(g)方法二 CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)在25 ℃、101 kPa下,1g液态甲醇完全燃烧放热22.68 kJ,写出甲醇燃烧热的热化学方程式:
(2)金属钛冶炼过程中其中一步反应是将原料金红石转化:
TiO2(金红石)+2C+2Cl2
 TiCl4+2CO
TiCl4+2CO已知:C(s)+O2(g)=CO2(g) ΔH=﹣393.5kJ/mol
2CO(g)+O2(g)=2CO2(g) ΔH=﹣566 kJ/mol
TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ΔH=+141 kJ/mol
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=
(3)臭氧可用于净化空气,饮用水消毒,处理工业废物和作为漂白剂。臭氧几乎可与除铂、金、铱、氟以外的所有单质反应如6Ag(s)+O3(g)=3Ag2O(s) ΔH=﹣235.8 kJ/mol,
已知:2Ag2O(s)=4Ag(s)+O2(g) ΔH= +62.2 kJ/mol,则O3转化为O2的热化学方程式为
您最近一年使用:0次
2019-12-09更新
|
195次组卷
|
4卷引用:河南省鹤壁市高级中学2018-2019学年高一下学期第一次段考化学试题
河南省鹤壁市高级中学2018-2019学年高一下学期第一次段考化学试题(已下线)2019年12月18日 《每日一题》化学人教版(选修4)——盖斯定律2020年春季人教版高中化学选修4第一章《化学反应与能量》测试卷贵州省贵阳市清镇养正学校2019-2020学年高二上学期期中考试化学试题



