1 . 甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g) CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
由此计算△H1=________ kJ.mol-1,已知△H2=-58kJ.mol-1,则△H3=_________ kJ.mol-1
(2)反应①的化学平衡常数K的表达式为_____________ ;图1中能正确反映平衡常数K随温度变化关系的曲线为______ (填曲线标记字母),其判断理由是__________________ 。
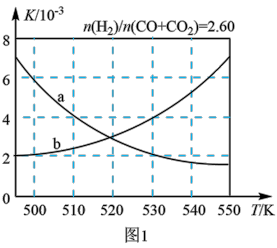 .
.
①CO(g)+2H2(g)
 CH3OH(g) △H1
CH3OH(g) △H1②CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2③CO2(g)+H2(g)
 CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
| 化学键 | H-H | C-O | C O O | H-O | C-H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1=
(2)反应①的化学平衡常数K的表达式为
 .
.
您最近一年使用:0次
2019-11-02更新
|
131次组卷
|
2卷引用:山东省淄博市淄川区般阳中学2019-2020学年高二10月月考化学试题
2018高三·全国·专题练习
名校
2 . 研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:
(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示:

反应的热化学方程式为____________________________ 。
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9 kJ•mol−1,H—H键的键能是436.0 kJ•mol−1,N—H键的键能是391.55 kJ•mol−1,则1/2N2(g)+3/2H2(g) NH3(g) ΔH=
NH3(g) ΔH=_____________________ 。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:①C(s,石墨)+O2(g) CO2(g) ΔH1=−393.5 kJ•mol−1
CO2(g) ΔH1=−393.5 kJ•mol−1
②2H2(g)+O2(g) 2H2O(l) ΔH2=−571.6 kJ•mol−1
2H2O(l) ΔH2=−571.6 kJ•mol−1
③2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l)ΔH3=−2599 kJ•mol−1
4CO2(g)+2H2O(l)ΔH3=−2599 kJ•mol−1
298 K时反应2C(s,石墨)+H2(g)=C2H2(g)的焓变:ΔH=_____________________ 。
(4)已知:铝热反应是放热反应,又知,常温下: 4Al(s)+3O2(g) 2Al2O3(s) ΔH1
2Al2O3(s) ΔH1
4Fe(s)+3O2(g) 2Fe2O3(s) ΔH2
2Fe2O3(s) ΔH2
下面关于ΔH1、ΔH2的比较正确的是________
A.ΔH1>ΔH2 B.ΔH1<ΔH2 C.ΔH1=ΔH2 D.无法计算
(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示:

反应的热化学方程式为
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9 kJ•mol−1,H—H键的键能是436.0 kJ•mol−1,N—H键的键能是391.55 kJ•mol−1,则1/2N2(g)+3/2H2(g)
 NH3(g) ΔH=
NH3(g) ΔH=(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:①C(s,石墨)+O2(g)
 CO2(g) ΔH1=−393.5 kJ•mol−1
CO2(g) ΔH1=−393.5 kJ•mol−1②2H2(g)+O2(g)
 2H2O(l) ΔH2=−571.6 kJ•mol−1
2H2O(l) ΔH2=−571.6 kJ•mol−1③2C2H2(g)+5O2(g)
 4CO2(g)+2H2O(l)ΔH3=−2599 kJ•mol−1
4CO2(g)+2H2O(l)ΔH3=−2599 kJ•mol−1298 K时反应2C(s,石墨)+H2(g)=C2H2(g)的焓变:ΔH=
(4)已知:铝热反应是放热反应,又知,常温下: 4Al(s)+3O2(g)
 2Al2O3(s) ΔH1
2Al2O3(s) ΔH14Fe(s)+3O2(g)
 2Fe2O3(s) ΔH2
2Fe2O3(s) ΔH2下面关于ΔH1、ΔH2的比较正确的是
A.ΔH1>ΔH2 B.ΔH1<ΔH2 C.ΔH1=ΔH2 D.无法计算
您最近一年使用:0次
2018-10-22更新
|
249次组卷
|
5卷引用:解密08 化学反应与热能(教师版)——备战2018年高考化学之高频考点解密
(已下线)解密08 化学反应与热能(教师版)——备战2018年高考化学之高频考点解密2018-2019学年人教版高二化学选修四章:化学反应与能量末测试题重庆市南开中学2018-2019学年高二上学期第一次月考化学试题(已下线)《2018-2019学年同步单元双基双测AB卷》第一单元 化学反应与能量单元测试(A卷)(已下线)【南昌新东方】2019 进贤二中 高二上 第二次月考
3 . TiO2 TiCl4
TiCl4 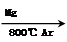 Ti
Ti
已知:①C(s)+O2(g)===CO2(g);ΔH=-393.5kJ·mol-1
②2CO(g)+O2(g)===2CO2(g);ΔH=-566kJ·mol-1
③TiO2(s)+2Cl2(g)===TiCl4(s)+O2(g);ΔH=+141kJ·mol-1,则TiO2(s)+2Cl2(g)+2C(s)===TiCl4(s)+2CO(g)的ΔH=__________。反应TiCl4+2Mg===2MgCl2+Ti在Ar气氛中进行的理由_______________________________________________________________________________________。
 TiCl4
TiCl4 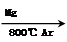 Ti
Ti已知:①C(s)+O2(g)===CO2(g);ΔH=-393.5kJ·mol-1
②2CO(g)+O2(g)===2CO2(g);ΔH=-566kJ·mol-1
③TiO2(s)+2Cl2(g)===TiCl4(s)+O2(g);ΔH=+141kJ·mol-1,则TiO2(s)+2Cl2(g)+2C(s)===TiCl4(s)+2CO(g)的ΔH=__________。反应TiCl4+2Mg===2MgCl2+Ti在Ar气氛中进行的理由_______________________________________________________________________________________。
您最近一年使用:0次



