1 . 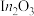 上
上 加氢制甲醇的某种反应路线如图,下列说法错误的是
加氢制甲醇的某种反应路线如图,下列说法错误的是
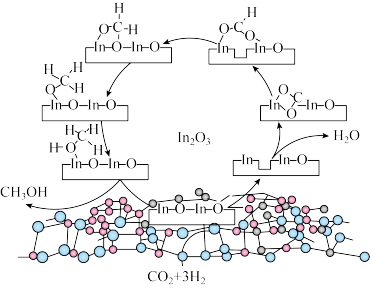
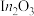 上
上 加氢制甲醇的某种反应路线如图,下列说法错误的是
加氢制甲醇的某种反应路线如图,下列说法错误的是
A.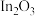 降低了总反应的活化能 降低了总反应的活化能 |
| B.该路线有非极性键的断裂和形成 |
| C.该合成路线符合绿色化学理念 |
| D.甲醇与水分子能形成分子间氢键 |
您最近一年使用:0次
2 . 2023年杭州亚运会主火炬塔首次使用废碳再生的“绿色甲醇”作为燃料,实现了循环内的零排放。“零碳甲醇”作为公认的新型清洁可再生能源,不易爆炸、储运安全便捷。
甲醇的制备方法有二氧化碳加氢法、电催化法、甲烷催化氧化法等。回答下列问题:
Ⅰ.二氧化碳加氢制甲醇:
①
 kJ/mol
kJ/mol
②
 kJ/mol
kJ/mol
③

已知:甲醇的选择性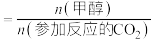
(1)
___________ ,该反应自发进行的条件是___________ 。
(2)一定温度下,在恒容密闭反应器中,反应③达到平衡,下列措施中能使平衡体系中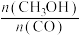 增大且加快化学反应速率的是___________ (填字母)。
增大且加快化学反应速率的是___________ (填字母)。
(3)恒温恒容条件下,原料气 、
、 以物质的量浓度之比为1∶3投料时,控制合适条件(不考虑反应③),甲醇的选择性为60%。已知初始压强为4MPa,
以物质的量浓度之比为1∶3投料时,控制合适条件(不考虑反应③),甲醇的选择性为60%。已知初始压强为4MPa, ,达到平衡时,
,达到平衡时,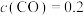 mol/L,则该过程中
mol/L,则该过程中 的平衡转化率为
的平衡转化率为___________ %,该条件下反应②的
___________ (保留三位有效数字)。
Ⅱ.电催化法
一种基于铜基金属簇催化剂电催化还原 制备甲醇的装置如左下图所示。控制其他条件相同,将一定量的
制备甲醇的装置如左下图所示。控制其他条件相同,将一定量的 通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如右下图所示。
通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如右下图所示。 的电极反应式为
的电极反应式为___________ 。
(5)控制电压为0.8V,电解时转移电子的物质的量为___________ mol。
Ⅲ.甲烷催化氧化法
主反应: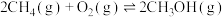
副反应: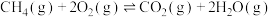
科学家将 、
、 和
和 (
( 是活性催化剂)按一定体积比在催化剂表面合成甲醇,部分反应历程如图所示(吸附在催化剂表面的物种用*标注,TS代表过渡态)。
是活性催化剂)按一定体积比在催化剂表面合成甲醇,部分反应历程如图所示(吸附在催化剂表面的物种用*标注,TS代表过渡态)。___________ kJ·mol ,写出该步骤反应的化学方程式:
,写出该步骤反应的化学方程式:___________ 。
甲醇的制备方法有二氧化碳加氢法、电催化法、甲烷催化氧化法等。回答下列问题:
Ⅰ.二氧化碳加氢制甲醇:
①

 kJ/mol
kJ/mol②

 kJ/mol
kJ/mol③


已知:甲醇的选择性
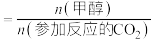
(1)

(2)一定温度下,在恒容密闭反应器中,反应③达到平衡,下列措施中能使平衡体系中
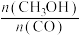 增大且加快化学反应速率的是___________ (填字母)。
增大且加快化学反应速率的是___________ (填字母)。| A.升高温度 | B.充入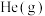 ,使体系压强增大 ,使体系压强增大 |
C.再充入1 mol | D.将 从体系中分离出去 从体系中分离出去 |
(3)恒温恒容条件下,原料气
 、
、 以物质的量浓度之比为1∶3投料时,控制合适条件(不考虑反应③),甲醇的选择性为60%。已知初始压强为4MPa,
以物质的量浓度之比为1∶3投料时,控制合适条件(不考虑反应③),甲醇的选择性为60%。已知初始压强为4MPa, ,达到平衡时,
,达到平衡时,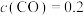 mol/L,则该过程中
mol/L,则该过程中 的平衡转化率为
的平衡转化率为
Ⅱ.电催化法
一种基于铜基金属簇催化剂电催化还原
 制备甲醇的装置如左下图所示。控制其他条件相同,将一定量的
制备甲醇的装置如左下图所示。控制其他条件相同,将一定量的 通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如右下图所示。
通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如右下图所示。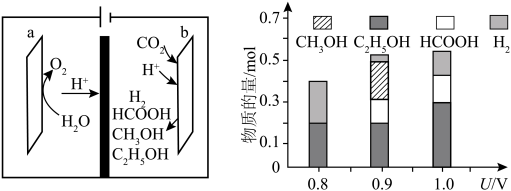
 的电极反应式为
的电极反应式为(5)控制电压为0.8V,电解时转移电子的物质的量为
Ⅲ.甲烷催化氧化法
主反应:
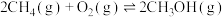
副反应:
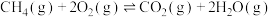
科学家将
 、
、 和
和 (
( 是活性催化剂)按一定体积比在催化剂表面合成甲醇,部分反应历程如图所示(吸附在催化剂表面的物种用*标注,TS代表过渡态)。
是活性催化剂)按一定体积比在催化剂表面合成甲醇,部分反应历程如图所示(吸附在催化剂表面的物种用*标注,TS代表过渡态)。
 ,写出该步骤反应的化学方程式:
,写出该步骤反应的化学方程式:
您最近一年使用:0次
3 . 以CO2为原料制备甲烷等能源物质具有较好的发展前景。
(1)CO2催化(固体催化剂)加氢合成甲烷过程发生以下两个反应:
主反应:CO2(g)+4H2(g) CH4+2H2O(g) △H1 = -156.9 kJ·mol-1
CH4+2H2O(g) △H1 = -156.9 kJ·mol-1
副反应:CO2(g)+H2(g) CO+H2O(g) △H2 = +41.1kJ·mol-1
CO+H2O(g) △H2 = +41.1kJ·mol-1
为了提高CO2加氢制备CH4过程中CH4的选择性(CH4选择性= ),主要是通过对催化剂的合理选择来实现。
),主要是通过对催化剂的合理选择来实现。
①CO2加氢制备CH4的一种催化机理如图,下列说法中正确的是_______ (填字母标号)。

A.催化过程使用的催化剂为La2O3和La2O2CO3
B. La2O2CO3可以释放出CO2*(活化分子)
C.H2经过Ni活性中心裂解产生活化态H*的过程为放热过程
D. CO2加氢制备CH4的过程需要La2O3和Ni共同完成
②保持温度500℃不变,向1L密闭容器中充入4molCO2和12molH2发生反应,若初始压强为p,20min后主、副反应都达到平衡状态,测得此时c(H2O)=5mol·L-1,体系压强变为0.75p,则CO的平衡分压p(CO)=_______ ,主、副反应的综合热效应为_______ , CH4选择性=_______ (保留3位有效数字)。
(2)CO2的光电催化反应器如下图所示。以TiO2为阳极,通过光解水产生电子和质子,而后传递到阴极(Pt/CNT)诱导阴极催化还原CO2制得异丙醇,生成异丙醇的电极反应式为_______ 。

(3)甲醇催化制取乙烯的过程中发生如下反应:
I. 3CH3OH(g) C3H6(g)+3H2O(g)
C3H6(g)+3H2O(g)
II. 2CH3OH(g) C2H4(g)+2H2O(g)
C2H4(g)+2H2O(g)
反应I的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式 (Ea为活化能,k为速率常数,R和C为常数)。则该反应的活化能Ea=
(Ea为活化能,k为速率常数,R和C为常数)。则该反应的活化能Ea=_______ kJ·mol-1。当改变外界条件时,实验数据如图中的曲线b所示,则实验可能改变的外界条件是_______ 。

(4)甲酸被认为是理想的氢能载体,我国科技工作者运用DFT计算研究单分子HCOOH在催化剂表面分解产生H2的反应历程如下图所示,其中吸附在催化剂表面的物种用*标注。已知:法拉第常数F = 96500C·mol-1。

①该反应历程中甲酸分解制氢气的△H =_______ kJ·mol-1。
②甲酸直接作为燃料电池的燃料具有能量密度高的优点,该电池的理论输出电压为2.76V,能量密度E =_______ kW·h·kg-1 (保留3位有效数字,能量密度=电池输出电能/燃料质量,1kW·h = 3.6×106 J )。
(1)CO2催化(固体催化剂)加氢合成甲烷过程发生以下两个反应:
主反应:CO2(g)+4H2(g)
 CH4+2H2O(g) △H1 = -156.9 kJ·mol-1
CH4+2H2O(g) △H1 = -156.9 kJ·mol-1副反应:CO2(g)+H2(g)
 CO+H2O(g) △H2 = +41.1kJ·mol-1
CO+H2O(g) △H2 = +41.1kJ·mol-1为了提高CO2加氢制备CH4过程中CH4的选择性(CH4选择性=
 ),主要是通过对催化剂的合理选择来实现。
),主要是通过对催化剂的合理选择来实现。①CO2加氢制备CH4的一种催化机理如图,下列说法中正确的是

A.催化过程使用的催化剂为La2O3和La2O2CO3
B. La2O2CO3可以释放出CO2*(活化分子)
C.H2经过Ni活性中心裂解产生活化态H*的过程为放热过程
D. CO2加氢制备CH4的过程需要La2O3和Ni共同完成
②保持温度500℃不变,向1L密闭容器中充入4molCO2和12molH2发生反应,若初始压强为p,20min后主、副反应都达到平衡状态,测得此时c(H2O)=5mol·L-1,体系压强变为0.75p,则CO的平衡分压p(CO)=
(2)CO2的光电催化反应器如下图所示。以TiO2为阳极,通过光解水产生电子和质子,而后传递到阴极(Pt/CNT)诱导阴极催化还原CO2制得异丙醇,生成异丙醇的电极反应式为

(3)甲醇催化制取乙烯的过程中发生如下反应:
I. 3CH3OH(g)
 C3H6(g)+3H2O(g)
C3H6(g)+3H2O(g)II. 2CH3OH(g)
 C2H4(g)+2H2O(g)
C2H4(g)+2H2O(g)反应I的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式
 (Ea为活化能,k为速率常数,R和C为常数)。则该反应的活化能Ea=
(Ea为活化能,k为速率常数,R和C为常数)。则该反应的活化能Ea=
(4)甲酸被认为是理想的氢能载体,我国科技工作者运用DFT计算研究单分子HCOOH在催化剂表面分解产生H2的反应历程如下图所示,其中吸附在催化剂表面的物种用*标注。已知:法拉第常数F = 96500C·mol-1。

①该反应历程中甲酸分解制氢气的△H =
②甲酸直接作为燃料电池的燃料具有能量密度高的优点,该电池的理论输出电压为2.76V,能量密度E =
您最近一年使用:0次
名校
解题方法
4 . 2021年我国首次实现以CO2为原料人工合成淀粉,该过程涉及CO2加氢(电解水得氢气)转化为甲醇(CH3OH)的过程,其能量变化如图所示。

下列叙述正确的是

下列叙述正确的是
| A.CO2合成甲醇的反应中,寻找高效催化剂可以改变Q1和Q2的大小 |
| B.CO2合成甲醇的反应中,破坏反应物化学键吸收的能量大于形成产物化学键释放的能量 |
| C.CO2合成甲醇的反应中正反应活化能比逆反应的活化能大Q2kJ |
| D.CO2合成淀粉的过程有碳碳键形成 |
您最近一年使用:0次
2022-12-06更新
|
191次组卷
|
2卷引用:陕西省西安电子科技中学2023-2024学年高二上学期期中测评化学试题
名校
5 . 合成气(CO和H2)是目前化工常用的原料,下面是用甲烷制备合成气的两种方法:①CH4(g)+H2O(g) CO(g)+3H2(g) ΔH1=+216 kJ·mol-1;②2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH2=-72 kJ·mol-1。其中一个反应的反应过程与能量变化关系如图所示。则下列说法正确的是
CO(g)+3H2(g) ΔH1=+216 kJ·mol-1;②2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH2=-72 kJ·mol-1。其中一个反应的反应过程与能量变化关系如图所示。则下列说法正确的是
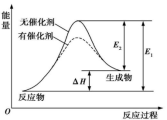
 CO(g)+3H2(g) ΔH1=+216 kJ·mol-1;②2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH2=-72 kJ·mol-1。其中一个反应的反应过程与能量变化关系如图所示。则下列说法正确的是
CO(g)+3H2(g) ΔH1=+216 kJ·mol-1;②2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH2=-72 kJ·mol-1。其中一个反应的反应过程与能量变化关系如图所示。则下列说法正确的是
| A.E1表示2CH4(g)+O2(g)=2CO(g)+4H2(g)的活化能 |
B.E2表示CH4(g)+H2O(g) CO(g)+3H2(g)的活化能 CO(g)+3H2(g)的活化能 |
| C.该图示为反应②的反应过程与能量变化示意图 |
| D.一般情况下,加入催化剂,既能降低E1,也能降低E2,但不能改变E1与E2的差值 |
您最近一年使用:0次
2018-01-20更新
|
459次组卷
|
6卷引用:陕西省西安市长安区第一中学2017-2018学年高二上学期期末考试化学(理)试题



