名校
解题方法
1 . 2021年我国科学家以 为原料人工合成淀粉,其效率约为传统农业生产淀粉的8.5倍,其部分合成路线如图所示,下列有关说法正确的是
为原料人工合成淀粉,其效率约为传统农业生产淀粉的8.5倍,其部分合成路线如图所示,下列有关说法正确的是
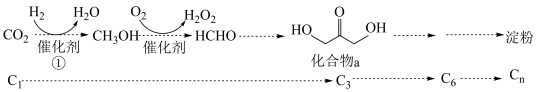
①
②
③
④
 为原料人工合成淀粉,其效率约为传统农业生产淀粉的8.5倍,其部分合成路线如图所示,下列有关说法正确的是
为原料人工合成淀粉,其效率约为传统农业生产淀粉的8.5倍,其部分合成路线如图所示,下列有关说法正确的是
①

②

③

④

| A.第①步反应断裂了非极性键与极性键 |
| B.催化剂降低了反应的活化能,改变了反应的焓变,降低了合成淀粉的难度 |
C. |
| D.反应④是吸热反应,活化能较大,所以是决速步 |
您最近一年使用:0次
名校
解题方法
2 . 过氧化氢(H2O2)是常用的绿色氧化剂。某化学兴趣小组查阅了H2O2的相关信息,并针对它的某些性质进行了探究,具体如下:H2O2可以通过H2和O2在某催化剂表面直接反应合成,具体原理如下图所示:

(1)采用同位素示踪法研究催化剂中H+的作用:将H2用D2(2H2)代替再进行实验。催化剂中氢离子参与反应的证据是生成的产物中有H2O2或_______ 粒子(填化学式)。
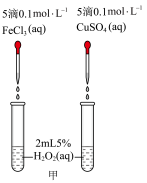
II.H2O2不稳定,在Fe3+、Cu2+等粒子的催化下会很快分解并放出热量。为了比较Fe3+和Cu2+对H2O2分解的催化效果,设计了如下实验。
(2)定性分析:通过观察甲装置两支试管中_______ 的现象,得出关于FeCl3和CuSO4催化效果的结论。某同学认为此方案还需要进一步控制变量,提出可将试剂CuSO4更换为_______ (填化学式)。
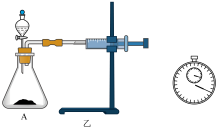
(3)定量测定:用乙装置进行定量实验。实验时组装好装置乙,关闭分液漏斗的活塞,将注射器活塞向外拉出一段距离后松开,观察活塞是否回到原来的位置。该操作的实验目的是_______ 。若反应30s后注射器中收集到气体的体积为VmL(标准状况),则锥形瓶A中实际产生气体的体积_______ VmL(填“>”、“<”或“=”)。
III.H2O2既有氧化性,又有还原性。
(4)H2O2可以氧化废水中的CN—,Cu2+可催化该反应。已知H2O2与CN—反应会生成参与大气循环的无毒气体。氰化氢(HCN)是一种易挥发的弱酸,有剧毒,对环境危害很大。
①H2O2与CN-的反应不能在酸性溶液中进行,原因是_______ ,反应生成气体的化学式为_______ 。
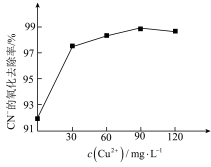
②一定条件下,测得CN-的氧化去除率随溶液中c(Cu2+)的变化如下图所示。c(Cu2+)过多时,CN-的氧化去除率有所下降,原因是_______ 。
(5)取少量84消毒液(有效成分为NaClO)于试管中,滴加H2O2溶液,产生大量无色气体。写出发生反应的化学方程式_______ 。

(1)采用同位素示踪法研究催化剂中H+的作用:将H2用D2(2H2)代替再进行实验。催化剂中氢离子参与反应的证据是生成的产物中有H2O2或
II.H2O2不稳定,在Fe3+、Cu2+等粒子的催化下会很快分解并放出热量。为了比较Fe3+和Cu2+对H2O2分解的催化效果,设计了如下实验。
(2)定性分析:通过观察甲装置两支试管中

(3)定量测定:用乙装置进行定量实验。实验时组装好装置乙,关闭分液漏斗的活塞,将注射器活塞向外拉出一段距离后松开,观察活塞是否回到原来的位置。该操作的实验目的是

III.H2O2既有氧化性,又有还原性。
(4)H2O2可以氧化废水中的CN—,Cu2+可催化该反应。已知H2O2与CN—反应会生成参与大气循环的无毒气体。氰化氢(HCN)是一种易挥发的弱酸,有剧毒,对环境危害很大。
①H2O2与CN-的反应不能在酸性溶液中进行,原因是
②一定条件下,测得CN-的氧化去除率随溶液中c(Cu2+)的变化如下图所示。c(Cu2+)过多时,CN-的氧化去除率有所下降,原因是

(5)取少量84消毒液(有效成分为NaClO)于试管中,滴加H2O2溶液,产生大量无色气体。写出发生反应的化学方程式
您最近一年使用:0次
解题方法
3 . 环状碳酸酯广泛用作极性非质子溶剂、电池的离子导体等,某研究团队以环氧乙烷衍生物(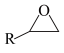 ,R表示烃基)和二氧化碳为原料催化合成环状碳酸酯,反应历程如图所示。下列说法错误的是
,R表示烃基)和二氧化碳为原料催化合成环状碳酸酯,反应历程如图所示。下列说法错误的是

 ,R表示烃基)和二氧化碳为原料催化合成环状碳酸酯,反应历程如图所示。下列说法错误的是
,R表示烃基)和二氧化碳为原料催化合成环状碳酸酯,反应历程如图所示。下列说法错误的是
A.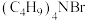 是反应的催化剂 是反应的催化剂 |
| B.反应过程中有极性键的断裂,无极性键的形成 |
| C.反应过程中有4种中间体 |
D.总反应方程式为  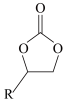 |
您最近一年使用:0次
名校
解题方法
4 . Ⅰ.我国学者采用量子力学方法,通过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在钯催化剂表面上的物种用*标注。
甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
方式 A:CH3OH* →CH3O* +H* Ea= +103.1kJ·mol-1
方式 B:CH3OH* →CH3* +OH* Eb= +249.3kJ·mol-1
由活化能E值推测,甲醇裂解过程主要历经的方式应为___________ (填A、B)。
下图为计算机模拟的各步反应的能量变化示意图。

该历程中,放热最多的步骤的化学方程式为___________ 。
Ⅱ.TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:

氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ΔH1=+175.4 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-220.9 kJ·mol-1
(1)沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式_____ 。
(2)工业上处理尾气中NO的方法为:将NO与H2的混合气体通入Ce(SO4)2与Ce2(SO4)3的混合溶液中,其物质转化如图所示。写出图示转化的总反应的化学方程式_____ 。

Ⅲ.甲醇可作为燃料电池的原料。CO2和CO可作为工业合成甲醇(CH3OH)的直接碳源,
(1)已知在常温常压下:①CH3OH(l)+ O2(g)=CO(g) + 2H2O(g); ΔH=﹣355.0 kJ∕mol
②2CO(g)+ O2(g)= 2CO2(g) ΔH=-566.0 kJ/mol ③H2O(l)=H2O(g) ΔH=+44.0 kJ/mol
写出表示甲醇燃烧热的热化学方程式:___________
(2)利用CO和H2在一定条件下可合成甲醇,发生如下反应:CO(g)+2H2(g)=CH3OH(g),其两种反应过程中能量的变化曲线如下图a、b所示,下列说法正确的是___________ 。
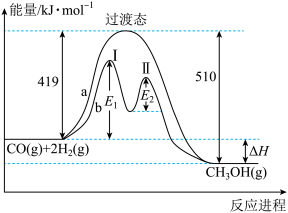
A.上述反应的ΔH=-91kJ·mol-1
B.a反应正反应的活化能为510kJ·mol-1
C.b过程中第Ⅰ阶段为吸热反应,第Ⅱ阶段为放热反应
D.b过程使用催化剂后降低了反应的活化能和ΔH
E.b过程的反应速率:第Ⅱ阶段>第Ⅰ阶段
甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
方式 A:CH3OH* →CH3O* +H* Ea= +103.1kJ·mol-1
方式 B:CH3OH* →CH3* +OH* Eb= +249.3kJ·mol-1
由活化能E值推测,甲醇裂解过程主要历经的方式应为
下图为计算机模拟的各步反应的能量变化示意图。

该历程中,放热最多的步骤的化学方程式为
Ⅱ.TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:

氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ΔH1=+175.4 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-220.9 kJ·mol-1
(1)沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式
(2)工业上处理尾气中NO的方法为:将NO与H2的混合气体通入Ce(SO4)2与Ce2(SO4)3的混合溶液中,其物质转化如图所示。写出图示转化的总反应的化学方程式

Ⅲ.甲醇可作为燃料电池的原料。CO2和CO可作为工业合成甲醇(CH3OH)的直接碳源,
(1)已知在常温常压下:①CH3OH(l)+ O2(g)=CO(g) + 2H2O(g); ΔH=﹣355.0 kJ∕mol
②2CO(g)+ O2(g)= 2CO2(g) ΔH=-566.0 kJ/mol ③H2O(l)=H2O(g) ΔH=+44.0 kJ/mol
写出表示甲醇燃烧热的热化学方程式:
(2)利用CO和H2在一定条件下可合成甲醇,发生如下反应:CO(g)+2H2(g)=CH3OH(g),其两种反应过程中能量的变化曲线如下图a、b所示,下列说法正确的是

A.上述反应的ΔH=-91kJ·mol-1
B.a反应正反应的活化能为510kJ·mol-1
C.b过程中第Ⅰ阶段为吸热反应,第Ⅱ阶段为放热反应
D.b过程使用催化剂后降低了反应的活化能和ΔH
E.b过程的反应速率:第Ⅱ阶段>第Ⅰ阶段
您最近一年使用:0次
2021-07-14更新
|
648次组卷
|
3卷引用:湖北省襄阳市第一中学2022-2023学年高一下学期4月月考化学试题
湖北省襄阳市第一中学2022-2023学年高一下学期4月月考化学试题江西省景德镇一中2020-2021学年高一下学期期末考试化学试题(已下线)易错点20 化学反应机理-备战2023年高考化学考试易错题



