1 . 对H2O2的分解速率影响因素进行研究。
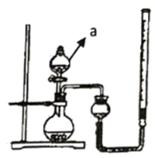
(1) A组为研究催化剂FeCl3的量对O2生成速率的影响,设计了如下三组实验方案(见下表),将表中所给的试剂按一定体积混合后进行反应。
| A | B | C |
10%H2O2/mL | 20.0 | V1 | V2 |
2 mol/LFeCl3/mL | 0 | 5.0 | 10.0 |
H2O/mL | V3 | V4 | 0 |
按要求回答下列问题:
①a装置的名称为
②若读数时发现,量气装置左端液面低于右端液面,则测得的气体体积
(2) B组在相同的温度下,利用下图甲装置对H2O2在不同条件下的分解速率进行了探究,得到乙曲线:
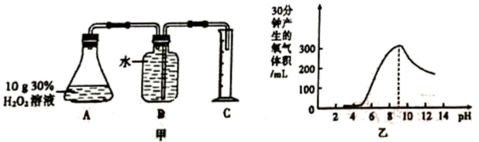
则B小组探究的是
(3)C小组利用如下装置探究100℃,H2O2在不同离子催化作用下反应24h的分解率,

实验编号 | 离子 | 加入量/(mg/L) | 分解率/% |
① | 无 | — | 2 |
② | Al3+ | 1.0 | 2 |
③ | Fe3+ | 1.0 | 15 |
④ | Cu2+ | 0.1 | 86 |
⑤ | Cr3+ | 0.1 | 96 |
则该小组实验时记录的数据应该是
(1)标准状况下,22.4LO2的质量为
(2)在MnO2存在下用H2O2为原料制备O2,反应的化学方程式为
(3) 已知H2O2不与CI-反应。为探究FeCl3在H2O2制取O2反应中的作用, 某兴趣小组进行下列实验:向试管中加入5mL 11 mol∙L−1H2O2溶液,静置几分钟,无明显现象;滴加2滴1 mol∙L−1FeCl3溶液,立即产生大量气泡。
①加FeCl3溶液反应20min后,H2O2的浓度变为10.5 mol∙L−1,则20min内H2O2的平均反应速率为
②反应结束后,滴加KSCN溶液,试管中溶液呈红色。经测定,溶液中Fe3+的量没有变化。综合以上实验,可推断出:在H2O2制O2反应中,FeCl3作
(4)实验完毕,在离开实验室之前,应该完成的事项有
 ,催化空气氧化
,催化空气氧化 的效率。回答下列问题:
的效率。回答下列问题:步骤Ⅰ 制备

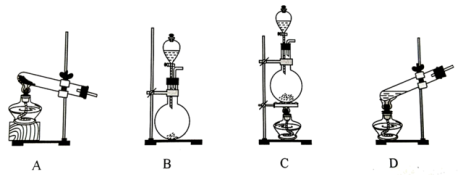
在通风橱中用下图装置制备
 (加热及夹持装置省略),反应方程式:
(加热及夹持装置省略),反应方程式: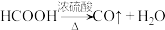

(1)装置A中盛放甲酸的仪器的名称是
(2)从B、C、D中选择合适的装置收集
 ,正确的接口连接顺序为a→_______→_______→_______→_______→h(每空填一个接口标号)。
,正确的接口连接顺序为a→_______→_______→_______→_______→h(每空填一个接口标号)。步骤Ⅱ 检验

将
 通入新制银氨溶液中,有黑色沉淀生成。
通入新制银氨溶液中,有黑色沉淀生成。(3)该反应的化学方程式为
步骤Ⅲ 探究
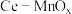 催化空气氧化
催化空气氧化 的效率
的效率将一定量
 与空气混合,得到
与空气混合,得到 体积分数为1%的气体样品。使用下图装置(部分加热及夹持装置省略),调节管式炉温度至
体积分数为1%的气体样品。使用下图装置(部分加热及夹持装置省略),调节管式炉温度至 ,按一定流速通入气体样品。(已知:
,按一定流速通入气体样品。(已知: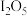 是白色固体,易吸水潮解:
是白色固体,易吸水潮解: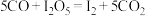 )
)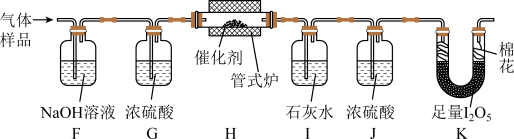
(4)通入
 (已折算为标况)的气体样品后,继续向装置内通入一段时间氮气,最终测得U形管内生成了
(已折算为标况)的气体样品后,继续向装置内通入一段时间氮气,最终测得U形管内生成了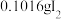 。
。①能证明
 被空气氧化的现象是
被空气氧化的现象是②
 被催化氧化的百分率为
被催化氧化的百分率为③若未通入氮气,②的结果将
(5)探究气体与催化剂接触时长对催化氧化效率的影响时,采用
(6)步骤Ⅲ装置存在的不足之处是
已知:25℃时,相关物质的Ksp见下表。氢氧化氧锰(MnOOH)难溶于水和碱性溶液。
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 | Co(OH)2 |
| Ksp | 1×10-16.3 | 1×10-38.6 | 1×10-32.3 | 1×10-12.7 | 1.09×10-15 |
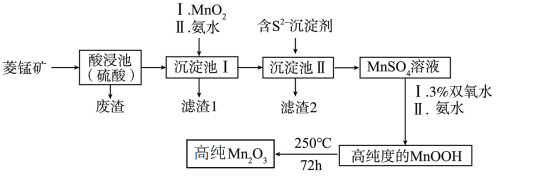
(1)为了提高酸浸速率,可采取的措施为
(2)向“沉淀池I”中加入MnO2的作用是
(3)“滤渣2”的主要成分是
(4)请写出MnSO4转化为MnOOH的离子方程式
(5)经过滤、洗涤、干燥等步骤可得高纯MnOOH。其中洗涤的具体操作为
(6)甲苯(用C7H8表示)是一种挥发性的大气污染物。Mn2O3可用作甲苯热催化氧化消除技术的催化剂。其装置及反应机理如图所示,下列说法中错误的是_______。

| A.反应Ⅱ的方程式为C7H8+36MnO2=7CO2+4H2O+18Mn2O3 |
| B.反应Ⅰ中Mn元素的化合价升高 |
| C.反应Ⅱ中O-H键的形成会吸收能量 |
| D.Mn2O3作催化剂可降低总反应C7H8(g)+9O2(g)=7CO2(g)+4H2O(g)的焓变 |




