名校
解题方法
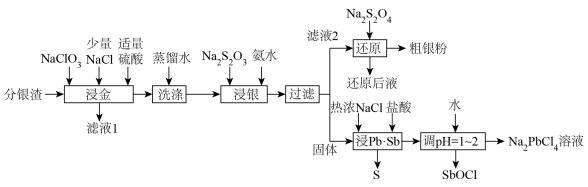
1 . 分银渣(主要成分为PbSO4、Sb2O3、AgCl、Ag2S、Au)是电解精炼铜的尾渣,具有较高的综合利用价值。一种提取流程如下:
2.Ksp(PbSO4)=2.53×10-8,Ksp(PbCl2)=1.70×10-5;
3.升高温度时,发生反应:Na2S2O3 S+Na2SO3。
S+Na2SO3。
回答下列问题:
(1)滤液1的主要成分为HAuCl4,该物质中金元素的化合价为___________ ,“浸金”过程中Ag2S转化为AgCl的离子方程式为__________
(2)“浸金”过程中加入适量硫酸,除防止Pb部分转化为PbCl2造成损失,还具有的作用是___________ ;
(3)“浸银”操作前先进行“洗涤”操作的目的是___________ ;
(4)“浸银”过程控制pH=8~10,温度50℃,发生反应:AgCl+2S2O
 [Ag(S2O3)2]3-+Cl-,“浸银”过程添加Na2SO3固体的作用是
[Ag(S2O3)2]3-+Cl-,“浸银”过程添加Na2SO3固体的作用是___________ ;
(5)“还原”过程中S2O 被氧化为SO
被氧化为SO 。还原后液可循环使用,应当将其导入到
。还原后液可循环使用,应当将其导入到___________ 操作中(填操作单元名称)。
(6)“浸Pb、Sb”过程中生成Na2PbCl4的化学方程式为___________ ,电解Na2PbCl4溶液制备金属单质Pb,装置如图,电路中通过0.2mole-时,阴极的质量增加___________ g。
2.Ksp(PbSO4)=2.53×10-8,Ksp(PbCl2)=1.70×10-5;
3.升高温度时,发生反应:Na2S2O3
 S+Na2SO3。
S+Na2SO3。回答下列问题:
(1)滤液1的主要成分为HAuCl4,该物质中金元素的化合价为
(2)“浸金”过程中加入适量硫酸,除防止Pb部分转化为PbCl2造成损失,还具有的作用是
(3)“浸银”操作前先进行“洗涤”操作的目的是
(4)“浸银”过程控制pH=8~10,温度50℃,发生反应:AgCl+2S2O

 [Ag(S2O3)2]3-+Cl-,“浸银”过程添加Na2SO3固体的作用是
[Ag(S2O3)2]3-+Cl-,“浸银”过程添加Na2SO3固体的作用是(5)“还原”过程中S2O
 被氧化为SO
被氧化为SO 。还原后液可循环使用,应当将其导入到
。还原后液可循环使用,应当将其导入到(6)“浸Pb、Sb”过程中生成Na2PbCl4的化学方程式为

您最近半年使用:0次
名校
解题方法
2 . 氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品。某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2·2H2O)。
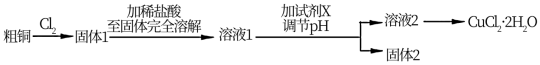
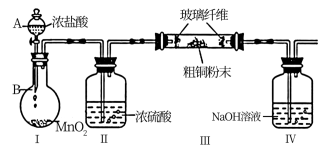
(1)实验室采用如下图所示的装置,可将粗铜与Cl2反应转化为固体1(部分仪器和夹持装置已略去)。
①仪器A的名称是____________ ;仪器B中发生的离子反应方程式为:____________
②实验开始前,需要做的操作是___________________ 。
③有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为_____ (填“是”或“否”)。原因___________ 。
(2)试剂X用于调节pH以除去杂质, X可选用下列试剂中的(填序号)________ 。
a.CuO b.CuSO4 c.Cu2(OH)2CO3 d.NH3·H2O e.Fe2O3 f.Fe
(3)若制备的氯化铜晶体经检验含有FeCl2,其原因可能是_______________ ,试提出改进方案:____________________
(4)在溶液2转化为CuCl2·2H2O的操作过程中,发现溶液颜色由蓝色变为绿色。小组同学欲探究其原因。已知:在氯化铜溶液中有如下转化关系:
Cu(H2O)42+(aq)+4Cl‾(aq)⇌CuCl42‾(aq)+4H2O(l)
蓝色 绿色
取氯化铜晶体配制成蓝绿色溶液Y,进行实验验证以上关系,下列实验中说法不正确的是________ (填序号)。
a.在Y中加入NaCl固体,溶液变为绿色
b.在Y中加入CuCl2晶体,溶液变为绿色
c.将Y加水稀释,发现溶液呈蓝色
d.取Y溶液用惰性电极进行电解,溶液颜色最终消失


(1)实验室采用如下图所示的装置,可将粗铜与Cl2反应转化为固体1(部分仪器和夹持装置已略去)。
①仪器A的名称是
②实验开始前,需要做的操作是
③有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为
(2)试剂X用于调节pH以除去杂质, X可选用下列试剂中的(填序号)
a.CuO b.CuSO4 c.Cu2(OH)2CO3 d.NH3·H2O e.Fe2O3 f.Fe
(3)若制备的氯化铜晶体经检验含有FeCl2,其原因可能是
(4)在溶液2转化为CuCl2·2H2O的操作过程中,发现溶液颜色由蓝色变为绿色。小组同学欲探究其原因。已知:在氯化铜溶液中有如下转化关系:
Cu(H2O)42+(aq)+4Cl‾(aq)⇌CuCl42‾(aq)+4H2O(l)
蓝色 绿色
取氯化铜晶体配制成蓝绿色溶液Y,进行实验验证以上关系,下列实验中说法不正确的是
a.在Y中加入NaCl固体,溶液变为绿色
b.在Y中加入CuCl2晶体,溶液变为绿色
c.将Y加水稀释,发现溶液呈蓝色
d.取Y溶液用惰性电极进行电解,溶液颜色最终消失
您最近半年使用:0次



