名校
1 . 重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO·Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3+7KCl+12H2O
12Na2CrO4+3Fe2O3+7KCl+12H2O

试回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:___________ 。
(2)操作③的目的是什么,用简要的文字说明:____________________________ 。
(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:_______ 。
(4)称取重铬酸钾试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)
①判断达到滴定终点的依据是:________________ ;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度(设整个过程中其它杂质不参与反应)____________ 。
 12Na2CrO4+3Fe2O3+7KCl+12H2O
12Na2CrO4+3Fe2O3+7KCl+12H2O
试回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:
(2)操作③的目的是什么,用简要的文字说明:
(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:
(4)称取重铬酸钾试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)
①判断达到滴定终点的依据是:
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度(设整个过程中其它杂质不参与反应)
您最近半年使用:0次
名校
解题方法
2 . 铅铬黄是一种颜料,主要成分是铬酸铅 (摩尔质量323g/mol)。现以
(摩尔质量323g/mol)。现以 和
和 等为原料制备该物质,并测定产物纯度。
等为原料制备该物质,并测定产物纯度。
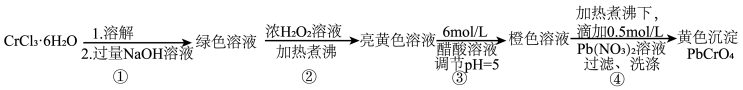
回答下列问题:
(1)已知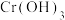 不溶于水,具有两性。第①步所得绿色溶液中的有色离子是
不溶于水,具有两性。第①步所得绿色溶液中的有色离子是_______ 。
(2)第②步生成了 ,写出该步骤的离子方程式
,写出该步骤的离子方程式_______ 。为了使 反应充分而不剩余,以下方案中最合理的是
反应充分而不剩余,以下方案中最合理的是_______ (填序号)。
A.首先加热绿色溶液,然后将一定量 浓溶液滴入其中
浓溶液滴入其中
B.首先加热 浓溶液,然后转入热的绿色溶液中
浓溶液,然后转入热的绿色溶液中
C.首先将一定量 浓溶液滴入绿色溶液中,然后加热煮沸
浓溶液滴入绿色溶液中,然后加热煮沸
(3)第③步调节pH=5的目的是为了将 转化为
转化为_______ (填写离子符号),并且防止在碱性条件下_______ 形成沉淀。
(4)由于铬酸铅的溶解度比重铬酸铅的小的多,在第④步中逐滴滴加 溶液后,产生
溶液后,产生 黄色沉淀,此时为了提高铅铬黄的产率,可补加少最NaOH溶液,请用化学平衡移动原理加以解释:
黄色沉淀,此时为了提高铅铬黄的产率,可补加少最NaOH溶液,请用化学平衡移动原理加以解释:_______ 。
(5)测定铅铬黄的纯度:取mg铅铭黄样品用盐酸酸化溶解,加足量KI将其还原为 ,再用
,再用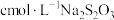 标准溶液滴定至淡黄绿色,发生反应
标准溶液滴定至淡黄绿色,发生反应 。加入淀粉指示剂,继续滴定,当溶液蓝色褪去,且30s不变色,即为终点。测得平均消耗标准溶液体积为VmL。此铅铬黄样品的质量分数w=
。加入淀粉指示剂,继续滴定,当溶液蓝色褪去,且30s不变色,即为终点。测得平均消耗标准溶液体积为VmL。此铅铬黄样品的质量分数w=_______ (用含c、m和V的式子表示)。
 (摩尔质量323g/mol)。现以
(摩尔质量323g/mol)。现以 和
和 等为原料制备该物质,并测定产物纯度。
等为原料制备该物质,并测定产物纯度。
回答下列问题:
(1)已知
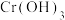 不溶于水,具有两性。第①步所得绿色溶液中的有色离子是
不溶于水,具有两性。第①步所得绿色溶液中的有色离子是(2)第②步生成了
 ,写出该步骤的离子方程式
,写出该步骤的离子方程式 反应充分而不剩余,以下方案中最合理的是
反应充分而不剩余,以下方案中最合理的是A.首先加热绿色溶液,然后将一定量
 浓溶液滴入其中
浓溶液滴入其中B.首先加热
 浓溶液,然后转入热的绿色溶液中
浓溶液,然后转入热的绿色溶液中C.首先将一定量
 浓溶液滴入绿色溶液中,然后加热煮沸
浓溶液滴入绿色溶液中,然后加热煮沸(3)第③步调节pH=5的目的是为了将
 转化为
转化为(4)由于铬酸铅的溶解度比重铬酸铅的小的多,在第④步中逐滴滴加
 溶液后,产生
溶液后,产生 黄色沉淀,此时为了提高铅铬黄的产率,可补加少最NaOH溶液,请用化学平衡移动原理加以解释:
黄色沉淀,此时为了提高铅铬黄的产率,可补加少最NaOH溶液,请用化学平衡移动原理加以解释:(5)测定铅铬黄的纯度:取mg铅铭黄样品用盐酸酸化溶解,加足量KI将其还原为
 ,再用
,再用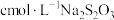 标准溶液滴定至淡黄绿色,发生反应
标准溶液滴定至淡黄绿色,发生反应 。加入淀粉指示剂,继续滴定,当溶液蓝色褪去,且30s不变色,即为终点。测得平均消耗标准溶液体积为VmL。此铅铬黄样品的质量分数w=
。加入淀粉指示剂,继续滴定,当溶液蓝色褪去,且30s不变色,即为终点。测得平均消耗标准溶液体积为VmL。此铅铬黄样品的质量分数w=
您最近半年使用:0次
2022-08-30更新
|
242次组卷
|
2卷引用:四川省成都市第七中学2023届高三上学期入学考试化学试题
3 . 镀镍废水是重金属污染源之一,常见处理含镍废水的一种离子交换和沉淀法工艺如下:
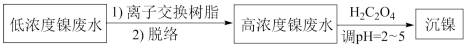
已知该交换树脂为阳离子型树脂HR,HR R-+H+;NiR2(aq)
R-+H+;NiR2(aq) Ni2+(aq)+2R-(aq)。
Ni2+(aq)+2R-(aq)。
(1)Ni2+的核外电子排布式为___________ 。
(2)已知在pH=2时,离子交换过程Ni2+去除率很低,其原因为_______ 。
(3)“脱络”(指镍元素由络合物NiR2转化成游离的Ni2+)过程中,R-与中间产物·OH(羟基自由基)反应生成难以与Ni2+络合的·R(有机物自由基),但·OH也能与H2O2发生反应。反应的方程式如下:
Ⅰ.Fe2++H2O2=Fe3++OH-+·OH
Ⅱ.R-+·OH=OH-+·R
平衡移动的角度解释加入FeSO4和H2O2能够实现“脱络”的原因是___________ 。
(4)NiC2O4隔绝空气高温煅烧可制得Ni2O3,NiC2O4受热分解的化学方程式为___________ 。
(5)硫酸镍铵(NH4)xNiy(SO4)m·nH2O可用于电镀等领域,为测定其组成,进行如下实验:
①称取4.670样品,配成250mL溶液A。
②取25.00mL溶液A,加足量浓NaOH溶液并加热,生成NH3 44.80mL (标准状况)。
③另取25.00mL溶液A,用0.05000mol/L的EDTA(Na2H2Y)标准溶液滴定其中的Ni2+(离子方程式为Ni2++H2Y2-=NiY2-+2H+),平行测定三次,平均消耗标准EDTA溶液20.00mL。
则硫酸镍铵的化学式为___________ (写出计算过程)。

已知该交换树脂为阳离子型树脂HR,HR
 R-+H+;NiR2(aq)
R-+H+;NiR2(aq) Ni2+(aq)+2R-(aq)。
Ni2+(aq)+2R-(aq)。(1)Ni2+的核外电子排布式为
(2)已知在pH=2时,离子交换过程Ni2+去除率很低,其原因为
(3)“脱络”(指镍元素由络合物NiR2转化成游离的Ni2+)过程中,R-与中间产物·OH(羟基自由基)反应生成难以与Ni2+络合的·R(有机物自由基),但·OH也能与H2O2发生反应。反应的方程式如下:
Ⅰ.Fe2++H2O2=Fe3++OH-+·OH
Ⅱ.R-+·OH=OH-+·R
平衡移动的角度解释加入FeSO4和H2O2能够实现“脱络”的原因是
(4)NiC2O4隔绝空气高温煅烧可制得Ni2O3,NiC2O4受热分解的化学方程式为
(5)硫酸镍铵(NH4)xNiy(SO4)m·nH2O可用于电镀等领域,为测定其组成,进行如下实验:
①称取4.670样品,配成250mL溶液A。
②取25.00mL溶液A,加足量浓NaOH溶液并加热,生成NH3 44.80mL (标准状况)。
③另取25.00mL溶液A,用0.05000mol/L的EDTA(Na2H2Y)标准溶液滴定其中的Ni2+(离子方程式为Ni2++H2Y2-=NiY2-+2H+),平行测定三次,平均消耗标准EDTA溶液20.00mL。
则硫酸镍铵的化学式为
您最近半年使用:0次



