解题方法
1 . 为达到下列实验目的,对应的操作及原理均正确的是
| 选项 | 实验目的 | 操作 | 原理 |
| A. | 分离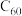 与 与 | 向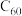 与 与 的混合物中加入与 的混合物中加入与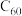 适配的杯酚,再加入甲苯溶解 适配的杯酚,再加入甲苯溶解 ,过滤,滤液中加入氯仿溶解杯酚 ,过滤,滤液中加入氯仿溶解杯酚 | 杯酚与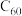 形成超分子,通过尺寸匹配实现分子识别 形成超分子,通过尺寸匹配实现分子识别 |
| B. | 检验硫代硫酸钠中是否混有亚硫酸钠 | 取样,加入稀盐酸,将生成的气体通入品红溶液 | 亚硫酸钠与盐酸反应生成的二氧化硫能使品红溶液褪色 |
| C. | 检验乙醇中是否混有乙醛 | 取待测液,加入酸性高锰酸钾溶液 | 醛基能被酸性高锰酸钾氧化 |
| D. | 探究浓度对化学平衡移动的影响 | 将5mL0.005mol/L的 溶液与5mL0.015mol/L的 溶液与5mL0.015mol/L的 溶液混合,再加 溶液混合,再加 固体 固体 | 在其他条件不变的情况下,增大生成物浓度,平衡向逆反应方向移动 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
2 . 金属镍广泛应用于制造记忆合金、储氢合金以及用作加氢反应的催化剂,是重要的战略物资,但资源匮乏。从某废镍渣(含NiFe2O4、NiO、 FeO、 Al2O3)中回收镍并转化为NiSO4的流程如图所示: 
回答下列问题:
(1)“碱浸”时发生反应的离子方程式为___________ 。
(2)“焙烧” 后金属元素以硫酸盐的形式存在,写出NiO与(NH4)2SO4反应的化学方程式___________ 。
(3)使用95℃热水“溶解”后过滤,所得滤渣的主要成分的化学式是___________ 。
(4)①“萃取”时发生反应Mn+ + nRH MRn+ nH+ (Mn+为金属离子,RH为萃取剂),萃取率与
MRn+ nH+ (Mn+为金属离子,RH为萃取剂),萃取率与 的关系如下表所示,当
的关系如下表所示,当 =0.25时,水层中主要的阳离子为
=0.25时,水层中主要的阳离子为___________ 。
②物质X的化学式为___________ 。
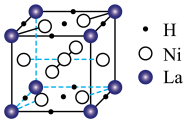
(5)镧镍合金储氢后的晶胞如图所示,该化合物中原子个数比N([La) : N(Ni) : N(H)=___________ 。
(6)Ni2+与丁二酮肟可形成鲜红色的二丁二酮肟合镍(M= 289 g·mol-1),结构如下图所示。

144.5g二丁二酮肟合镍分子内含有σ键___________ mol,碳碳键是由___________ 轨道重叠形成的。
a. sp3和sp2 b. sp2和 sp2 c. sp2和p d. sp3和p

回答下列问题:
(1)“碱浸”时发生反应的离子方程式为
(2)“焙烧” 后金属元素以硫酸盐的形式存在,写出NiO与(NH4)2SO4反应的化学方程式
(3)使用95℃热水“溶解”后过滤,所得滤渣的主要成分的化学式是
(4)①“萃取”时发生反应Mn+ + nRH
 MRn+ nH+ (Mn+为金属离子,RH为萃取剂),萃取率与
MRn+ nH+ (Mn+为金属离子,RH为萃取剂),萃取率与 的关系如下表所示,当
的关系如下表所示,当 =0.25时,水层中主要的阳离子为
=0.25时,水层中主要的阳离子为 萃取率/% | 0.1 | 0.15 | 0.2 | 0.25 | 0.3 | 0.35 | 0.4 |
| Ni2+ | 55% | 68% | 80% | 99% | 99.5% | 99.8% | 99.9% |
| Fe2+ | 2% | 2% | 4% | 5% | 8% | 30% | 58% |
(5)镧镍合金储氢后的晶胞如图所示,该化合物中原子个数比N([La) : N(Ni) : N(H)=

(6)Ni2+与丁二酮肟可形成鲜红色的二丁二酮肟合镍(M= 289 g·mol-1),结构如下图所示。

144.5g二丁二酮肟合镍分子内含有σ键
a. sp3和sp2 b. sp2和 sp2 c. sp2和p d. sp3和p
您最近一年使用:0次
2023-03-18更新
|
627次组卷
|
2卷引用:云南省昆明市2023届高三三诊一模理科综合化学试题
3 . 为充分利用金属资源,某研究团队利用生产钴电极材料生的铜锰渣(含 、
、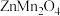 、
、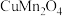 等物质)回收金属
等物质)回收金属 的一种流程如图所示:
的一种流程如图所示:
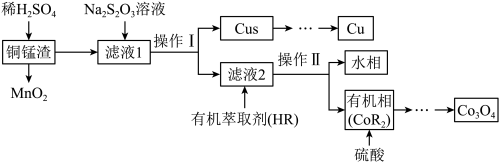
回答下列问题:
(1)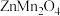 、
、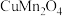 中Mn元素的化合价为
中Mn元素的化合价为___________ .
(2)写出铜锰渣中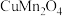 与稀硫酸反应的化学方程式
与稀硫酸反应的化学方程式_____________ .
(3)研究团队认为该工艺可能利用了如下反应原理沉淀滤液1中的Cu2+: ,
,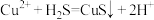 .析出的Cu沉淀中还混有少量的S单质,原因是
.析出的Cu沉淀中还混有少量的S单质,原因是__________ (用离子方程式解释).
(4)依据反应 萃取滤液2中的
萃取滤液2中的 并进行操作Ⅱ,操作Ⅱ的名称是
并进行操作Ⅱ,操作Ⅱ的名称是________ ;所得有机相中加入硫酸能进行反萃取的原因是________________________ (结合平衡移动原理解释).
(5)控制反应温度为 ,向滤液1中加入
,向滤液1中加入 溶液,不同金属沉淀率与
溶液,不同金属沉淀率与 用量倍数的关系如下图所示.
用量倍数的关系如下图所示.
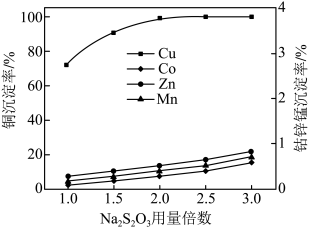
当 用量倍数为2.0时,水相中的金属阳离子主要含
用量倍数为2.0时,水相中的金属阳离子主要含 、
、_________ (填离子符号).
(6) 用作电池材料,使用KOH溶液作电解液,充电时
用作电池材料,使用KOH溶液作电解液,充电时 转化为
转化为 的电极反应式为
的电极反应式为____________________ .
 、
、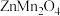 、
、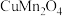 等物质)回收金属
等物质)回收金属 的一种流程如图所示:
的一种流程如图所示:
回答下列问题:
(1)
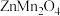 、
、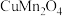 中Mn元素的化合价为
中Mn元素的化合价为(2)写出铜锰渣中
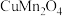 与稀硫酸反应的化学方程式
与稀硫酸反应的化学方程式(3)研究团队认为该工艺可能利用了如下反应原理沉淀滤液1中的Cu2+:
 ,
,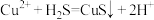 .析出的Cu沉淀中还混有少量的S单质,原因是
.析出的Cu沉淀中还混有少量的S单质,原因是(4)依据反应
 萃取滤液2中的
萃取滤液2中的 并进行操作Ⅱ,操作Ⅱ的名称是
并进行操作Ⅱ,操作Ⅱ的名称是(5)控制反应温度为
 ,向滤液1中加入
,向滤液1中加入 溶液,不同金属沉淀率与
溶液,不同金属沉淀率与 用量倍数的关系如下图所示.
用量倍数的关系如下图所示.
当
 用量倍数为2.0时,水相中的金属阳离子主要含
用量倍数为2.0时,水相中的金属阳离子主要含 、
、(6)
 用作电池材料,使用KOH溶液作电解液,充电时
用作电池材料,使用KOH溶液作电解液,充电时 转化为
转化为 的电极反应式为
的电极反应式为
您最近一年使用:0次



