解题方法
1 . 为达到下列实验目的,对应的操作及原理均正确的是
| 选项 | 实验目的 | 操作 | 原理 |
| A. | 分离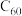 与 与 | 向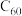 与 与 的混合物中加入与 的混合物中加入与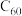 适配的杯酚,再加入甲苯溶解 适配的杯酚,再加入甲苯溶解 ,过滤,滤液中加入氯仿溶解杯酚 ,过滤,滤液中加入氯仿溶解杯酚 | 杯酚与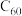 形成超分子,通过尺寸匹配实现分子识别 形成超分子,通过尺寸匹配实现分子识别 |
| B. | 检验硫代硫酸钠中是否混有亚硫酸钠 | 取样,加入稀盐酸,将生成的气体通入品红溶液 | 亚硫酸钠与盐酸反应生成的二氧化硫能使品红溶液褪色 |
| C. | 检验乙醇中是否混有乙醛 | 取待测液,加入酸性高锰酸钾溶液 | 醛基能被酸性高锰酸钾氧化 |
| D. | 探究浓度对化学平衡移动的影响 | 将5mL0.005mol/L的 溶液与5mL0.015mol/L的 溶液与5mL0.015mol/L的 溶液混合,再加 溶液混合,再加 固体 固体 | 在其他条件不变的情况下,增大生成物浓度,平衡向逆反应方向移动 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
解题方法
2 . 金属镍广泛应用于制造记忆合金、储氢合金以及用作加氢反应的催化剂,是重要的战略物资,但资源匮乏。从某废镍渣(含NiFe2O4、NiO、 FeO、 Al2O3)中回收镍并转化为NiSO4的流程如图所示: 
回答下列问题:
(1)“碱浸”时发生反应的离子方程式为___________ 。
(2)“焙烧” 后金属元素以硫酸盐的形式存在,写出NiO与(NH4)2SO4反应的化学方程式___________ 。
(3)使用95℃热水“溶解”后过滤,所得滤渣的主要成分的化学式是___________ 。
(4)①“萃取”时发生反应Mn+ + nRH MRn+ nH+ (Mn+为金属离子,RH为萃取剂),萃取率与
MRn+ nH+ (Mn+为金属离子,RH为萃取剂),萃取率与 的关系如下表所示,当
的关系如下表所示,当 =0.25时,水层中主要的阳离子为
=0.25时,水层中主要的阳离子为___________ 。
②物质X的化学式为___________ 。
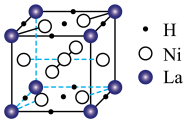
(5)镧镍合金储氢后的晶胞如图所示,该化合物中原子个数比N([La) : N(Ni) : N(H)=___________ 。
(6)Ni2+与丁二酮肟可形成鲜红色的二丁二酮肟合镍(M= 289 g·mol-1),结构如下图所示。

144.5g二丁二酮肟合镍分子内含有σ键___________ mol,碳碳键是由___________ 轨道重叠形成的。
a. sp3和sp2 b. sp2和 sp2 c. sp2和p d. sp3和p

回答下列问题:
(1)“碱浸”时发生反应的离子方程式为
(2)“焙烧” 后金属元素以硫酸盐的形式存在,写出NiO与(NH4)2SO4反应的化学方程式
(3)使用95℃热水“溶解”后过滤,所得滤渣的主要成分的化学式是
(4)①“萃取”时发生反应Mn+ + nRH
 MRn+ nH+ (Mn+为金属离子,RH为萃取剂),萃取率与
MRn+ nH+ (Mn+为金属离子,RH为萃取剂),萃取率与 的关系如下表所示,当
的关系如下表所示,当 =0.25时,水层中主要的阳离子为
=0.25时,水层中主要的阳离子为 萃取率/% | 0.1 | 0.15 | 0.2 | 0.25 | 0.3 | 0.35 | 0.4 |
| Ni2+ | 55% | 68% | 80% | 99% | 99.5% | 99.8% | 99.9% |
| Fe2+ | 2% | 2% | 4% | 5% | 8% | 30% | 58% |
(5)镧镍合金储氢后的晶胞如图所示,该化合物中原子个数比N([La) : N(Ni) : N(H)=

(6)Ni2+与丁二酮肟可形成鲜红色的二丁二酮肟合镍(M= 289 g·mol-1),结构如下图所示。

144.5g二丁二酮肟合镍分子内含有σ键
a. sp3和sp2 b. sp2和 sp2 c. sp2和p d. sp3和p
您最近半年使用:0次
2023-03-18更新
|
621次组卷
|
2卷引用:云南省昆明市2023届高三三诊一模理科综合化学试题
3 . 为充分利用金属资源,某研究团队利用生产钴电极材料生的铜锰渣(含 、
、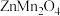 、
、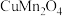 等物质)回收金属
等物质)回收金属 的一种流程如图所示:
的一种流程如图所示:
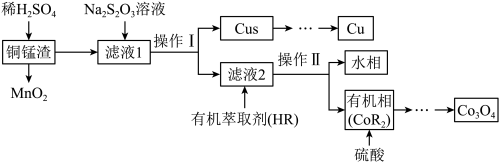
回答下列问题:
(1)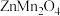 、
、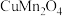 中Mn元素的化合价为
中Mn元素的化合价为___________ .
(2)写出铜锰渣中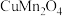 与稀硫酸反应的化学方程式
与稀硫酸反应的化学方程式_____________ .
(3)研究团队认为该工艺可能利用了如下反应原理沉淀滤液1中的Cu2+: ,
,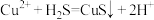 .析出的Cu沉淀中还混有少量的S单质,原因是
.析出的Cu沉淀中还混有少量的S单质,原因是__________ (用离子方程式解释).
(4)依据反应 萃取滤液2中的
萃取滤液2中的 并进行操作Ⅱ,操作Ⅱ的名称是
并进行操作Ⅱ,操作Ⅱ的名称是________ ;所得有机相中加入硫酸能进行反萃取的原因是________________________ (结合平衡移动原理解释).
(5)控制反应温度为 ,向滤液1中加入
,向滤液1中加入 溶液,不同金属沉淀率与
溶液,不同金属沉淀率与 用量倍数的关系如下图所示.
用量倍数的关系如下图所示.
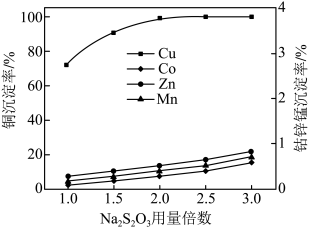
当 用量倍数为2.0时,水相中的金属阳离子主要含
用量倍数为2.0时,水相中的金属阳离子主要含 、
、_________ (填离子符号).
(6) 用作电池材料,使用KOH溶液作电解液,充电时
用作电池材料,使用KOH溶液作电解液,充电时 转化为
转化为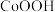 的电极反应式为
的电极反应式为____________________ .
 、
、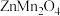 、
、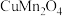 等物质)回收金属
等物质)回收金属 的一种流程如图所示:
的一种流程如图所示:
回答下列问题:
(1)
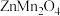 、
、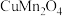 中Mn元素的化合价为
中Mn元素的化合价为(2)写出铜锰渣中
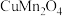 与稀硫酸反应的化学方程式
与稀硫酸反应的化学方程式(3)研究团队认为该工艺可能利用了如下反应原理沉淀滤液1中的Cu2+:
 ,
,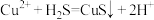 .析出的Cu沉淀中还混有少量的S单质,原因是
.析出的Cu沉淀中还混有少量的S单质,原因是(4)依据反应
 萃取滤液2中的
萃取滤液2中的 并进行操作Ⅱ,操作Ⅱ的名称是
并进行操作Ⅱ,操作Ⅱ的名称是(5)控制反应温度为
 ,向滤液1中加入
,向滤液1中加入 溶液,不同金属沉淀率与
溶液,不同金属沉淀率与 用量倍数的关系如下图所示.
用量倍数的关系如下图所示.
当
 用量倍数为2.0时,水相中的金属阳离子主要含
用量倍数为2.0时,水相中的金属阳离子主要含 、
、(6)
 用作电池材料,使用KOH溶液作电解液,充电时
用作电池材料,使用KOH溶液作电解液,充电时 转化为
转化为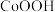 的电极反应式为
的电极反应式为
您最近半年使用:0次
2010·云南·一模
名校
4 . 下列说法中,能说明化学平衡一定向正反应方向移动的是
A.N2O4(g) 2NO2(g),改变某一条件后,气体颜色加深 2NO2(g),改变某一条件后,气体颜色加深 |
B.N2(g) + 3H2(g)  2NH3(g),改变某一条件后,NH3的体积分数增加 2NH3(g),改变某一条件后,NH3的体积分数增加 |
C.H2(g) + I2(g)  2HI(g),单位时间内消耗H2和HI的物质的量之比大于1∶2 2HI(g),单位时间内消耗H2和HI的物质的量之比大于1∶2 |
D.2SO2(g) + O2(g)  2SO3(g),恒温恒容充入He 2SO3(g),恒温恒容充入He |
您最近半年使用:0次
2017-06-13更新
|
205次组卷
|
6卷引用:2010年云南省部分名校高三5月联考试题理科综合化学
(已下线)2010年云南省部分名校高三5月联考试题理科综合化学(已下线)2011届湖北省天门市高三模拟考试(一)(理综)化学部分(已下线)2010-2011学年河北省衡水中学高一下学期期末考试化学试卷(已下线)2010—2011学年度本溪市第一中学高一下学期期末考试化学试卷河南省南阳市第一中学校2016-2017学年高二下学期第三次月考化学试题河南省南阳市第一中学2016-2017学年高二下学期第三次月考化学试题
2011·云南昆明·一模
5 . 一定温度下,1 molX和n mol Y在体积为2L的密闭容器中发生如下反应:X(g)+Y(g) 2Z(g)+M(s),5min后达到平衡,此时生成2a mol Z.下列说法正确的是( )
2Z(g)+M(s),5min后达到平衡,此时生成2a mol Z.下列说法正确的是( )
 2Z(g)+M(s),5min后达到平衡,此时生成2a mol Z.下列说法正确的是( )
2Z(g)+M(s),5min后达到平衡,此时生成2a mol Z.下列说法正确的是( )| A.用X表示此反应的反应速率是(0.1-0.2a)mol•(L•min)-1 |
| B.当混合气体的质量不再发生变化时,说明反应达到平衡状态 |
| C.向平衡后的体系中加入1mol M,平衡向逆反应方向移动 |
| D.向上述平衡体系中再充入1mol X,v(正)增大,v(逆)减小,平衡正向移动 |
您最近半年使用:0次



