名校
1 . 利用CO2合成二甲醚的原理为2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) ∆H,其中投料比
CH3OCH3(g)+3H2O(g) ∆H,其中投料比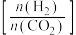 (取值为2、3、4)和温度与CO2的平衡转化率的关系如图所示
(取值为2、3、4)和温度与CO2的平衡转化率的关系如图所示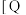 点c(CO2)= 0.2mol·L-1。下列说法正确的是
点c(CO2)= 0.2mol·L-1。下列说法正确的是
 CH3OCH3(g)+3H2O(g) ∆H,其中投料比
CH3OCH3(g)+3H2O(g) ∆H,其中投料比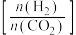 (取值为2、3、4)和温度与CO2的平衡转化率的关系如图所示
(取值为2、3、4)和温度与CO2的平衡转化率的关系如图所示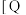 点c(CO2)= 0.2mol·L-1。下列说法正确的是
点c(CO2)= 0.2mol·L-1。下列说法正确的是
| A.T1K时,Kc=0.0675 | B.△H>0 |
C.X表示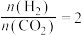 | D.催化剂可以改变CO2的平衡转化率 |
您最近半年使用:0次
名校
解题方法
2 . 相变离子液体体系因节能潜力大被认为是新一代 吸收剂,某新型相变离子液体X吸收
吸收剂,某新型相变离子液体X吸收 的过程如图,已知X的阴离子中所有原子共平面,下列说法错误的是
的过程如图,已知X的阴离子中所有原子共平面,下列说法错误的是
 吸收剂,某新型相变离子液体X吸收
吸收剂,某新型相变离子液体X吸收 的过程如图,已知X的阴离子中所有原子共平面,下列说法错误的是
的过程如图,已知X的阴离子中所有原子共平面,下列说法错误的是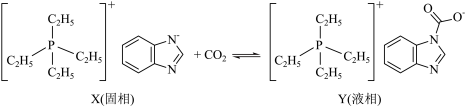
| A.X的阳离子中所有原子(除H外)均达到最外层8电子稳定状态 |
B.真空条件下有利于Y解析出 |
| C.X的阴离子中所有N均提供2个电子参与大π键的形成 |
| D.Y的熔点比X的低,可推知阴离子半径:Y>X |
您最近半年使用:0次
7日内更新
|
251次组卷
|
2卷引用:湖南省长沙市湖南师范大学附属中学2024届高三下学期模拟试卷(一) 化学试题
名校
3 . 某温度下,向VL恒容密闭容器中通入4molX(g),发生反应:① ,②
,② 。反应体系中X、Y、Z的物质的量随时间t的变化曲线如图所示。下列说法错误的是
。反应体系中X、Y、Z的物质的量随时间t的变化曲线如图所示。下列说法错误的是
 ,②
,② 。反应体系中X、Y、Z的物质的量随时间t的变化曲线如图所示。下列说法错误的是
。反应体系中X、Y、Z的物质的量随时间t的变化曲线如图所示。下列说法错误的是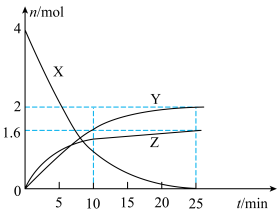
| A.25min时,生成了3.2molM |
B.0~10min内,气体X的平均反应速率为 |
C.该温度下,反应②的平衡常数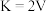 |
| D.25min时保持其他条件不变,再向体系中通入1molY(g)后,反应②的平衡不移动 |
您最近半年使用:0次
4 . 利用含钴废料(主要成分为 、
、 、
、 、
、 以及
以及 、
、 等)制备碳酸钴和硫酸镍晶体的一种工艺流程如图所示:
等)制备碳酸钴和硫酸镍晶体的一种工艺流程如图所示: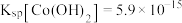 ;
;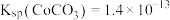 。
。
请回答下列问题:
(1)“碱浸”时所得滤液中溶质的主要成分为 和
和___________ 。“酸浸”时 发生反应的总离子方程式为
发生反应的总离子方程式为___________ 。
(2)“萃取”时 萃取的反应原理如下:
萃取的反应原理如下: (有机层)
(有机层)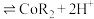 ,若萃取剂的量一定时,
,若萃取剂的量一定时,___________ (填“一次萃取”或“少量多次萃取”)的萃取效率更高。若“酸浸”后浸出液的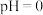 ,
, ,萃取完成后水相中
,萃取完成后水相中 为
为 ,则钴的萃取率为
,则钴的萃取率为___________ (结果保留一位小数,溶液体积变化忽略不计)。
(3)“沉锰”时, 转化为
转化为 ,则“沉锰”时发生反应的离子方程式为
,则“沉锰”时发生反应的离子方程式为___________ 。
(4)可以通过电解 溶液获得单质
溶液获得单质 和较浓的盐酸,其工作原理如图所示,其中膜a和膜b中,属于阳离子交换膜的是
和较浓的盐酸,其工作原理如图所示,其中膜a和膜b中,属于阳离子交换膜的是___________ 。若Ⅱ室溶液中溶质的质量增加了 ,则理论上获得的单质
,则理论上获得的单质 的质量为
的质量为___________ 。
 、
、 、
、 、
、 以及
以及 、
、 等)制备碳酸钴和硫酸镍晶体的一种工艺流程如图所示:
等)制备碳酸钴和硫酸镍晶体的一种工艺流程如图所示: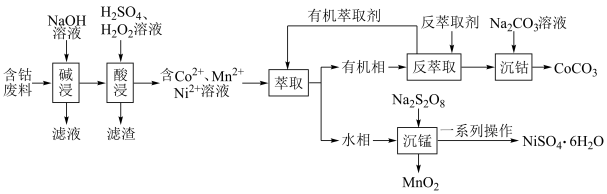
 ;
; 。
。请回答下列问题:
(1)“碱浸”时所得滤液中溶质的主要成分为
 和
和 发生反应的总离子方程式为
发生反应的总离子方程式为(2)“萃取”时
 萃取的反应原理如下:
萃取的反应原理如下: (有机层)
(有机层)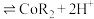 ,若萃取剂的量一定时,
,若萃取剂的量一定时, ,
, ,萃取完成后水相中
,萃取完成后水相中 为
为 ,则钴的萃取率为
,则钴的萃取率为(3)“沉锰”时,
 转化为
转化为 ,则“沉锰”时发生反应的离子方程式为
,则“沉锰”时发生反应的离子方程式为(4)可以通过电解
 溶液获得单质
溶液获得单质 和较浓的盐酸,其工作原理如图所示,其中膜a和膜b中,属于阳离子交换膜的是
和较浓的盐酸,其工作原理如图所示,其中膜a和膜b中,属于阳离子交换膜的是 ,则理论上获得的单质
,则理论上获得的单质 的质量为
的质量为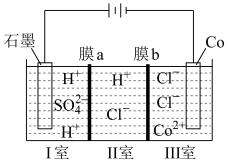
您最近半年使用:0次
名校
解题方法
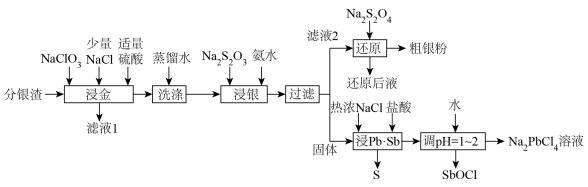
5 . 分银渣(主要成分为PbSO4、Sb2O3、AgCl、Ag2S、Au)是电解精炼铜的尾渣,具有较高的综合利用价值。一种提取流程如下:
2.Ksp(PbSO4)=2.53×10-8,Ksp(PbCl2)=1.70×10-5;
3.升高温度时,发生反应:Na2S2O3 S+Na2SO3。
S+Na2SO3。
回答下列问题:
(1)滤液1的主要成分为HAuCl4,该物质中金元素的化合价为___________ ,“浸金”过程中Ag2S转化为AgCl的离子方程式为__________
(2)“浸金”过程中加入适量硫酸,除防止Pb部分转化为PbCl2造成损失,还具有的作用是___________ ;
(3)“浸银”操作前先进行“洗涤”操作的目的是___________ ;
(4)“浸银”过程控制pH=8~10,温度50℃,发生反应:AgCl+2S2O
 [Ag(S2O3)2]3-+Cl-,“浸银”过程添加Na2SO3固体的作用是
[Ag(S2O3)2]3-+Cl-,“浸银”过程添加Na2SO3固体的作用是___________ ;
(5)“还原”过程中S2O 被氧化为SO
被氧化为SO 。还原后液可循环使用,应当将其导入到
。还原后液可循环使用,应当将其导入到___________ 操作中(填操作单元名称)。
(6)“浸Pb、Sb”过程中生成Na2PbCl4的化学方程式为___________ ,电解Na2PbCl4溶液制备金属单质Pb,装置如图,电路中通过0.2mole-时,阴极的质量增加___________ g。
2.Ksp(PbSO4)=2.53×10-8,Ksp(PbCl2)=1.70×10-5;
3.升高温度时,发生反应:Na2S2O3
 S+Na2SO3。
S+Na2SO3。回答下列问题:
(1)滤液1的主要成分为HAuCl4,该物质中金元素的化合价为
(2)“浸金”过程中加入适量硫酸,除防止Pb部分转化为PbCl2造成损失,还具有的作用是
(3)“浸银”操作前先进行“洗涤”操作的目的是
(4)“浸银”过程控制pH=8~10,温度50℃,发生反应:AgCl+2S2O

 [Ag(S2O3)2]3-+Cl-,“浸银”过程添加Na2SO3固体的作用是
[Ag(S2O3)2]3-+Cl-,“浸银”过程添加Na2SO3固体的作用是(5)“还原”过程中S2O
 被氧化为SO
被氧化为SO 。还原后液可循环使用,应当将其导入到
。还原后液可循环使用,应当将其导入到(6)“浸Pb、Sb”过程中生成Na2PbCl4的化学方程式为

您最近半年使用:0次
6 . CH3CHO在NaOH溶液作用下制取2-丁烯醛的历程如下: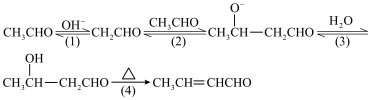
下列说法
| A.OH-是该反应的催化剂 |
B.CH3CHO分子中甲基上的“ ”比 ”比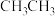 中的“ 中的“ ”更易电离出H+ ”更易电离出H+ |
| C.反应(4)加热失水有利于反应(3)平衡正向移动 |
| D.CH3CHO与CH3CH2CHO的混合液在NaOH溶液作用下最多可得到2种羟基醛 |
您最近半年使用:0次
7 . 氮及其化合物在工农业生产、生活中有着重要作用。
1.下列元素中电负性最大的是____。
2.NH3和PH3都具有四面体结构,NH3比PH3的分解温度高的原因是____。
3.配合物Ni(CO)4也具有四面体结构,常温下Ni(CO)4为液态,易溶于CCl4、苯等有机溶剂。写出基态Ni的电子排布式____ ;Ni(CO)4属于____ 晶体。
4.Zn(NH3)42+离子也具有四面体结构,Zn2+可提供4个能量最低的空轨道与NH3参与形成配位键,这4个空轨道是____。
氨在某催化剂作用下只发生如下反应:
主反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H =-905kJ/mol
4NO(g)+6H2O(g) △H =-905kJ/mol
副反应:4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H =-1268kJ/mol
2N2(g)+6H2O(g) △H =-1268kJ/mol
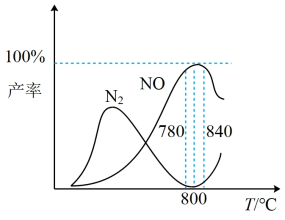
有关物质产率与温度的关系如图。_________ 。
6.工业上采用物料比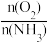 在1.7~2.0,主要目的是:
在1.7~2.0,主要目的是:______________ 。
7.下列说法正确的是______________ 。
A. 工业上进行氨催化氧化生成NO时,温度应控制在780~840℃之间
B. 在加压条件下生产能力可提高5~6倍,是因为加压可提高转化率
C. 选择合适的催化剂,可以大幅度提高NO在最终产物中的比率
8.一定温度下,在3.0L密闭容器中,通入0.10molCH4和0.20molNO2进行反应,CH4(g)+2NO2(g) CO2(g)+N2(g)+2H2O(g) △H <0,反应时间(t)与容器内气体总压强(p)的数据见下表:
CO2(g)+N2(g)+2H2O(g) △H <0,反应时间(t)与容器内气体总压强(p)的数据见下表:
表中数据计算0~4min内υ(NO2)=_________ 。
9.在一恒容密闭容器中,通入一定量CH4和NO2,测得在相同时间内,在不同温度下,NO2的转化率 [α(NO2)/%] 如下图;c点___ (填“是”或“不是”)反应达平衡的点。d点之后,转化率随温度升高而降低的原因是___ 。
1.下列元素中电负性最大的是____。
| A.N | B.P | C.Si | D.C |
| A.NH3分子间有氢键 | B.NH3分子极性强 |
| C.N-H键键能大于P-H键 | D.氨极易液化 |
4.Zn(NH3)42+离子也具有四面体结构,Zn2+可提供4个能量最低的空轨道与NH3参与形成配位键,这4个空轨道是____。
| A.3p | B.3d | C.4s | D.4p |
氨在某催化剂作用下只发生如下反应:
主反应:4NH3(g)+5O2(g)
 4NO(g)+6H2O(g) △H =-905kJ/mol
4NO(g)+6H2O(g) △H =-905kJ/mol副反应:4NH3(g)+3O2(g)
 2N2(g)+6H2O(g) △H =-1268kJ/mol
2N2(g)+6H2O(g) △H =-1268kJ/mol有关物质产率与温度的关系如图。
6.工业上采用物料比
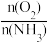 在1.7~2.0,主要目的是:
在1.7~2.0,主要目的是:7.下列说法正确的是
A. 工业上进行氨催化氧化生成NO时,温度应控制在780~840℃之间
B. 在加压条件下生产能力可提高5~6倍,是因为加压可提高转化率
C. 选择合适的催化剂,可以大幅度提高NO在最终产物中的比率
8.一定温度下,在3.0L密闭容器中,通入0.10molCH4和0.20molNO2进行反应,CH4(g)+2NO2(g)
 CO2(g)+N2(g)+2H2O(g) △H <0,反应时间(t)与容器内气体总压强(p)的数据见下表:
CO2(g)+N2(g)+2H2O(g) △H <0,反应时间(t)与容器内气体总压强(p)的数据见下表:| 时间(t/min) | 0 | 2 | 4 | 6 | 8 | 10 |
| 总压强(p/100kPa) | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
9.在一恒容密闭容器中,通入一定量CH4和NO2,测得在相同时间内,在不同温度下,NO2的转化率 [α(NO2)/%] 如下图;c点
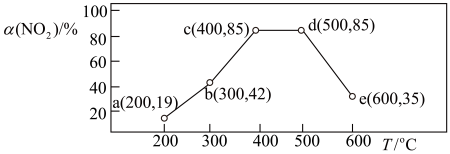
您最近半年使用:0次
名校
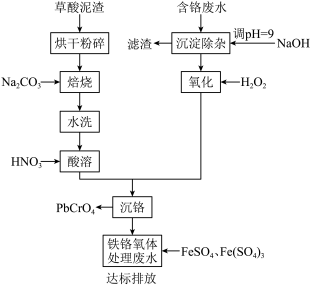
8 . 铬酸铅俗称铬黄,主要用于油漆、油墨、塑料以及橡胶等行业。一种以含铬废水(含Cr3+、Fe3+、Cu2+)和草酸泥渣(含草酸铅、硫酸铅)为原料制备铬酸铅的工艺流程如下:
回答下列问题
(1)草酸泥渣“粉碎”的目的是___________ ,“焙烧”时加入碳酸钠是为了将硫酸铅转化为PbO,同时放出CO2,该转化过程的化学方程式为___________ 。
(2)滤渣的主要成分为___________ 、___________ 。(填化学式)
(3)“沉淀除杂”所得滤液中含铬化合物主要为___________ 。(填化学式)
(4)“氧化”工序中发生反应的离子方程式为___________ 。
(5)为了提高沉铬率,用平衡移动原理解释“酸溶”过程中所加硝酸不能过量的原因:___________ 。
(6)处理含 的废水时,Cr(Ⅵ)被还原成Cr(Ⅲ)。若投入10molFeSO4,使金属阳离子恰好完全形成铁铬氧体(FeO·FexCryO3,其中FexCryO3中Fe为+3价)沉淀,理论上还需要投入Fe2(SO4)3的物质的量为
的废水时,Cr(Ⅵ)被还原成Cr(Ⅲ)。若投入10molFeSO4,使金属阳离子恰好完全形成铁铬氧体(FeO·FexCryO3,其中FexCryO3中Fe为+3价)沉淀,理论上还需要投入Fe2(SO4)3的物质的量为___________ mol。

回答下列问题
(1)草酸泥渣“粉碎”的目的是
(2)滤渣的主要成分为
(3)“沉淀除杂”所得滤液中含铬化合物主要为
(4)“氧化”工序中发生反应的离子方程式为
(5)为了提高沉铬率,用平衡移动原理解释“酸溶”过程中所加硝酸不能过量的原因:
(6)处理含
 的废水时,Cr(Ⅵ)被还原成Cr(Ⅲ)。若投入10molFeSO4,使金属阳离子恰好完全形成铁铬氧体(FeO·FexCryO3,其中FexCryO3中Fe为+3价)沉淀,理论上还需要投入Fe2(SO4)3的物质的量为
的废水时,Cr(Ⅵ)被还原成Cr(Ⅲ)。若投入10molFeSO4,使金属阳离子恰好完全形成铁铬氧体(FeO·FexCryO3,其中FexCryO3中Fe为+3价)沉淀,理论上还需要投入Fe2(SO4)3的物质的量为
您最近半年使用:0次
2024-04-21更新
|
125次组卷
|
2卷引用:东北三省四城市联考暨沈阳市高三下学期质量监测(二)化学试题
解题方法
9 . 室温下,1体积的水能溶解约2体积的Cl2.用试管收集Cl2后进行如图所示实验,下列对实验现象的分析或预测正确的是
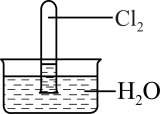
| A.试管内液面上升,证明Cl2与水发生了反应 |
| B.取出试管中的溶液,加入少量CaCO3粉末,溶液漂白能力减弱 |
C.取出试管中的溶液,光照一段时间后pH下降,与反应2HClO 2HCl+O2↑有关 2HCl+O2↑有关 |
| D.取出试管中的溶液,滴加紫色石蕊溶液,溶液先变红后褪色,加热后颜色又变为红色 |
您最近半年使用:0次
名校
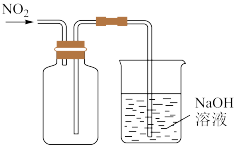
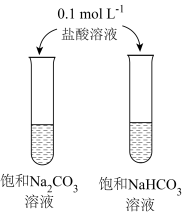
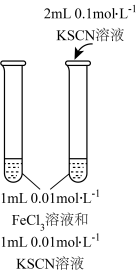
10 . 下列实验方案能达实验目的的是
| A | B | |
| 目的 | 收集并吸收NO2 | 比较Mg、Al金属性的强弱 |
| 实验方案 |
|
|
| C | D | |
| 目的 | 比较Na2CO3、NaHCO3与酸反应快慢 | 研究浓度对化学平衡的影响 |
| 实验方案 |
|
|
| A.A | B.B | C.C | D.D |
您最近半年使用:0次