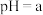名校
1 . 一种从某钒矿石(主要成分为 、
、 、
、 和
和 )中提钒的工艺流程如图所示。已知
)中提钒的工艺流程如图所示。已知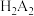 能够萃取溶液中的
能够萃取溶液中的 ,且萃取
,且萃取 的原理为
的原理为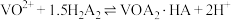 。下列说法正确的是
。下列说法正确的是
 、
、 、
、 和
和 )中提钒的工艺流程如图所示。已知
)中提钒的工艺流程如图所示。已知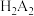 能够萃取溶液中的
能够萃取溶液中的 ,且萃取
,且萃取 的原理为
的原理为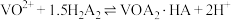 。下列说法正确的是
。下列说法正确的是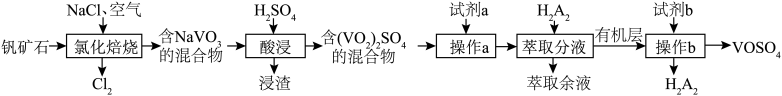
A.试剂a可选用的是 、 、 、 、 等 等 |
B.试剂b可选用的是KOH、NaOH、 等 等 |
| C.“酸浸”“操作b”的过程中均有氧化还原反应发生 |
| D.“操作b”使用的主要玻璃仪器有分液漏斗、烧杯 |
您最近半年使用:0次
名校
解题方法
2 . 科学家设计了一种新型 金属框架,可通过静电作用选择性吸附氨气,对于捕捉氨气效果良好。
金属框架,可通过静电作用选择性吸附氨气,对于捕捉氨气效果良好。 和另一种材料
和另一种材料 均可用于除去有害气体
均可用于除去有害气体 ,
,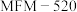 的孔径大小和形状恰能选择性固定
的孔径大小和形状恰能选择性固定 (如图所示)。
(如图所示)。 分子构型与乙烯类似。
分子构型与乙烯类似。
① ;
;
② 。
。
下列关于二者净化气体的说法中,正确的一项是
 金属框架,可通过静电作用选择性吸附氨气,对于捕捉氨气效果良好。
金属框架,可通过静电作用选择性吸附氨气,对于捕捉氨气效果良好。 和另一种材料
和另一种材料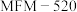 均可用于除去有害气体
均可用于除去有害气体 ,
,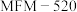 的孔径大小和形状恰能选择性固定
的孔径大小和形状恰能选择性固定 (如图所示)。
(如图所示)。
 分子构型与乙烯类似。
分子构型与乙烯类似。①
 ;
;②
 。
。下列关于二者净化气体的说法中,正确的一项是
A.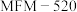 捕获的气体所有原子共平面, 捕获的气体所有原子共平面, 捕获的气体空间构型为正四面体 捕获的气体空间构型为正四面体 |
B.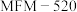 置入废气后,废气颜色变深, 置入废气后,废气颜色变深, 置入废气后,废气颜色变浅 置入废气后,废气颜色变浅 |
C.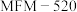 适宜在较低温度下净化气体, 适宜在较低温度下净化气体, 适宜在较高温度下净化气体 适宜在较高温度下净化气体 |
D.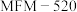 适宜在较高压强下净化气体, 适宜在较高压强下净化气体, 适宜在较低压强下净化气体 适宜在较低压强下净化气体 |
您最近半年使用:0次
7日内更新
|
81次组卷
|
2卷引用:安徽师范大学附属中学2024届高三下学期5月测试化学试卷
解题方法
3 . 废电池中含磷酸铁锂,提锂后的废渣主要含 、
、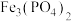 和金属铝等,以废渣为原料制备电池级
和金属铝等,以废渣为原料制备电池级 的一种工艺流程如下。
的一种工艺流程如下。 、
、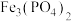 均难溶于水。
均难溶于水。
ii.将 转化为
转化为 有利于更彻底除去
有利于更彻底除去 。
。
(1)酸浸前,将废渣粉碎的目的是________ 。
(2)从平衡移动的角度解释加入硝酸溶解 的原因:
的原因:________ 。
(3)在酸浸液中加入 进行电解,电解原理的示意图如下图所示,电解过程中
进行电解,电解原理的示意图如下图所示,电解过程中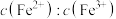 不断增大。结合电极反应说明
不断增大。结合电极反应说明 在电解中的作用:
在电解中的作用:________ 。 。向“氧化”后的溶液中加入HCHO,加热,产生NO和
。向“氧化”后的溶液中加入HCHO,加热,产生NO和 ,当液面上方不再产生红棕色气体时,静置一段时间,产生
,当液面上方不再产生红棕色气体时,静置一段时间,产生 沉淀。阐述此过程中HCHO的作用:
沉淀。阐述此过程中HCHO的作用:________ 。
(5)过滤得到电池级 后,滤液中主要的金属阳离子有
后,滤液中主要的金属阳离子有________ 。
(6)磷酸铁锂-石墨电池的总反应: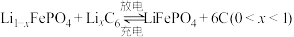 。
。
①高温条件下, 、葡萄糖(
、葡萄糖( )和
)和 可制备电极材料
可制备电极材料 ,同时生成CO和
,同时生成CO和 ,反应的化学方程式是
,反应的化学方程式是________ 。
②放电时负极的电极反应式是________ 。
 、
、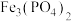 和金属铝等,以废渣为原料制备电池级
和金属铝等,以废渣为原料制备电池级 的一种工艺流程如下。
的一种工艺流程如下。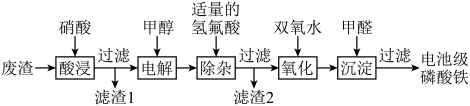
 、
、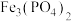 均难溶于水。
均难溶于水。ii.将
 转化为
转化为 有利于更彻底除去
有利于更彻底除去 。
。(1)酸浸前,将废渣粉碎的目的是
(2)从平衡移动的角度解释加入硝酸溶解
 的原因:
的原因:(3)在酸浸液中加入
 进行电解,电解原理的示意图如下图所示,电解过程中
进行电解,电解原理的示意图如下图所示,电解过程中 不断增大。结合电极反应说明
不断增大。结合电极反应说明 在电解中的作用:
在电解中的作用: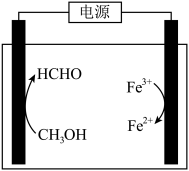
 。向“氧化”后的溶液中加入HCHO,加热,产生NO和
。向“氧化”后的溶液中加入HCHO,加热,产生NO和 ,当液面上方不再产生红棕色气体时,静置一段时间,产生
,当液面上方不再产生红棕色气体时,静置一段时间,产生 沉淀。阐述此过程中HCHO的作用:
沉淀。阐述此过程中HCHO的作用:(5)过滤得到电池级
 后,滤液中主要的金属阳离子有
后,滤液中主要的金属阳离子有(6)磷酸铁锂-石墨电池的总反应:
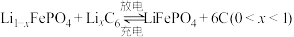 。
。①高温条件下,
 、葡萄糖(
、葡萄糖( )和
)和 可制备电极材料
可制备电极材料 ,同时生成CO和
,同时生成CO和 ,反应的化学方程式是
,反应的化学方程式是②放电时负极的电极反应式是
您最近半年使用:0次
4 . CH3CHO在NaOH溶液作用下制取2-丁烯醛的历程如下:
下列说法不正确 的是

下列说法
| A.OH-是该反应的催化剂 |
B.CH3CHO分子中甲基上的“ ”比 ”比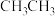 中的“ 中的“ ”更易电离出H+ ”更易电离出H+ |
| C.反应(4)加热失水有利于反应(3)平衡正向移动 |
| D.CH3CHO与CH3CH2CHO的混合液在NaOH溶液作用下最多可得到2种羟基醛 |
您最近半年使用:0次
5 . 大气中 能通过高温下与
能通过高温下与 反应进行协同转化处理。反应原理为:
反应进行协同转化处理。反应原理为: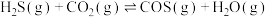 ,工业中测得的产物中有
,工业中测得的产物中有 、
、 、CO等副产物。
、CO等副产物。
(1)一定温度下,在恒容密闭容器中发生以上反应,下列条件能判断反应达到平衡状态的是___________。
(2)在573K下,向2L恒容密闭容器中通入2mol 和1mol
和1mol  ,反应达到平衡后水蒸气的物质的量分数为0.2。
,反应达到平衡后水蒸气的物质的量分数为0.2。
①上述条件下 的平衡转化率
的平衡转化率
___________ %。
②在上述平衡体系中再加2mol 和2mol
和2mol  ,通过数据说明平衡移动的方向
,通过数据说明平衡移动的方向___________ 。
(3)在不同温度下,向密闭容器甲、乙中分别充入2mol 和1mol
和1mol  ,它们分别在有水分子筛(只允许水分子透过)和无水分子筛条件下反应,测得的
,它们分别在有水分子筛(只允许水分子透过)和无水分子筛条件下反应,测得的 平衡转化率随温度变化关系如图所示。
平衡转化率随温度变化关系如图所示。___________ 。
A.甲 B.乙 C.甲、乙中任一个
②1173K以后平衡转化率变化的原因可能是___________ 。
 能通过高温下与
能通过高温下与 反应进行协同转化处理。反应原理为:
反应进行协同转化处理。反应原理为: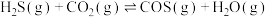 ,工业中测得的产物中有
,工业中测得的产物中有 、
、 、CO等副产物。
、CO等副产物。(1)一定温度下,在恒容密闭容器中发生以上反应,下列条件能判断反应达到平衡状态的是___________。
A.容器内 不再生成 不再生成 | B.容器内压强不再发生变化 |
| C.容器内气体密度不再发生变化 | D. |
(2)在573K下,向2L恒容密闭容器中通入2mol
 和1mol
和1mol  ,反应达到平衡后水蒸气的物质的量分数为0.2。
,反应达到平衡后水蒸气的物质的量分数为0.2。①上述条件下
 的平衡转化率
的平衡转化率
②在上述平衡体系中再加2mol
 和2mol
和2mol  ,通过数据说明平衡移动的方向
,通过数据说明平衡移动的方向(3)在不同温度下,向密闭容器甲、乙中分别充入2mol
 和1mol
和1mol  ,它们分别在有水分子筛(只允许水分子透过)和无水分子筛条件下反应,测得的
,它们分别在有水分子筛(只允许水分子透过)和无水分子筛条件下反应,测得的 平衡转化率随温度变化关系如图所示。
平衡转化率随温度变化关系如图所示。
A.甲 B.乙 C.甲、乙中任一个
②1173K以后平衡转化率变化的原因可能是
您最近半年使用:0次
2024·黑龙江·模拟预测
解题方法
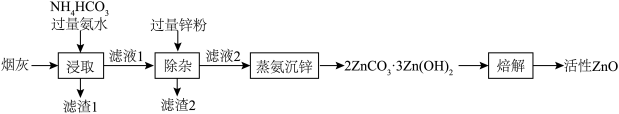
6 . 活性ZnO俗名锌白,用作白色颜料,也广泛用于生产玻璃、橡胶、油漆、塑料等。利用化工厂产生的烟灰(ZnO,还含有少量CuO、MnO2、FeO等杂质)制备活性ZnO的工艺流程如图。
(1)Zn的基态价电子排布式为___________ ,烟灰中的主要成分ZnO发生反应的化学方程式为___________ ,滤渣1的主要成分为___________ 。
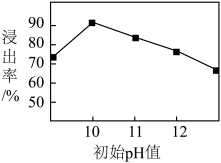
(2)锌元素的浸出率随浸出液初始pH的变化关系如图所示,当浸出液初始pH大于10时,浸出率随pH增大而减小的原因是___________ 。 也能与氨水形成配合物存在于浸出后的滤液中,加入Zn粉可将它置换除去,写出Zn粉和铜氨配合物反应的离子方程式
也能与氨水形成配合物存在于浸出后的滤液中,加入Zn粉可将它置换除去,写出Zn粉和铜氨配合物反应的离子方程式___________ 。
(4)“蒸氨”时会出现白色固体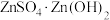 ,运用平衡移动原理解释原因:
,运用平衡移动原理解释原因:___________ 。
(5)从m kg烟灰中得到活性ZnO akg,则ZnO的回收率___________ (填“小于”、“大于”或“等于”)100%。
(6)已知 和
和 的分解温度分别为125℃、300℃。实验室加热碱式碳酸锌
的分解温度分别为125℃、300℃。实验室加热碱式碳酸锌 时测得的固体残留率随温度的变化关系如图所示。
时测得的固体残留率随温度的变化关系如图所示。___________ (填化学式)。
②经焙解得到的活性ZnO晶胞结构如图所示。该晶胞中Zn原子的配位数为___________ 。
(1)Zn的基态价电子排布式为
(2)锌元素的浸出率随浸出液初始pH的变化关系如图所示,当浸出液初始pH大于10时,浸出率随pH增大而减小的原因是
 也能与氨水形成配合物存在于浸出后的滤液中,加入Zn粉可将它置换除去,写出Zn粉和铜氨配合物反应的离子方程式
也能与氨水形成配合物存在于浸出后的滤液中,加入Zn粉可将它置换除去,写出Zn粉和铜氨配合物反应的离子方程式(4)“蒸氨”时会出现白色固体
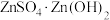 ,运用平衡移动原理解释原因:
,运用平衡移动原理解释原因:(5)从m kg烟灰中得到活性ZnO akg,则ZnO的回收率
(6)已知
 和
和 的分解温度分别为125℃、300℃。实验室加热碱式碳酸锌
的分解温度分别为125℃、300℃。实验室加热碱式碳酸锌 时测得的固体残留率随温度的变化关系如图所示。
时测得的固体残留率随温度的变化关系如图所示。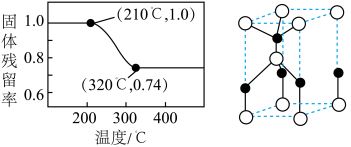
②经焙解得到的活性ZnO晶胞结构如图所示。该晶胞中Zn原子的配位数为
您最近半年使用:0次
2024·黑龙江·模拟预测
解题方法
7 . 氢能是一种极具发展潜能的清洁能源。对于可逆反应:
 ,在容积恒为2L的密闭容器中,将2.0molC0与8.0molH2混合加热到830℃发生上述反应,5min时达到平衡,CO的转化率是80%。实验发现,其他条件不变,在相同时间内,向上述体系中投入一定量的CaO可以增大H2的体积分数。选用相同质量、不同粒径的CaO固体进行实验时,对比实验的结果如图所示。下列叙述中错误的是
,在容积恒为2L的密闭容器中,将2.0molC0与8.0molH2混合加热到830℃发生上述反应,5min时达到平衡,CO的转化率是80%。实验发现,其他条件不变,在相同时间内,向上述体系中投入一定量的CaO可以增大H2的体积分数。选用相同质量、不同粒径的CaO固体进行实验时,对比实验的结果如图所示。下列叙述中错误的是

 ,在容积恒为2L的密闭容器中,将2.0molC0与8.0molH2混合加热到830℃发生上述反应,5min时达到平衡,CO的转化率是80%。实验发现,其他条件不变,在相同时间内,向上述体系中投入一定量的CaO可以增大H2的体积分数。选用相同质量、不同粒径的CaO固体进行实验时,对比实验的结果如图所示。下列叙述中错误的是
,在容积恒为2L的密闭容器中,将2.0molC0与8.0molH2混合加热到830℃发生上述反应,5min时达到平衡,CO的转化率是80%。实验发现,其他条件不变,在相同时间内,向上述体系中投入一定量的CaO可以增大H2的体积分数。选用相同质量、不同粒径的CaO固体进行实验时,对比实验的结果如图所示。下列叙述中错误的是
| A.微米CaO和纳米CaO对平衡影响不同主要是CaO作为催化剂表面积越大,反应的速率越快 |
B.在生产中,增大 的用量可同时提高CO的转化率和 的用量可同时提高CO的转化率和 的产率 的产率 |
C.5min内的平均反应速率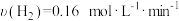 |
| D.平衡时间容器中通入He增大压强,平衡不移动 |
您最近半年使用:0次
8 . 某校化学学习小组探究 与
与 溶液的反应,装置如下图所示,分液漏斗中盛有浓硫酸,锥形瓶中装有
溶液的反应,装置如下图所示,分液漏斗中盛有浓硫酸,锥形瓶中装有 固体。回答下列问题:
固体。回答下列问题:
(1)写出实验中制备 的化学方程式
的化学方程式________ 。
(2)配制100mL
 溶液用到的主要玻璃仪器为烧杯、玻璃棒、胶头滴管和
溶液用到的主要玻璃仪器为烧杯、玻璃棒、胶头滴管和________ 。
【实验探究】
向3mL
 溶液中通入
溶液中通入 ,观察到溶液立即由黄色变成红棕色,放置12小时后,,红棕色消失,溶液变为浅绿色。结合已有知识,针对溶液呈红棕色学习小组提出以下猜想:
,观察到溶液立即由黄色变成红棕色,放置12小时后,,红棕色消失,溶液变为浅绿色。结合已有知识,针对溶液呈红棕色学习小组提出以下猜想:
猜想1: 水解产生了红棕色的
水解产生了红棕色的 胶体;
胶体;
猜想2: 与溶液中某种
与溶液中某种 价含硫微粒形成了红棕色的配合物。
价含硫微粒形成了红棕色的配合物。
(3)为验证上述猜想,甲同学用激光笔照射该红棕色溶液,________ ,证明猜想1不成立。
(4)乙同学查阅文献得知猜想2正确,并设计了下表3组实验,以确定红棕色配合物的配体是 、
、 、
、 中的哪一种(实验均在常温下进行)。
中的哪一种(实验均在常温下进行)。
已知:常温下,溶液中 价含硫微粒物质的量分数随pH变化曲线如图所示。
价含硫微粒物质的量分数随pH变化曲线如图所示。________ (填写微粒符号),依据的实验证据是________ 。
(5)丙同学查阅资料得知:
利用分光光度计可测定溶液中有色物质的吸光度,吸光度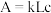 ,其中k为摩尔吸收系数;L为液层厚度即光路长度,在实验中液层厚度保持一致;c为有色物质的浓度。
,其中k为摩尔吸收系数;L为液层厚度即光路长度,在实验中液层厚度保持一致;c为有色物质的浓度。
丙同学经过思考,认为乙同学的实验方案不严谨,除了pH会影响溶液红棕色的深浅,还有一个因素也可能会影响溶液红棕色的深浅。于是设计如下实验进行探究,请帮助该同学完成实验方案,填写下表中空白处。
实验结果讨论:若 ,则该因素不影响溶液红棕色的深浅;若
,则该因素不影响溶液红棕色的深浅;若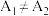 ,则该因素会影响溶液红棕色的深浅。
,则该因素会影响溶液红棕色的深浅。
(6)丁同学查阅资料得知:
配合物在溶液中存在解离平衡,如: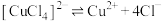 。
。
丁同学设计实验,利用分光光度计测定上述溶液中红棕色物质的吸光度,证明解离平衡的存在。请完成表中内容。
实验限选试剂为: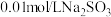 溶液,
溶液,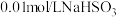 溶液,
溶液, 固体,
固体,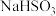 固体
固体
 与
与 溶液的反应,装置如下图所示,分液漏斗中盛有浓硫酸,锥形瓶中装有
溶液的反应,装置如下图所示,分液漏斗中盛有浓硫酸,锥形瓶中装有 固体。回答下列问题:
固体。回答下列问题: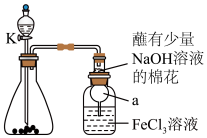
(1)写出实验中制备
 的化学方程式
的化学方程式(2)配制100mL

 溶液用到的主要玻璃仪器为烧杯、玻璃棒、胶头滴管和
溶液用到的主要玻璃仪器为烧杯、玻璃棒、胶头滴管和【实验探究】
向3mL

 溶液中通入
溶液中通入 ,观察到溶液立即由黄色变成红棕色,放置12小时后,,红棕色消失,溶液变为浅绿色。结合已有知识,针对溶液呈红棕色学习小组提出以下猜想:
,观察到溶液立即由黄色变成红棕色,放置12小时后,,红棕色消失,溶液变为浅绿色。结合已有知识,针对溶液呈红棕色学习小组提出以下猜想:猜想1:
 水解产生了红棕色的
水解产生了红棕色的 胶体;
胶体;猜想2:
 与溶液中某种
与溶液中某种 价含硫微粒形成了红棕色的配合物。
价含硫微粒形成了红棕色的配合物。(3)为验证上述猜想,甲同学用激光笔照射该红棕色溶液,
(4)乙同学查阅文献得知猜想2正确,并设计了下表3组实验,以确定红棕色配合物的配体是
 、
、 、
、 中的哪一种(实验均在常温下进行)。
中的哪一种(实验均在常温下进行)。组别 | 溶液1(1mL) | 溶液2(2mL) | 现象 |
a |
|
| 溶液1和溶液2混合后,组别a、b、c所得溶液红棕色依次加深。 |
b |  的饱和溶液,用 的饱和溶液,用 固体调节. 固体调节. | ||
c |  的饱和溶液,用 的饱和溶液,用 固体调节 固体调节 |
 价含硫微粒物质的量分数随pH变化曲线如图所示。
价含硫微粒物质的量分数随pH变化曲线如图所示。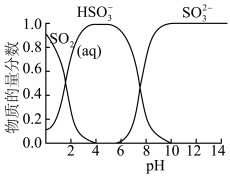
(5)丙同学查阅资料得知:
利用分光光度计可测定溶液中有色物质的吸光度,吸光度
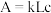 ,其中k为摩尔吸收系数;L为液层厚度即光路长度,在实验中液层厚度保持一致;c为有色物质的浓度。
,其中k为摩尔吸收系数;L为液层厚度即光路长度,在实验中液层厚度保持一致;c为有色物质的浓度。丙同学经过思考,认为乙同学的实验方案不严谨,除了pH会影响溶液红棕色的深浅,还有一个因素也可能会影响溶液红棕色的深浅。于是设计如下实验进行探究,请帮助该同学完成实验方案,填写下表中空白处。
实验序号 | 操作 | 吸光度 |
1 | 把1mL 0.1mol/L 溶液与2mL 溶液与2mL 饱和溶液混合均匀,溶液变成红棕色,测定溶液中红棕色物质的吸光度。 饱和溶液混合均匀,溶液变成红棕色,测定溶液中红棕色物质的吸光度。 |
|
2 |
|
 ,则该因素不影响溶液红棕色的深浅;若
,则该因素不影响溶液红棕色的深浅;若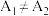 ,则该因素会影响溶液红棕色的深浅。
,则该因素会影响溶液红棕色的深浅。(6)丁同学查阅资料得知:
配合物在溶液中存在解离平衡,如:
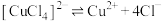 。
。丁同学设计实验,利用分光光度计测定上述溶液中红棕色物质的吸光度,证明解离平衡的存在。请完成表中内容。
实验限选试剂为:
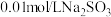 溶液,
溶液,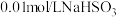 溶液,
溶液, 固体,
固体,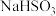 固体
固体实验序号 | 操作 | 吸光度 | 结论 |
3 | 向3mL 0.1mol/L 溶液中通入 溶液中通入 ,溶液立即由黄色变成红棕色,测定溶液中红棕色物质的吸光度 ,溶液立即由黄色变成红棕色,测定溶液中红棕色物质的吸光度 |
| |
4 |
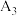 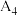 (填“大于”、“小于”或“等于”) (填“大于”、“小于”或“等于”) | 平衡向 |
您最近半年使用:0次
名校
9 . 利用CO2合成二甲醚的原理为2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) ∆H,其中投料比
CH3OCH3(g)+3H2O(g) ∆H,其中投料比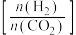 (取值为2、3、4)和温度与CO2的平衡转化率的关系如图所示
(取值为2、3、4)和温度与CO2的平衡转化率的关系如图所示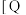 点c(CO2)= 0.2mol·L-1。下列说法正确的是
点c(CO2)= 0.2mol·L-1。下列说法正确的是
 CH3OCH3(g)+3H2O(g) ∆H,其中投料比
CH3OCH3(g)+3H2O(g) ∆H,其中投料比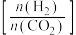 (取值为2、3、4)和温度与CO2的平衡转化率的关系如图所示
(取值为2、3、4)和温度与CO2的平衡转化率的关系如图所示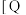 点c(CO2)= 0.2mol·L-1。下列说法正确的是
点c(CO2)= 0.2mol·L-1。下列说法正确的是
| A.T1K时,Kc=0.0675 | B.△H>0 |
C.X表示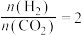 | D.催化剂可以改变CO2的平衡转化率 |
您最近半年使用:0次
解题方法
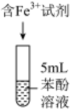
10 . 某小组同学探究铁离子与苯酚的反应。
已知: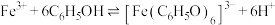 ;
;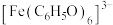 为紫色配合物。
为紫色配合物。
(1)配制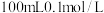 苯酚溶液,需要用到的玻璃仪器有:烧杯、胶头滴管、玻璃棒、
苯酚溶液,需要用到的玻璃仪器有:烧杯、胶头滴管、玻璃棒、__________ 。
(2)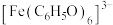 中,提供空轨道用以形成配位键的微粒是
中,提供空轨道用以形成配位键的微粒是__________ ,配位数为__________ 。
(3)探究铁盐种类和pH对苯酚与 显色反应的影响。
显色反应的影响。
查阅资料:
ⅰ. 对苯酚与
对苯酚与 的显色反应无影响;
的显色反应无影响;
ⅱ.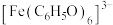 对特定波长光的吸收程度(用吸光度A表示)与
对特定波长光的吸收程度(用吸光度A表示)与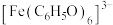 浓度在一定范围内成正比。
浓度在一定范围内成正比。
提出猜想:猜想1: 对苯酚与
对苯酚与 的显色反应有影响
的显色反应有影响
猜想2: 对苯酚与
对苯酚与 的显色反应有影响
的显色反应有影响
猜想3: 对苯酚与
对苯酚与 的显色反应有影响
的显色反应有影响
进行实验:
常温下,用盐酸调节pH,配制得到pH分别为a和b的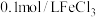 溶液(
溶液( );用硫酸调节pH,配制得到pH分别为a和b的
);用硫酸调节pH,配制得到pH分别为a和b的 溶液。取4支试管各加入
溶液。取4支试管各加入 苯酚溶液,按实验1~4分别再加入0.1mL含
苯酚溶液,按实验1~4分别再加入0.1mL含 的试剂,显色10min后用紫外一可见分光光度计测定该溶液的吸光度(本实验条件下,pH改变对
的试剂,显色10min后用紫外一可见分光光度计测定该溶液的吸光度(本实验条件下,pH改变对 水解程度的影响可忽略)。
水解程度的影响可忽略)。
结果讨论:实验结果为
①根据实验结果,小组同学认为此结果不足以证明猜想3成立的理由是__________________ 。
②为进一步验证猜想,小组同学设计了实验5和6,补充下表中试剂M为__________________ 。(限选试剂:NaCl溶液、 溶液、NaCl固体、
溶液、NaCl固体、 固体)。
固体)。
③根据实验1~6的结果,小组同学得出猜想1不成立,猜想2成立,且 对苯酚与
对苯酚与 的显色反应起抑制作用,得出此结论的依据是:
的显色反应起抑制作用,得出此结论的依据是: 、A1
、A1__________ A6(填“>”“<”或者“=”)。
④根据实验1~6的结果,小组同学得出猜想3成立,且 对
对 与苯酚的显色反应有抑制作用,从化学平衡角度解释其原因是
与苯酚的显色反应有抑制作用,从化学平衡角度解释其原因是______________________________ 。
(4)通过以上实验结论分析:与苯酚相比,对羟基苯甲酸(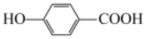 )与
)与 溶液发生显色反应
溶液发生显色反应__________ (填“容易”或“更难”)。
(5)实验室中常用某些配合物的性质进行物质的检验,请举一例子并说明现象____________ 。
已知:
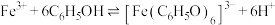 ;
;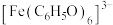 为紫色配合物。
为紫色配合物。(1)配制
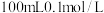 苯酚溶液,需要用到的玻璃仪器有:烧杯、胶头滴管、玻璃棒、
苯酚溶液,需要用到的玻璃仪器有:烧杯、胶头滴管、玻璃棒、(2)
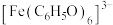 中,提供空轨道用以形成配位键的微粒是
中,提供空轨道用以形成配位键的微粒是(3)探究铁盐种类和pH对苯酚与
 显色反应的影响。
显色反应的影响。查阅资料:
ⅰ.
 对苯酚与
对苯酚与 的显色反应无影响;
的显色反应无影响;ⅱ.
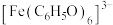 对特定波长光的吸收程度(用吸光度A表示)与
对特定波长光的吸收程度(用吸光度A表示)与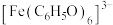 浓度在一定范围内成正比。
浓度在一定范围内成正比。提出猜想:猜想1:
 对苯酚与
对苯酚与 的显色反应有影响
的显色反应有影响猜想2:
 对苯酚与
对苯酚与 的显色反应有影响
的显色反应有影响猜想3:
 对苯酚与
对苯酚与 的显色反应有影响
的显色反应有影响进行实验:
常温下,用盐酸调节pH,配制得到pH分别为a和b的
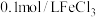 溶液(
溶液( );用硫酸调节pH,配制得到pH分别为a和b的
);用硫酸调节pH,配制得到pH分别为a和b的 溶液。取4支试管各加入
溶液。取4支试管各加入 苯酚溶液,按实验1~4分别再加入0.1mL含
苯酚溶液,按实验1~4分别再加入0.1mL含 的试剂,显色10min后用紫外一可见分光光度计测定该溶液的吸光度(本实验条件下,pH改变对
的试剂,显色10min后用紫外一可见分光光度计测定该溶液的吸光度(本实验条件下,pH改变对 水解程度的影响可忽略)。
水解程度的影响可忽略)。
| 序号 | 含 | 吸光度 | |
|
| |||
1 |
| / | A1 | |
2 |
| / | A2 | |
3 | / |
| A3 | |
4 | / |
| A4 | |

①根据实验结果,小组同学认为此结果不足以证明猜想3成立的理由是
②为进一步验证猜想,小组同学设计了实验5和6,补充下表中试剂M为
 溶液、NaCl固体、
溶液、NaCl固体、 固体)。
固体)。
| 序号 | 含 | 再加入的试剂 | 吸光度 | |
|
| ||||
5 | / |
| NaCl固体 | A5 | |
6 |
| / | 试剂M | A6 | |
 对苯酚与
对苯酚与 的显色反应起抑制作用,得出此结论的依据是:
的显色反应起抑制作用,得出此结论的依据是: 、A1
、A1④根据实验1~6的结果,小组同学得出猜想3成立,且
 对
对 与苯酚的显色反应有抑制作用,从化学平衡角度解释其原因是
与苯酚的显色反应有抑制作用,从化学平衡角度解释其原因是(4)通过以上实验结论分析:与苯酚相比,对羟基苯甲酸(
 )与
)与 溶液发生显色反应
溶液发生显色反应(5)实验室中常用某些配合物的性质进行物质的检验,请举一例子并说明现象
您最近半年使用:0次

 溶液
溶液