名校
解题方法
1 . 探究溶液中Ag+与单质S的反应。
资料:Ag2S不溶于6mol/L盐酸,Ag2SO3和Ag2SO4在6mol/L盐酸中均发生沉淀的转化
实验Ⅰ.在注射器中将10mL0.04mol/LAgNO3溶液(pH≈6)与0.01g S粉混合,水浴加热,充分反应后,过滤,得到无色溶液a(pH≈1),沉淀除S、洗涤后得到黑色固体b。
(1)研究黑色固体b的组成
①根据S具有__________ 性,推测b中可能含有Ag2S、Ag、Ag2SO3或Ag2SO4。
②检验黑色固体b的成分______ 。
ⅱ.用滤液c继续实验证明了黑色固体b中不含Ag2SO3,可选择的试剂是______ (填序号)。
a.酸性KMnO4溶液 b.H2O2和BaCl2的混合溶液 c.溴水
ⅲ.进一步实验证实了黑色固体b中不含Ag。根据沉淀e含有Ag、气体含有H2S,写出同时生成Ag和H2S的离子方程式:_________________ 。
(2)研究无色溶液a的组成
结合上述实验结果,分析溶液a中可能存在 或H2SO3,依据是
或H2SO3,依据是_______________ 。___________________ 。
②加入足量稀盐酸的作用是_________________ 。
(3)在注射器中进行实验Ⅳ,探究Ag2SO4溶液与S的反应,所得产物与实验Ⅰ相同。向注射器中加入的物质是__________________ 。
(4)用酸化的NaNO3溶液(pH≈6)与S进行实验Ⅴ,发现二者不反应。综合以上实验,写出溶液中Ag+与S反应的离子方程式并简要说明Ag+的作用:_______________ 。
资料:Ag2S不溶于6mol/L盐酸,Ag2SO3和Ag2SO4在6mol/L盐酸中均发生沉淀的转化
实验Ⅰ.在注射器中将10mL0.04mol/LAgNO3溶液(pH≈6)与0.01g S粉混合,水浴加热,充分反应后,过滤,得到无色溶液a(pH≈1),沉淀除S、洗涤后得到黑色固体b。
(1)研究黑色固体b的组成
①根据S具有
②检验黑色固体b的成分
实验Ⅱ.
ⅱ.用滤液c继续实验证明了黑色固体b中不含Ag2SO3,可选择的试剂是
a.酸性KMnO4溶液 b.H2O2和BaCl2的混合溶液 c.溴水
ⅲ.进一步实验证实了黑色固体b中不含Ag。根据沉淀e含有Ag、气体含有H2S,写出同时生成Ag和H2S的离子方程式:
(2)研究无色溶液a的组成
结合上述实验结果,分析溶液a中可能存在
 或H2SO3,依据是
或H2SO3,依据是实验Ⅲ.
②加入足量稀盐酸的作用是
(3)在注射器中进行实验Ⅳ,探究Ag2SO4溶液与S的反应,所得产物与实验Ⅰ相同。向注射器中加入的物质是
(4)用酸化的NaNO3溶液(pH≈6)与S进行实验Ⅴ,发现二者不反应。综合以上实验,写出溶液中Ag+与S反应的离子方程式并简要说明Ag+的作用:
您最近一年使用:0次
名校
解题方法
2 . CCTV在“新闻30分”中介绍:王者归“铼”,我国发现超级铁矿,飞机上天全靠它。铼(Re)是一种稀散金属,广泛应用于航空航天领域。工业上从高铼废料(含 等)中提取铼的一种工艺流程如图所示:
等)中提取铼的一种工艺流程如图所示: 。
。
回答下列问题:
(1)“焙烧”时,高铼废料粉末与富氧空气逆流混合的目的为___________ 。该工序中,ReS2发生反应的化学方程式为___________ 。
(2)其他条件相同时,“离子交换”过程中料液和D296体积比与铼交换率、铼交换量的变化关系如图1所示;混合溶液的pH与 提取率的变化关系如图2所示。
提取率的变化关系如图2所示。___________ 。
②其他条件相同,混合溶液的pH>1.5时, 的提取率降低的主要原因为
的提取率降低的主要原因为___________ 。
(3)“反萃取”时,选用的试剂X为盐酸的理由为___________ 。
(4)另一种途径从炼铜废液中来提取铼,其简易工艺流程如图,(部分副产物省略,铼在废液中以 形式存在):
形式存在):___________ 方法提纯高铼酸铵晶体。
(5)废料中的Ni元素经一系列操作可得到金属镍,金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图及晶胞参数如图所示。该晶体的化学式为___________ ;晶体密度为___________ g∙cm-3 (列出含a、b、NA的计算表达式,NA表示阿伏加德罗常数的值)。
 等)中提取铼的一种工艺流程如图所示:
等)中提取铼的一种工艺流程如图所示:
 。
。回答下列问题:
(1)“焙烧”时,高铼废料粉末与富氧空气逆流混合的目的为
(2)其他条件相同时,“离子交换”过程中料液和D296体积比与铼交换率、铼交换量的变化关系如图1所示;混合溶液的pH与
 提取率的变化关系如图2所示。
提取率的变化关系如图2所示。
②其他条件相同,混合溶液的pH>1.5时,
 的提取率降低的主要原因为
的提取率降低的主要原因为(3)“反萃取”时,选用的试剂X为盐酸的理由为
(4)另一种途径从炼铜废液中来提取铼,其简易工艺流程如图,(部分副产物省略,铼在废液中以
 形式存在):
形式存在):
(5)废料中的Ni元素经一系列操作可得到金属镍,金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图及晶胞参数如图所示。该晶体的化学式为

您最近一年使用:0次
解题方法
3 . 工业上利用软锰矿(主要成分为 ,含少量
,含少量 、FeO和
、FeO和 等杂质)和含
等杂质)和含 的烟气为主要原料,制备无水碳酸锰的工艺流程如图所示。
的烟气为主要原料,制备无水碳酸锰的工艺流程如图所示。 难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解,在空气中高温加热所得固体产物为
难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解,在空气中高温加热所得固体产物为 。
。
②不同金属离子生成氢氧化物沉淀的pH如下表:
③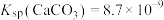 ,
,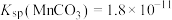 。
。
回答下列问题:
(1)下列说法正确的是________(填序号)。
(2)调节溶液的pH前,加入软锰矿发生“氧化”作用的离子方程式是________ 。
(3)调节pH:加入适量的熟石灰,调节pH=5。充分反应后生成的沉淀有________ 。如果没有前期的“氧化”环节,pH就需要调节到更大的数值,这样会导致________ 。
(4)“沉锰”过程中加入氨水的目的是________ (从化学平衡移动的角度解释)。“沉锰”过程宜在较低温度下进行,可能的原因是________ (写1条即可)。“沉锰”时通过控制合理的pH,就可以控制 的浓度,达到不产生
的浓度,达到不产生 的目的,原因是
的目的,原因是________ 。
 ,含少量
,含少量 、FeO和
、FeO和 等杂质)和含
等杂质)和含 的烟气为主要原料,制备无水碳酸锰的工艺流程如图所示。
的烟气为主要原料,制备无水碳酸锰的工艺流程如图所示。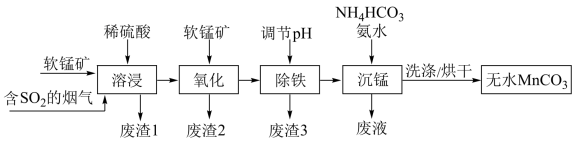
 难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解,在空气中高温加热所得固体产物为
难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解,在空气中高温加热所得固体产物为 。
。②不同金属离子生成氢氧化物沉淀的pH如下表:
| 离子 |  |  |  |
| 开始沉淀时pH | 2.7 | 7.5 | 7.8 |
| 完全沉淀时pH | 3.7 | 9.7 | 9.8 |
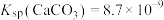 ,
,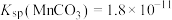 。
。回答下列问题:
(1)下列说法正确的是________(填序号)。
| A.最好使用粉状软锰矿进行“溶浸” | B.废渣1的主要成分和“芯片”相同 |
| C.溶浸时不会发生氧化还原反应 | D.废液经处理可用于灌溉农作物 |
(2)调节溶液的pH前,加入软锰矿发生“氧化”作用的离子方程式是
(3)调节pH:加入适量的熟石灰,调节pH=5。充分反应后生成的沉淀有
(4)“沉锰”过程中加入氨水的目的是
 的浓度,达到不产生
的浓度,达到不产生 的目的,原因是
的目的,原因是
您最近一年使用:0次
解题方法
4 . 废电池中含磷酸铁锂,提锂后的废渣主要含 、
、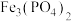 和金属铝等,以废渣为原料制备电池级
和金属铝等,以废渣为原料制备电池级 的一种工艺流程如下。
的一种工艺流程如下。 、
、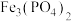 均难溶于水。
均难溶于水。
ii.将 转化为
转化为 有利于更彻底除去
有利于更彻底除去 。
。
(1)酸浸前,将废渣粉碎的目的是________ 。
(2)从平衡移动的角度解释加入硝酸溶解 的原因:
的原因:________ 。
(3)在酸浸液中加入 进行电解,电解原理的示意图如下图所示,电解过程中
进行电解,电解原理的示意图如下图所示,电解过程中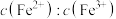 不断增大。结合电极反应说明
不断增大。结合电极反应说明 在电解中的作用:
在电解中的作用:________ 。 。向“氧化”后的溶液中加入HCHO,加热,产生NO和
。向“氧化”后的溶液中加入HCHO,加热,产生NO和 ,当液面上方不再产生红棕色气体时,静置一段时间,产生
,当液面上方不再产生红棕色气体时,静置一段时间,产生 沉淀。阐述此过程中HCHO的作用:
沉淀。阐述此过程中HCHO的作用:________ 。
(5)过滤得到电池级 后,滤液中主要的金属阳离子有
后,滤液中主要的金属阳离子有________ 。
(6)磷酸铁锂-石墨电池的总反应: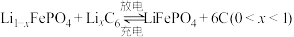 。
。
①高温条件下, 、葡萄糖(
、葡萄糖( )和
)和 可制备电极材料
可制备电极材料 ,同时生成CO和
,同时生成CO和 ,反应的化学方程式是
,反应的化学方程式是________ 。
②放电时负极的电极反应式是________ 。
 、
、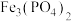 和金属铝等,以废渣为原料制备电池级
和金属铝等,以废渣为原料制备电池级 的一种工艺流程如下。
的一种工艺流程如下。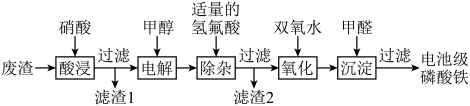
 、
、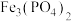 均难溶于水。
均难溶于水。ii.将
 转化为
转化为 有利于更彻底除去
有利于更彻底除去 。
。(1)酸浸前,将废渣粉碎的目的是
(2)从平衡移动的角度解释加入硝酸溶解
 的原因:
的原因:(3)在酸浸液中加入
 进行电解,电解原理的示意图如下图所示,电解过程中
进行电解,电解原理的示意图如下图所示,电解过程中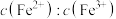 不断增大。结合电极反应说明
不断增大。结合电极反应说明 在电解中的作用:
在电解中的作用: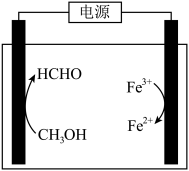
 。向“氧化”后的溶液中加入HCHO,加热,产生NO和
。向“氧化”后的溶液中加入HCHO,加热,产生NO和 ,当液面上方不再产生红棕色气体时,静置一段时间,产生
,当液面上方不再产生红棕色气体时,静置一段时间,产生 沉淀。阐述此过程中HCHO的作用:
沉淀。阐述此过程中HCHO的作用:(5)过滤得到电池级
 后,滤液中主要的金属阳离子有
后,滤液中主要的金属阳离子有(6)磷酸铁锂-石墨电池的总反应:
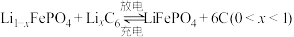 。
。①高温条件下,
 、葡萄糖(
、葡萄糖( )和
)和 可制备电极材料
可制备电极材料 ,同时生成CO和
,同时生成CO和 ,反应的化学方程式是
,反应的化学方程式是②放电时负极的电极反应式是
您最近一年使用:0次
解题方法
5 . 某实验小组从某废旧锂离子电池正极活性材料(主要成分可表示为 ,还含有少量
,还含有少量 、
、 的化合物)中分别回收处理金属元素,工艺流程如下图所示:
的化合物)中分别回收处理金属元素,工艺流程如下图所示: 、
、 、
、 、
、 ;
;
②有关金属离子沉淀完全的 见下表:
见下表:
(1)丁二酮肟分子中 杂化的碳原子个数为
杂化的碳原子个数为______ ,二丁二酮肟镍中存在的化学键有______ (填序号)。
A. 链 B.氢键 C.金属键 D.配位键
链 B.氢键 C.金属键 D.配位键
(2)“氧化”过程的操作为控制体系的 在
在 ,加入
,加入 溶液,写出反应的离子方程式
溶液,写出反应的离子方程式______ 。
(3)P507萃取剂(用HA表示)萃取 的原理可表示为
的原理可表示为 的浸出与水相
的浸出与水相 的关系如图所示。分析
的关系如图所示。分析 较小时萃取率偏低的原因为
较小时萃取率偏低的原因为______ 。 和
和 在空气氛围中焙烧可得到
在空气氛围中焙烧可得到 ,该反应化学方程式为
,该反应化学方程式为______ 。
(5)将草酸钴晶体 置于空气中加热,受热过程中固体残留率(
置于空气中加热,受热过程中固体残留率( )变化如下图所示,则C点固体物质的化学式为
)变化如下图所示,则C点固体物质的化学式为______ 。 的一种晶胞如图所示(仅标出
的一种晶胞如图所示(仅标出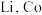 与
与 未标出)、该晶胞中占有O的个数为
未标出)、该晶胞中占有O的个数为______ 。
 ,还含有少量
,还含有少量 、
、 的化合物)中分别回收处理金属元素,工艺流程如下图所示:
的化合物)中分别回收处理金属元素,工艺流程如下图所示: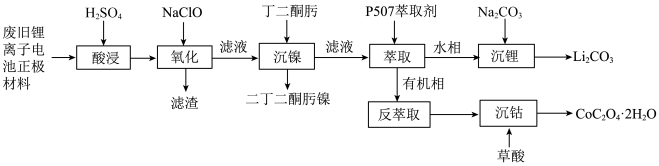
 、
、 、
、 、
、 ;
;②有关金属离子沉淀完全的
 见下表:
见下表:离子 |
|
|
|
|
| 9.3 | 3.2 | 9.0 | 8.9 |
③沉镍反应为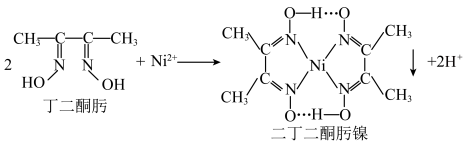
(1)丁二酮肟分子中
 杂化的碳原子个数为
杂化的碳原子个数为A.
 链 B.氢键 C.金属键 D.配位键
链 B.氢键 C.金属键 D.配位键(2)“氧化”过程的操作为控制体系的
 在
在 ,加入
,加入 溶液,写出反应的离子方程式
溶液,写出反应的离子方程式(3)P507萃取剂(用HA表示)萃取
 的原理可表示为
的原理可表示为 的浸出与水相
的浸出与水相 的关系如图所示。分析
的关系如图所示。分析 较小时萃取率偏低的原因为
较小时萃取率偏低的原因为
 和
和 在空气氛围中焙烧可得到
在空气氛围中焙烧可得到 ,该反应化学方程式为
,该反应化学方程式为(5)将草酸钴晶体
 置于空气中加热,受热过程中固体残留率(
置于空气中加热,受热过程中固体残留率( )变化如下图所示,则C点固体物质的化学式为
)变化如下图所示,则C点固体物质的化学式为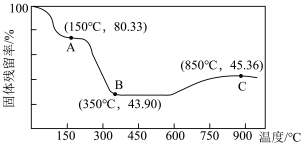
 的一种晶胞如图所示(仅标出
的一种晶胞如图所示(仅标出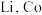 与
与 未标出)、该晶胞中占有O的个数为
未标出)、该晶胞中占有O的个数为
您最近一年使用:0次
6 . 大气中 能通过高温下与
能通过高温下与 反应进行协同转化处理。反应原理为:
反应进行协同转化处理。反应原理为: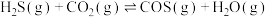 ,工业中测得的产物中有
,工业中测得的产物中有 、
、 、CO等副产物。
、CO等副产物。
(1)一定温度下,在恒容密闭容器中发生以上反应,下列条件能判断反应达到平衡状态的是___________。
(2)在573K下,向2L恒容密闭容器中通入2mol 和1mol
和1mol  ,反应达到平衡后水蒸气的物质的量分数为0.2。
,反应达到平衡后水蒸气的物质的量分数为0.2。
①上述条件下 的平衡转化率
的平衡转化率
___________ %。
②在上述平衡体系中再加2mol 和2mol
和2mol  ,通过数据说明平衡移动的方向
,通过数据说明平衡移动的方向___________ 。
(3)在不同温度下,向密闭容器甲、乙中分别充入2mol 和1mol
和1mol  ,它们分别在有水分子筛(只允许水分子透过)和无水分子筛条件下反应,测得的
,它们分别在有水分子筛(只允许水分子透过)和无水分子筛条件下反应,测得的 平衡转化率随温度变化关系如图所示。
平衡转化率随温度变化关系如图所示。___________ 。
A.甲 B.乙 C.甲、乙中任一个
②1173K以后平衡转化率变化的原因可能是___________ 。
 能通过高温下与
能通过高温下与 反应进行协同转化处理。反应原理为:
反应进行协同转化处理。反应原理为: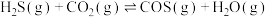 ,工业中测得的产物中有
,工业中测得的产物中有 、
、 、CO等副产物。
、CO等副产物。(1)一定温度下,在恒容密闭容器中发生以上反应,下列条件能判断反应达到平衡状态的是___________。
A.容器内 不再生成 不再生成 | B.容器内压强不再发生变化 |
| C.容器内气体密度不再发生变化 | D. |
(2)在573K下,向2L恒容密闭容器中通入2mol
 和1mol
和1mol  ,反应达到平衡后水蒸气的物质的量分数为0.2。
,反应达到平衡后水蒸气的物质的量分数为0.2。①上述条件下
 的平衡转化率
的平衡转化率
②在上述平衡体系中再加2mol
 和2mol
和2mol  ,通过数据说明平衡移动的方向
,通过数据说明平衡移动的方向(3)在不同温度下,向密闭容器甲、乙中分别充入2mol
 和1mol
和1mol  ,它们分别在有水分子筛(只允许水分子透过)和无水分子筛条件下反应,测得的
,它们分别在有水分子筛(只允许水分子透过)和无水分子筛条件下反应,测得的 平衡转化率随温度变化关系如图所示。
平衡转化率随温度变化关系如图所示。
A.甲 B.乙 C.甲、乙中任一个
②1173K以后平衡转化率变化的原因可能是
您最近一年使用:0次
2024·黑龙江·模拟预测
解题方法
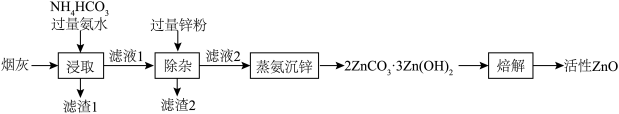
7 . 活性ZnO俗名锌白,用作白色颜料,也广泛用于生产玻璃、橡胶、油漆、塑料等。利用化工厂产生的烟灰(ZnO,还含有少量CuO、MnO2、FeO等杂质)制备活性ZnO的工艺流程如图。
(1)Zn的基态价电子排布式为___________ ,烟灰中的主要成分ZnO发生反应的化学方程式为___________ ,滤渣1的主要成分为___________ 。
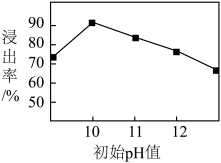
(2)锌元素的浸出率随浸出液初始pH的变化关系如图所示,当浸出液初始pH大于10时,浸出率随pH增大而减小的原因是___________ 。 也能与氨水形成配合物存在于浸出后的滤液中,加入Zn粉可将它置换除去,写出Zn粉和铜氨配合物反应的离子方程式
也能与氨水形成配合物存在于浸出后的滤液中,加入Zn粉可将它置换除去,写出Zn粉和铜氨配合物反应的离子方程式___________ 。
(4)“蒸氨”时会出现白色固体 ,运用平衡移动原理解释原因:
,运用平衡移动原理解释原因:___________ 。
(5)从m kg烟灰中得到活性ZnO akg,则ZnO的回收率___________ (填“小于”、“大于”或“等于”)100%。
(6)已知 和
和 的分解温度分别为125℃、300℃。实验室加热碱式碳酸锌
的分解温度分别为125℃、300℃。实验室加热碱式碳酸锌 时测得的固体残留率随温度的变化关系如图所示。
时测得的固体残留率随温度的变化关系如图所示。___________ (填化学式)。
②经焙解得到的活性ZnO晶胞结构如图所示。该晶胞中Zn原子的配位数为___________ 。
(1)Zn的基态价电子排布式为
(2)锌元素的浸出率随浸出液初始pH的变化关系如图所示,当浸出液初始pH大于10时,浸出率随pH增大而减小的原因是
 也能与氨水形成配合物存在于浸出后的滤液中,加入Zn粉可将它置换除去,写出Zn粉和铜氨配合物反应的离子方程式
也能与氨水形成配合物存在于浸出后的滤液中,加入Zn粉可将它置换除去,写出Zn粉和铜氨配合物反应的离子方程式(4)“蒸氨”时会出现白色固体
 ,运用平衡移动原理解释原因:
,运用平衡移动原理解释原因:(5)从m kg烟灰中得到活性ZnO akg,则ZnO的回收率
(6)已知
 和
和 的分解温度分别为125℃、300℃。实验室加热碱式碳酸锌
的分解温度分别为125℃、300℃。实验室加热碱式碳酸锌 时测得的固体残留率随温度的变化关系如图所示。
时测得的固体残留率随温度的变化关系如图所示。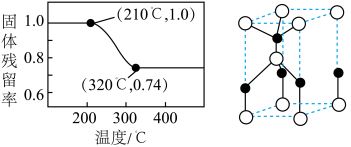
②经焙解得到的活性ZnO晶胞结构如图所示。该晶胞中Zn原子的配位数为
您最近一年使用:0次
8 . 某校化学学习小组探究 与
与 溶液的反应,装置如下图所示,分液漏斗中盛有浓硫酸,锥形瓶中装有
溶液的反应,装置如下图所示,分液漏斗中盛有浓硫酸,锥形瓶中装有 固体。回答下列问题:
固体。回答下列问题:
(1)写出实验中制备 的化学方程式
的化学方程式________ 。
(2)配制100mL
 溶液用到的主要玻璃仪器为烧杯、玻璃棒、胶头滴管和
溶液用到的主要玻璃仪器为烧杯、玻璃棒、胶头滴管和________ 。
【实验探究】
向3mL
 溶液中通入
溶液中通入 ,观察到溶液立即由黄色变成红棕色,放置12小时后,,红棕色消失,溶液变为浅绿色。结合已有知识,针对溶液呈红棕色学习小组提出以下猜想:
,观察到溶液立即由黄色变成红棕色,放置12小时后,,红棕色消失,溶液变为浅绿色。结合已有知识,针对溶液呈红棕色学习小组提出以下猜想:
猜想1: 水解产生了红棕色的
水解产生了红棕色的 胶体;
胶体;
猜想2: 与溶液中某种
与溶液中某种 价含硫微粒形成了红棕色的配合物。
价含硫微粒形成了红棕色的配合物。
(3)为验证上述猜想,甲同学用激光笔照射该红棕色溶液,________ ,证明猜想1不成立。
(4)乙同学查阅文献得知猜想2正确,并设计了下表3组实验,以确定红棕色配合物的配体是 、
、 、
、 中的哪一种(实验均在常温下进行)。
中的哪一种(实验均在常温下进行)。
已知:常温下,溶液中 价含硫微粒物质的量分数随pH变化曲线如图所示。
价含硫微粒物质的量分数随pH变化曲线如图所示。________ (填写微粒符号),依据的实验证据是________ 。
(5)丙同学查阅资料得知:
利用分光光度计可测定溶液中有色物质的吸光度,吸光度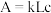 ,其中k为摩尔吸收系数;L为液层厚度即光路长度,在实验中液层厚度保持一致;c为有色物质的浓度。
,其中k为摩尔吸收系数;L为液层厚度即光路长度,在实验中液层厚度保持一致;c为有色物质的浓度。
丙同学经过思考,认为乙同学的实验方案不严谨,除了pH会影响溶液红棕色的深浅,还有一个因素也可能会影响溶液红棕色的深浅。于是设计如下实验进行探究,请帮助该同学完成实验方案,填写下表中空白处。
实验结果讨论:若 ,则该因素不影响溶液红棕色的深浅;若
,则该因素不影响溶液红棕色的深浅;若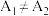 ,则该因素会影响溶液红棕色的深浅。
,则该因素会影响溶液红棕色的深浅。
(6)丁同学查阅资料得知:
配合物在溶液中存在解离平衡,如: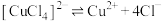 。
。
丁同学设计实验,利用分光光度计测定上述溶液中红棕色物质的吸光度,证明解离平衡的存在。请完成表中内容。
实验限选试剂为: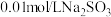 溶液,
溶液,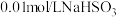 溶液,
溶液, 固体,
固体,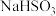 固体
固体
 与
与 溶液的反应,装置如下图所示,分液漏斗中盛有浓硫酸,锥形瓶中装有
溶液的反应,装置如下图所示,分液漏斗中盛有浓硫酸,锥形瓶中装有 固体。回答下列问题:
固体。回答下列问题: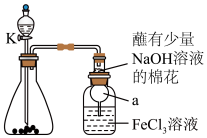
(1)写出实验中制备
 的化学方程式
的化学方程式(2)配制100mL

 溶液用到的主要玻璃仪器为烧杯、玻璃棒、胶头滴管和
溶液用到的主要玻璃仪器为烧杯、玻璃棒、胶头滴管和【实验探究】
向3mL

 溶液中通入
溶液中通入 ,观察到溶液立即由黄色变成红棕色,放置12小时后,,红棕色消失,溶液变为浅绿色。结合已有知识,针对溶液呈红棕色学习小组提出以下猜想:
,观察到溶液立即由黄色变成红棕色,放置12小时后,,红棕色消失,溶液变为浅绿色。结合已有知识,针对溶液呈红棕色学习小组提出以下猜想:猜想1:
 水解产生了红棕色的
水解产生了红棕色的 胶体;
胶体;猜想2:
 与溶液中某种
与溶液中某种 价含硫微粒形成了红棕色的配合物。
价含硫微粒形成了红棕色的配合物。(3)为验证上述猜想,甲同学用激光笔照射该红棕色溶液,
(4)乙同学查阅文献得知猜想2正确,并设计了下表3组实验,以确定红棕色配合物的配体是
 、
、 、
、 中的哪一种(实验均在常温下进行)。
中的哪一种(实验均在常温下进行)。组别 | 溶液1(1mL) | 溶液2(2mL) | 现象 |
a |
|
| 溶液1和溶液2混合后,组别a、b、c所得溶液红棕色依次加深。 |
b |  的饱和溶液,用 的饱和溶液,用 固体调节. 固体调节. | ||
c |  的饱和溶液,用 的饱和溶液,用 固体调节 固体调节 |
 价含硫微粒物质的量分数随pH变化曲线如图所示。
价含硫微粒物质的量分数随pH变化曲线如图所示。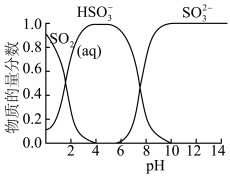
(5)丙同学查阅资料得知:
利用分光光度计可测定溶液中有色物质的吸光度,吸光度
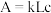 ,其中k为摩尔吸收系数;L为液层厚度即光路长度,在实验中液层厚度保持一致;c为有色物质的浓度。
,其中k为摩尔吸收系数;L为液层厚度即光路长度,在实验中液层厚度保持一致;c为有色物质的浓度。丙同学经过思考,认为乙同学的实验方案不严谨,除了pH会影响溶液红棕色的深浅,还有一个因素也可能会影响溶液红棕色的深浅。于是设计如下实验进行探究,请帮助该同学完成实验方案,填写下表中空白处。
实验序号 | 操作 | 吸光度 |
1 | 把1mL 0.1mol/L 溶液与2mL 溶液与2mL 饱和溶液混合均匀,溶液变成红棕色,测定溶液中红棕色物质的吸光度。 饱和溶液混合均匀,溶液变成红棕色,测定溶液中红棕色物质的吸光度。 |
|
2 |
|
 ,则该因素不影响溶液红棕色的深浅;若
,则该因素不影响溶液红棕色的深浅;若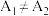 ,则该因素会影响溶液红棕色的深浅。
,则该因素会影响溶液红棕色的深浅。(6)丁同学查阅资料得知:
配合物在溶液中存在解离平衡,如:
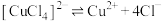 。
。丁同学设计实验,利用分光光度计测定上述溶液中红棕色物质的吸光度,证明解离平衡的存在。请完成表中内容。
实验限选试剂为:
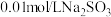 溶液,
溶液,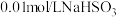 溶液,
溶液, 固体,
固体,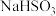 固体
固体实验序号 | 操作 | 吸光度 | 结论 |
3 | 向3mL 0.1mol/L 溶液中通入 溶液中通入 ,溶液立即由黄色变成红棕色,测定溶液中红棕色物质的吸光度 ,溶液立即由黄色变成红棕色,测定溶液中红棕色物质的吸光度 |
| |
4 |
  (填“大于”、“小于”或“等于”) (填“大于”、“小于”或“等于”) | 平衡向 |
您最近一年使用:0次
解题方法
9 . 某小组同学探究铁离子与苯酚的反应。
已知: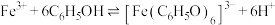 ;
;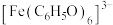 为紫色配合物。
为紫色配合物。
(1)配制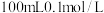 苯酚溶液,需要用到的玻璃仪器有:烧杯、胶头滴管、玻璃棒、
苯酚溶液,需要用到的玻璃仪器有:烧杯、胶头滴管、玻璃棒、__________ 。
(2)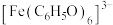 中,提供空轨道用以形成配位键的微粒是
中,提供空轨道用以形成配位键的微粒是__________ ,配位数为__________ 。
(3)探究铁盐种类和pH对苯酚与 显色反应的影响。
显色反应的影响。
查阅资料:
ⅰ. 对苯酚与
对苯酚与 的显色反应无影响;
的显色反应无影响;
ⅱ.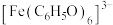 对特定波长光的吸收程度(用吸光度A表示)与
对特定波长光的吸收程度(用吸光度A表示)与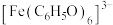 浓度在一定范围内成正比。
浓度在一定范围内成正比。
提出猜想:猜想1: 对苯酚与
对苯酚与 的显色反应有影响
的显色反应有影响
猜想2: 对苯酚与
对苯酚与 的显色反应有影响
的显色反应有影响
猜想3: 对苯酚与
对苯酚与 的显色反应有影响
的显色反应有影响
进行实验:
常温下,用盐酸调节pH,配制得到pH分别为a和b的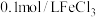 溶液(
溶液( );用硫酸调节pH,配制得到pH分别为a和b的
);用硫酸调节pH,配制得到pH分别为a和b的 溶液。取4支试管各加入
溶液。取4支试管各加入 苯酚溶液,按实验1~4分别再加入0.1mL含
苯酚溶液,按实验1~4分别再加入0.1mL含 的试剂,显色10min后用紫外一可见分光光度计测定该溶液的吸光度(本实验条件下,pH改变对
的试剂,显色10min后用紫外一可见分光光度计测定该溶液的吸光度(本实验条件下,pH改变对 水解程度的影响可忽略)。
水解程度的影响可忽略)。
结果讨论:实验结果为
①根据实验结果,小组同学认为此结果不足以证明猜想3成立的理由是__________________ 。
②为进一步验证猜想,小组同学设计了实验5和6,补充下表中试剂M为__________________ 。(限选试剂:NaCl溶液、 溶液、NaCl固体、
溶液、NaCl固体、 固体)。
固体)。
③根据实验1~6的结果,小组同学得出猜想1不成立,猜想2成立,且 对苯酚与
对苯酚与 的显色反应起抑制作用,得出此结论的依据是:
的显色反应起抑制作用,得出此结论的依据是: 、A1
、A1__________ A6(填“>”“<”或者“=”)。
④根据实验1~6的结果,小组同学得出猜想3成立,且 对
对 与苯酚的显色反应有抑制作用,从化学平衡角度解释其原因是
与苯酚的显色反应有抑制作用,从化学平衡角度解释其原因是______________________________ 。
(4)通过以上实验结论分析:与苯酚相比,对羟基苯甲酸(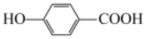 )与
)与 溶液发生显色反应
溶液发生显色反应__________ (填“容易”或“更难”)。
(5)实验室中常用某些配合物的性质进行物质的检验,请举一例子并说明现象____________ 。
已知:
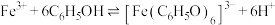 ;
;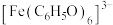 为紫色配合物。
为紫色配合物。(1)配制
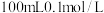 苯酚溶液,需要用到的玻璃仪器有:烧杯、胶头滴管、玻璃棒、
苯酚溶液,需要用到的玻璃仪器有:烧杯、胶头滴管、玻璃棒、(2)
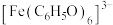 中,提供空轨道用以形成配位键的微粒是
中,提供空轨道用以形成配位键的微粒是(3)探究铁盐种类和pH对苯酚与
 显色反应的影响。
显色反应的影响。查阅资料:
ⅰ.
 对苯酚与
对苯酚与 的显色反应无影响;
的显色反应无影响;ⅱ.
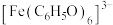 对特定波长光的吸收程度(用吸光度A表示)与
对特定波长光的吸收程度(用吸光度A表示)与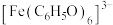 浓度在一定范围内成正比。
浓度在一定范围内成正比。提出猜想:猜想1:
 对苯酚与
对苯酚与 的显色反应有影响
的显色反应有影响猜想2:
 对苯酚与
对苯酚与 的显色反应有影响
的显色反应有影响猜想3:
 对苯酚与
对苯酚与 的显色反应有影响
的显色反应有影响进行实验:
常温下,用盐酸调节pH,配制得到pH分别为a和b的
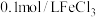 溶液(
溶液( );用硫酸调节pH,配制得到pH分别为a和b的
);用硫酸调节pH,配制得到pH分别为a和b的 溶液。取4支试管各加入
溶液。取4支试管各加入 苯酚溶液,按实验1~4分别再加入0.1mL含
苯酚溶液,按实验1~4分别再加入0.1mL含 的试剂,显色10min后用紫外一可见分光光度计测定该溶液的吸光度(本实验条件下,pH改变对
的试剂,显色10min后用紫外一可见分光光度计测定该溶液的吸光度(本实验条件下,pH改变对 水解程度的影响可忽略)。
水解程度的影响可忽略)。
| 序号 | 含 | 吸光度 | |
|
| |||
1 |
| / | A1 | |
2 |
| / | A2 | |
3 | / |
| A3 | |
4 | / |
| A4 | |

①根据实验结果,小组同学认为此结果不足以证明猜想3成立的理由是
②为进一步验证猜想,小组同学设计了实验5和6,补充下表中试剂M为
 溶液、NaCl固体、
溶液、NaCl固体、 固体)。
固体)。
| 序号 | 含 | 再加入的试剂 | 吸光度 | |
|
| ||||
5 | / |
| NaCl固体 | A5 | |
6 |
| / | 试剂M | A6 | |
 对苯酚与
对苯酚与 的显色反应起抑制作用,得出此结论的依据是:
的显色反应起抑制作用,得出此结论的依据是: 、A1
、A1④根据实验1~6的结果,小组同学得出猜想3成立,且
 对
对 与苯酚的显色反应有抑制作用,从化学平衡角度解释其原因是
与苯酚的显色反应有抑制作用,从化学平衡角度解释其原因是(4)通过以上实验结论分析:与苯酚相比,对羟基苯甲酸(
 )与
)与 溶液发生显色反应
溶液发生显色反应(5)实验室中常用某些配合物的性质进行物质的检验,请举一例子并说明现象
您最近一年使用:0次
10 . 石油化工、煤化工等行业的废气中均含有硫化氢,需要将其回收处理并利用。
(1)热分解法: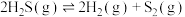
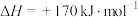 ,工业上,通常在等温、等用条件下将
,工业上,通常在等温、等用条件下将 与Ar的混合气体通入反应器,发生
与Ar的混合气体通入反应器,发生 热分解反应,达到平衡状态后,若继续向反应器中通入Ar,
热分解反应,达到平衡状态后,若继续向反应器中通入Ar, 的平衡转化率会
的平衡转化率会___________ (填“增大”、“减小”或“不变”)。
(2)氧化法: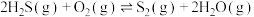
已知: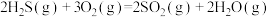
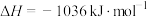
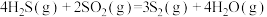
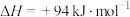
无催化剂条件下,混合加热 与
与 ,探究相同时间内
,探究相同时间内 (g)产率影响因素。
(g)产率影响因素。
①用氧化法处理 ,若生成1mol
,若生成1mol  (g),放出热量为
(g),放出热量为___________ kJ。
②其他条件相同时, 产率随温度的变化如图所示。随着温度升高,
产率随温度的变化如图所示。随着温度升高, (g)产率先增大后减小,原因是
(g)产率先增大后减小,原因是___________ 。
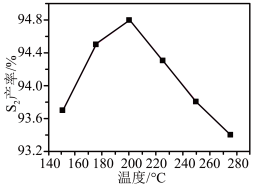
③其他条件相同时, (g)产率随
(g)产率随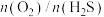 值的变化如图所示。
值的变化如图所示。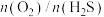 值过高不利于提高
值过高不利于提高 (g)产率,可能的原因是
(g)产率,可能的原因是___________ 。
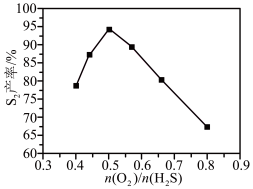
(3)微电池法:利用电化学原理去除天然气中的 ,装置如图所示,总反应是:
,装置如图所示,总反应是: 。
。
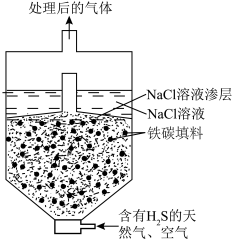
①写出负极的电极反应式___________ 。
②一段时间后,单位时间内 的去除率降低,其可能的原因是
的去除率降低,其可能的原因是___________ 。
(4)硫酸钙吸收法:如图为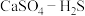 反应体系在不同温度、不同
反应体系在不同温度、不同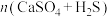 物质的量比的物相变化图。
物质的量比的物相变化图。
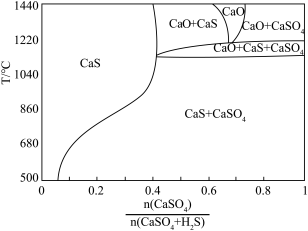
①用斜线在图中画出 可以完全转化并且有CaO生成的区域
可以完全转化并且有CaO生成的区域___________ 。
②若不通入 ,简述
,简述 随温度升高分解的规律
随温度升高分解的规律___________ 。
(1)热分解法:
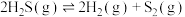
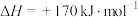 ,工业上,通常在等温、等用条件下将
,工业上,通常在等温、等用条件下将 与Ar的混合气体通入反应器,发生
与Ar的混合气体通入反应器,发生 热分解反应,达到平衡状态后,若继续向反应器中通入Ar,
热分解反应,达到平衡状态后,若继续向反应器中通入Ar, 的平衡转化率会
的平衡转化率会(2)氧化法:
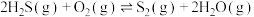
已知:
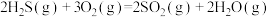
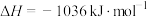
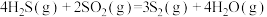
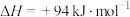
无催化剂条件下,混合加热
 与
与 ,探究相同时间内
,探究相同时间内 (g)产率影响因素。
(g)产率影响因素。①用氧化法处理
 ,若生成1mol
,若生成1mol  (g),放出热量为
(g),放出热量为②其他条件相同时,
 产率随温度的变化如图所示。随着温度升高,
产率随温度的变化如图所示。随着温度升高, (g)产率先增大后减小,原因是
(g)产率先增大后减小,原因是
③其他条件相同时,
 (g)产率随
(g)产率随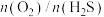 值的变化如图所示。
值的变化如图所示。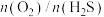 值过高不利于提高
值过高不利于提高 (g)产率,可能的原因是
(g)产率,可能的原因是
(3)微电池法:利用电化学原理去除天然气中的
 ,装置如图所示,总反应是:
,装置如图所示,总反应是: 。
。
①写出负极的电极反应式
②一段时间后,单位时间内
 的去除率降低,其可能的原因是
的去除率降低,其可能的原因是(4)硫酸钙吸收法:如图为
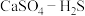 反应体系在不同温度、不同
反应体系在不同温度、不同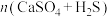 物质的量比的物相变化图。
物质的量比的物相变化图。
①用斜线在图中画出
 可以完全转化并且有CaO生成的区域
可以完全转化并且有CaO生成的区域②若不通入
 ,简述
,简述 随温度升高分解的规律
随温度升高分解的规律
您最近一年使用:0次

 溶液
溶液