1 . 甲醇是一种可再生的清洁能源,二氧化碳催化加氢制甲醇,有利于实现“碳达峰”、“碳中和”。已知有关 的热化学方程式如下:
的热化学方程式如下:
Ⅰ. ,
,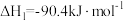 ;
;
Ⅱ. ,
, ;
;
Ⅲ. ,
,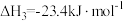 ;
;
Ⅳ. ,
,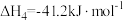 ;
;
请回答下列问题:
(1)

_______ 。
(2)在体积一定的密闭容器中按物质的量比1:2充入CO和 ,发生上述反应Ⅰ,充分反应达平衡后,如图是平衡混合物中
,发生上述反应Ⅰ,充分反应达平衡后,如图是平衡混合物中 的体积分数在不同压强下随温度变化的平衡曲线。
的体积分数在不同压强下随温度变化的平衡曲线。 ,温度为300℃时,反应Ⅰ的压强平衡常数
,温度为300℃时,反应Ⅰ的压强平衡常数
_______ 。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
②反应Ⅰ达平衡后,下列措施能提高 产率的是
产率的是_______ (填字母)。
A.加入适量一氧化碳 B.升高温度 C.使用高效催化剂 D.增大压强
(3)一定温度下,向容积为1L的恒容密闭容器中,充入 和
和 ,发生上述反应Ⅱ,测得各物质的物质的量浓度变化如图所示:
,发生上述反应Ⅱ,测得各物质的物质的量浓度变化如图所示:_______ 的浓度随时间的变化; 内,
内, 的平均反应速率为
的平均反应速率为_______  。
。
(4)对于反应Ⅲ,其速率方程式为 ,
, ,
, ,
, 为速率常数且只与温度有关,则该反应的平衡常数
为速率常数且只与温度有关,则该反应的平衡常数
_______ (用含 、
、 的代数式表示)。
的代数式表示)。
已知某温度下,上述反应平衡常数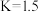 ,在密闭容器中充入一定物质的量的
,在密闭容器中充入一定物质的量的 ,反应到某时刻测得各组分的物质的量如下:
,反应到某时刻测得各组分的物质的量如下:
此时正、逆反应速率的大小:
_______  。
。
 的热化学方程式如下:
的热化学方程式如下:Ⅰ.
 ,
,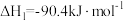 ;
;Ⅱ.
 ,
, ;
;Ⅲ.
 ,
,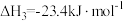 ;
;Ⅳ.
 ,
,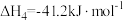 ;
;请回答下列问题:
(1)


(2)在体积一定的密闭容器中按物质的量比1:2充入CO和
 ,发生上述反应Ⅰ,充分反应达平衡后,如图是平衡混合物中
,发生上述反应Ⅰ,充分反应达平衡后,如图是平衡混合物中 的体积分数在不同压强下随温度变化的平衡曲线。
的体积分数在不同压强下随温度变化的平衡曲线。
 ,温度为300℃时,反应Ⅰ的压强平衡常数
,温度为300℃时,反应Ⅰ的压强平衡常数
②反应Ⅰ达平衡后,下列措施能提高
 产率的是
产率的是A.加入适量一氧化碳 B.升高温度 C.使用高效催化剂 D.增大压强
(3)一定温度下,向容积为1L的恒容密闭容器中,充入
 和
和 ,发生上述反应Ⅱ,测得各物质的物质的量浓度变化如图所示:
,发生上述反应Ⅱ,测得各物质的物质的量浓度变化如图所示: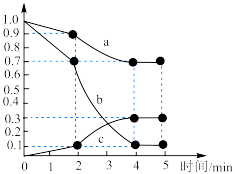
 内,
内, 的平均反应速率为
的平均反应速率为 。
。(4)对于反应Ⅲ,其速率方程式为
 ,
, ,
, ,
, 为速率常数且只与温度有关,则该反应的平衡常数
为速率常数且只与温度有关,则该反应的平衡常数
 、
、 的代数式表示)。
的代数式表示)。已知某温度下,上述反应平衡常数
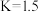 ,在密闭容器中充入一定物质的量的
,在密闭容器中充入一定物质的量的 ,反应到某时刻测得各组分的物质的量如下:
,反应到某时刻测得各组分的物质的量如下:| 物质 |  |  | 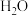 |
| 物质的量/mol | 0.2 | 0.2 | 0.2 |

 。
。
您最近半年使用:0次
解题方法
2 . 水热法制备 的流程如图,下列叙述正确的是
的流程如图,下列叙述正确的是
 的流程如图,下列叙述正确的是
的流程如图,下列叙述正确的是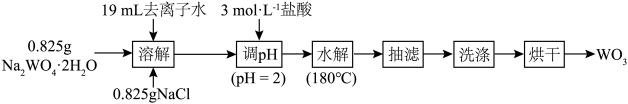
| A.本实验使用托盘天平称量 | B. 作反应的氧化剂 作反应的氧化剂 |
C.调 为2的目的是促进反应完全 为2的目的是促进反应完全 | D.用 溶液检验产品是否洗净 溶液检验产品是否洗净 |
您最近半年使用:0次
名校
3 . 一种从某钒矿石(主要成分为 、
、 、
、 和
和 )中提钒的工艺流程如图所示。已知
)中提钒的工艺流程如图所示。已知 能够萃取溶液中的
能够萃取溶液中的 ,且萃取
,且萃取 的原理为
的原理为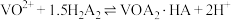 。下列说法正确的是
。下列说法正确的是
 、
、 、
、 和
和 )中提钒的工艺流程如图所示。已知
)中提钒的工艺流程如图所示。已知 能够萃取溶液中的
能够萃取溶液中的 ,且萃取
,且萃取 的原理为
的原理为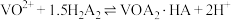 。下列说法正确的是
。下列说法正确的是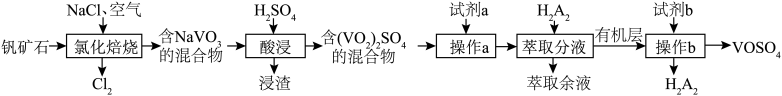
A.试剂a可选用的是 、 、 、 、 等 等 |
B.试剂b可选用的是KOH、NaOH、 等 等 |
| C.“酸浸”“操作b”的过程中均有氧化还原反应发生 |
| D.“操作b”使用的主要玻璃仪器有分液漏斗、烧杯 |
您最近半年使用:0次
4 . 对下列实验操作的相关现象预测和所得的结论均正确的是
选项 | 实验操作 | 现象预测 | 结论 |
A | 向  黄色溶液中滴5~10滴 黄色溶液中滴5~10滴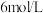  溶液 溶液 | 溶液颜色由黄色变为橙色 | 增大反应物浓度,平衡正向移动 |
B | 取适量食品包装袋中的抗氧化“铁粉包”样品,滴加适量稀硝酸溶解,再滴加几滴 溶液 溶液 | 溶液变红色 | 该铁粉已经完全被空气氧化 |
C | 向  溶液中滴加 溶液中滴加  溶液 溶液 | 有白色沉淀生成 |
|
D | 将3g铜片和适量稀 混合 混合 | 管口有红棕色气体 | 稀硝酸被Cu还原为 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
解题方法
5 . 科学家设计了一种新型 金属框架,可通过静电作用选择性吸附氨气,对于捕捉氨气效果良好。
金属框架,可通过静电作用选择性吸附氨气,对于捕捉氨气效果良好。 和另一种材料
和另一种材料 均可用于除去有害气体
均可用于除去有害气体 ,
, 的孔径大小和形状恰能选择性固定
的孔径大小和形状恰能选择性固定 (如图所示)。
(如图所示)。 分子构型与乙烯类似。
分子构型与乙烯类似。
① ;
;
② 。
。
下列关于二者净化气体的说法中,正确的一项是
 金属框架,可通过静电作用选择性吸附氨气,对于捕捉氨气效果良好。
金属框架,可通过静电作用选择性吸附氨气,对于捕捉氨气效果良好。 和另一种材料
和另一种材料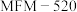 均可用于除去有害气体
均可用于除去有害气体 ,
,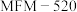 的孔径大小和形状恰能选择性固定
的孔径大小和形状恰能选择性固定 (如图所示)。
(如图所示)。
 分子构型与乙烯类似。
分子构型与乙烯类似。①
 ;
;②
 。
。下列关于二者净化气体的说法中,正确的一项是
A.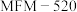 捕获的气体所有原子共平面, 捕获的气体所有原子共平面, 捕获的气体空间构型为正四面体 捕获的气体空间构型为正四面体 |
B.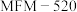 置入废气后,废气颜色变深, 置入废气后,废气颜色变深, 置入废气后,废气颜色变浅 置入废气后,废气颜色变浅 |
C.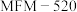 适宜在较低温度下净化气体, 适宜在较低温度下净化气体, 适宜在较高温度下净化气体 适宜在较高温度下净化气体 |
D.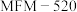 适宜在较高压强下净化气体, 适宜在较高压强下净化气体, 适宜在较低压强下净化气体 适宜在较低压强下净化气体 |
您最近半年使用:0次
7日内更新
|
81次组卷
|
2卷引用:安徽师范大学附属中学2024届高三下学期5月测试化学试卷
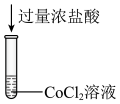
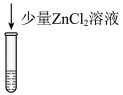
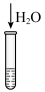
6 . 某小组对 的性质进行探究,实验操作及现象如下,下列说法不正确的是
的性质进行探究,实验操作及现象如下,下列说法不正确的是
资料:
 的性质进行探究,实验操作及现象如下,下列说法不正确的是
的性质进行探究,实验操作及现象如下,下列说法不正确的是资料:
| 物质 |  |  |  | ||||
| 溶液中的颜色 | 粉红色 | 蓝色 | 无色 | ||||
| 操作 |
| 将a中得到的蓝色溶液均分为3份,分别倒入试管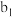 、 、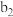 、 、 中 中 | |||||
 |
 |
 | |||||
| 现象 | a中现象:加入浓盐酸后,溶液由粉红色变为蓝色 | 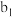 中现象:溶液变为粉红色 中现象:溶液变为粉红色 | 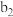 中现象 中现象 | 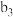 中现象 中现象 | |||
A.试管a中存在平衡: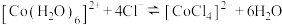 |
B.由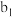 中现象可推测稳定性: 中现象可推测稳定性: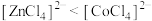 |
C.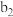 中现象可能为产生白色沉淀 中现象可能为产生白色沉淀 |
D.推测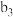 中现象为溶液变为粉红色,因为加入水使各组分离子浓度变化,平衡移动 中现象为溶液变为粉红色,因为加入水使各组分离子浓度变化,平衡移动 |
您最近半年使用:0次
7 . CH3CHO在NaOH溶液作用下制取2-丁烯醛的历程如下:
下列说法不正确 的是

下列说法
| A.OH-是该反应的催化剂 |
B.CH3CHO分子中甲基上的“ ”比 ”比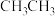 中的“ 中的“ ”更易电离出H+ ”更易电离出H+ |
| C.反应(4)加热失水有利于反应(3)平衡正向移动 |
| D.CH3CHO与CH3CH2CHO的混合液在NaOH溶液作用下最多可得到2种羟基醛 |
您最近半年使用:0次
8 . 大气中 能通过高温下与
能通过高温下与 反应进行协同转化处理。反应原理为:
反应进行协同转化处理。反应原理为: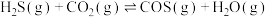 ,工业中测得的产物中有
,工业中测得的产物中有 、
、 、CO等副产物。
、CO等副产物。
(1)一定温度下,在恒容密闭容器中发生以上反应,下列条件能判断反应达到平衡状态的是___________。
(2)在573K下,向2L恒容密闭容器中通入2mol 和1mol
和1mol  ,反应达到平衡后水蒸气的物质的量分数为0.2。
,反应达到平衡后水蒸气的物质的量分数为0.2。
①上述条件下 的平衡转化率
的平衡转化率
___________ %。
②在上述平衡体系中再加2mol 和2mol
和2mol  ,通过数据说明平衡移动的方向
,通过数据说明平衡移动的方向___________ 。
(3)在不同温度下,向密闭容器甲、乙中分别充入2mol 和1mol
和1mol  ,它们分别在有水分子筛(只允许水分子透过)和无水分子筛条件下反应,测得的
,它们分别在有水分子筛(只允许水分子透过)和无水分子筛条件下反应,测得的 平衡转化率随温度变化关系如图所示。
平衡转化率随温度变化关系如图所示。___________ 。
A.甲 B.乙 C.甲、乙中任一个
②1173K以后平衡转化率变化的原因可能是___________ 。
 能通过高温下与
能通过高温下与 反应进行协同转化处理。反应原理为:
反应进行协同转化处理。反应原理为: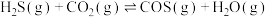 ,工业中测得的产物中有
,工业中测得的产物中有 、
、 、CO等副产物。
、CO等副产物。(1)一定温度下,在恒容密闭容器中发生以上反应,下列条件能判断反应达到平衡状态的是___________。
A.容器内 不再生成 不再生成 | B.容器内压强不再发生变化 |
| C.容器内气体密度不再发生变化 | D. |
(2)在573K下,向2L恒容密闭容器中通入2mol
 和1mol
和1mol  ,反应达到平衡后水蒸气的物质的量分数为0.2。
,反应达到平衡后水蒸气的物质的量分数为0.2。①上述条件下
 的平衡转化率
的平衡转化率
②在上述平衡体系中再加2mol
 和2mol
和2mol  ,通过数据说明平衡移动的方向
,通过数据说明平衡移动的方向(3)在不同温度下,向密闭容器甲、乙中分别充入2mol
 和1mol
和1mol  ,它们分别在有水分子筛(只允许水分子透过)和无水分子筛条件下反应,测得的
,它们分别在有水分子筛(只允许水分子透过)和无水分子筛条件下反应,测得的 平衡转化率随温度变化关系如图所示。
平衡转化率随温度变化关系如图所示。
A.甲 B.乙 C.甲、乙中任一个
②1173K以后平衡转化率变化的原因可能是
您最近半年使用:0次
2024·黑龙江·模拟预测
解题方法
9 . 氢能是一种极具发展潜能的清洁能源。对于可逆反应:
 ,在容积恒为2L的密闭容器中,将2.0molC0与8.0molH2混合加热到830℃发生上述反应,5min时达到平衡,CO的转化率是80%。实验发现,其他条件不变,在相同时间内,向上述体系中投入一定量的CaO可以增大H2的体积分数。选用相同质量、不同粒径的CaO固体进行实验时,对比实验的结果如图所示。下列叙述中错误的是
,在容积恒为2L的密闭容器中,将2.0molC0与8.0molH2混合加热到830℃发生上述反应,5min时达到平衡,CO的转化率是80%。实验发现,其他条件不变,在相同时间内,向上述体系中投入一定量的CaO可以增大H2的体积分数。选用相同质量、不同粒径的CaO固体进行实验时,对比实验的结果如图所示。下列叙述中错误的是

 ,在容积恒为2L的密闭容器中,将2.0molC0与8.0molH2混合加热到830℃发生上述反应,5min时达到平衡,CO的转化率是80%。实验发现,其他条件不变,在相同时间内,向上述体系中投入一定量的CaO可以增大H2的体积分数。选用相同质量、不同粒径的CaO固体进行实验时,对比实验的结果如图所示。下列叙述中错误的是
,在容积恒为2L的密闭容器中,将2.0molC0与8.0molH2混合加热到830℃发生上述反应,5min时达到平衡,CO的转化率是80%。实验发现,其他条件不变,在相同时间内,向上述体系中投入一定量的CaO可以增大H2的体积分数。选用相同质量、不同粒径的CaO固体进行实验时,对比实验的结果如图所示。下列叙述中错误的是
| A.微米CaO和纳米CaO对平衡影响不同主要是CaO作为催化剂表面积越大,反应的速率越快 |
B.在生产中,增大 的用量可同时提高CO的转化率和 的用量可同时提高CO的转化率和 的产率 的产率 |
C.5min内的平均反应速率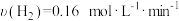 |
| D.平衡时间容器中通入He增大压强,平衡不移动 |
您最近半年使用:0次
名校
10 . 利用CO2合成二甲醚的原理为2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) ∆H,其中投料比
CH3OCH3(g)+3H2O(g) ∆H,其中投料比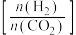 (取值为2、3、4)和温度与CO2的平衡转化率的关系如图所示
(取值为2、3、4)和温度与CO2的平衡转化率的关系如图所示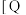 点c(CO2)= 0.2mol·L-1。下列说法正确的是
点c(CO2)= 0.2mol·L-1。下列说法正确的是
 CH3OCH3(g)+3H2O(g) ∆H,其中投料比
CH3OCH3(g)+3H2O(g) ∆H,其中投料比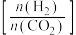 (取值为2、3、4)和温度与CO2的平衡转化率的关系如图所示
(取值为2、3、4)和温度与CO2的平衡转化率的关系如图所示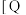 点c(CO2)= 0.2mol·L-1。下列说法正确的是
点c(CO2)= 0.2mol·L-1。下列说法正确的是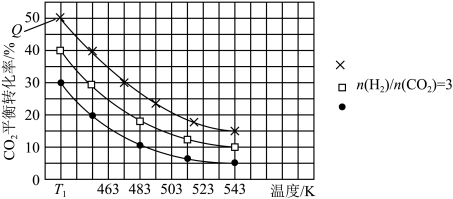
| A.T1K时,Kc=0.0675 | B.△H>0 |
C.X表示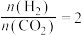 | D.催化剂可以改变CO2的平衡转化率 |
您最近半年使用:0次

 与
与 发生了双水解
发生了双水解