真题
名校
1 . 某小组进行实验,向 蒸馏水中加入
蒸馏水中加入 ,充分振荡,溶液呈浅棕色,再加入
,充分振荡,溶液呈浅棕色,再加入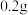 锌粒,溶液颜色加深;最终紫黑色晶体消失,溶液褪色。已知
锌粒,溶液颜色加深;最终紫黑色晶体消失,溶液褪色。已知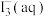 为棕色,下列关于颜色变化的解释错误的是
为棕色,下列关于颜色变化的解释错误的是
 蒸馏水中加入
蒸馏水中加入 ,充分振荡,溶液呈浅棕色,再加入
,充分振荡,溶液呈浅棕色,再加入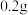 锌粒,溶液颜色加深;最终紫黑色晶体消失,溶液褪色。已知
锌粒,溶液颜色加深;最终紫黑色晶体消失,溶液褪色。已知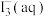 为棕色,下列关于颜色变化的解释错误的是
为棕色,下列关于颜色变化的解释错误的是| 选项 | 颜色变化 | 解释 |
| A | 溶液呈浅棕色 |  在水中溶解度较小 在水中溶解度较小 |
| B | 溶液颜色加深 | 发生了反应: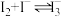 |
| C | 紫黑色晶体消失 |  ( ( )的消耗使溶解平衡 )的消耗使溶解平衡 右移 右移 |
| D | 溶液褪色 |  与有色物质发生了置换反应 与有色物质发生了置换反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-06-13更新
|
8437次组卷
|
19卷引用:福建省福州第三中学2023-2024学年高三下学期第十六次检测(三模)化学试题
福建省福州第三中学2023-2024学年高三下学期第十六次检测(三模)化学试题2024年中国人民大学附属中学高三下学期高考化学模拟练习试卷(六)2023年高考辽宁卷化学真题(已下线)T13-实验方案的设计与评价(已下线)2023年高考化学真题完全解读(辽宁卷)(已下线)考点09 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第11讲 氯气和卤族元素(已下线)专题08 反应速率与化学平衡-2023年高考化学真题题源解密(新高考专用)(已下线)专题05 化学实验基础-2023年高考化学真题题源解密(全国通用)(已下线)考点14 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)实验03 探究外界条件对化学平衡移动的影响-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)浙江省杭州第十四中学2023-2024学年高二上学期 期中考试化学试卷(已下线)第3讲 物质制备实验的设计与评价10-2023新东方高二上期中考化学中国人民大学附属中学2023-2024学年高三下学期化学练习6湖北省鄂东新领先协作体2023-2024学年高二下学期3月联考化学试题(已下线)FHgkyldyjhx10(已下线)测试辽宁化学 请勿下载
2 . 某兴趣小组用铬铁矿[Fe(CrO2)2]制备K2Cr2O7晶体,流程如下:
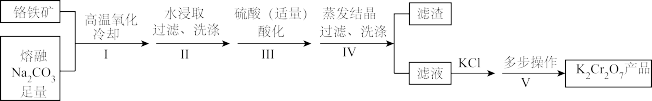
已知:4Fe (CrO2)2 + 10Na2CO3+7O2 8Na2CrO4 +4NaFeO2+10CO2
8Na2CrO4 +4NaFeO2+10CO2
2H++2CrO
 Cr2O
Cr2O +H2O
+H2O
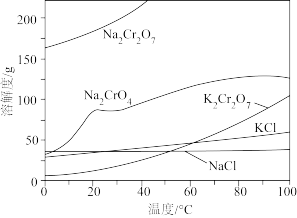
相关物质的溶解度随温度变化如下图。
请回答:
(1)步骤I,将铬铁矿粉碎有利于加快高温氧化的速率,其理由是______ 。
(2)下列说法正确的是______ 。
A.步骤II,低温可提高浸取率
B.步骤II,过滤可除去NaFeO2水解产生的Fe(OH)3
C.步骤III,酸化的目的主要是使Na2CrO4转变为Na2Cr2O7
D.步骤IV,所得滤渣的主要成分是Na2SO4和Na2CO3
(3)步骤V,重结晶前,为了得到杂质较少的K2Cr2O7粗产品,从下列选项中选出合理的操作(操作不能重复使用)并排序:溶解KCl →______ →______ →______ →______ →重结晶。
a.50℃蒸发溶剂;
b.100℃ 蒸发溶剂;
c.抽滤;
d.冷却至室温;
e.蒸发至溶液出现晶膜,停止加热;
f.蒸发至溶液中出现大量晶体,停止加热。
(4)为了测定K2Cr2O7产品的纯度,可采用氧化还原滴定法。
①下列关于滴定分析的操作,不正确的是______ 。
A.用量筒量取25.00mL待测液转移至锥形瓶
B.滴定时要适当控制滴定速度
C.滴定时应一直观察滴定管中溶液体积的变化
D.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
E.平行滴定时,须重新装液并调节液面至“0”刻度或“0”刻度以下
②在接近终点时,使用“半滴操作”可提高测量的准确度。其方法是:将旋塞稍稍转动,使半滴溶液悬于管口,用锥形瓶内壁将半滴溶液沾落,______ 继续摇动锥形瓶,观察颜色变化。(请在横线上补全操作)
(5)该小组用滴定法准确测得产品中K2Cr2O7的质量分数为98.50%。某同学还用分光光度法测定产品纯度(K2Cr2O7溶液的吸光度与其浓度成正比例),但测得的质量分数明显偏低。分析其原因,发现配制K2Cr2O7待测水溶液时少加了一种试剂。该试剂是______ ,添加该试剂的理由是______ 。
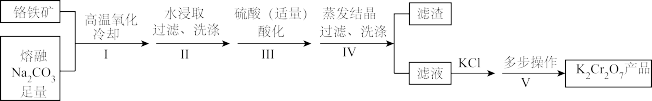
已知:4Fe (CrO2)2 + 10Na2CO3+7O2
 8Na2CrO4 +4NaFeO2+10CO2
8Na2CrO4 +4NaFeO2+10CO22H++2CrO

 Cr2O
Cr2O +H2O
+H2O相关物质的溶解度随温度变化如下图。

请回答:
(1)步骤I,将铬铁矿粉碎有利于加快高温氧化的速率,其理由是
(2)下列说法正确的是
A.步骤II,低温可提高浸取率
B.步骤II,过滤可除去NaFeO2水解产生的Fe(OH)3
C.步骤III,酸化的目的主要是使Na2CrO4转变为Na2Cr2O7
D.步骤IV,所得滤渣的主要成分是Na2SO4和Na2CO3
(3)步骤V,重结晶前,为了得到杂质较少的K2Cr2O7粗产品,从下列选项中选出合理的操作(操作不能重复使用)并排序:溶解KCl →
a.50℃蒸发溶剂;
b.100℃ 蒸发溶剂;
c.抽滤;
d.冷却至室温;
e.蒸发至溶液出现晶膜,停止加热;
f.蒸发至溶液中出现大量晶体,停止加热。
(4)为了测定K2Cr2O7产品的纯度,可采用氧化还原滴定法。
①下列关于滴定分析的操作,不正确的是
A.用量筒量取25.00mL待测液转移至锥形瓶
B.滴定时要适当控制滴定速度
C.滴定时应一直观察滴定管中溶液体积的变化
D.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
E.平行滴定时,须重新装液并调节液面至“0”刻度或“0”刻度以下
②在接近终点时,使用“半滴操作”可提高测量的准确度。其方法是:将旋塞稍稍转动,使半滴溶液悬于管口,用锥形瓶内壁将半滴溶液沾落,
(5)该小组用滴定法准确测得产品中K2Cr2O7的质量分数为98.50%。某同学还用分光光度法测定产品纯度(K2Cr2O7溶液的吸光度与其浓度成正比例),但测得的质量分数明显偏低。分析其原因,发现配制K2Cr2O7待测水溶液时少加了一种试剂。该试剂是
您最近一年使用:0次
2021-01-09更新
|
8511次组卷
|
16卷引用:2021年1月浙江高考化学试题变式题26-31
(已下线)2021年1月浙江高考化学试题变式题26-31天津市咸水沽第一中学2023届高三上学期第一次模拟考试化学试题浙江省金华市曙光学校2021-2022学年高三下学期5月模拟考试化学试题2021年1月新高考浙江化学高考真题(已下线)大题02 化学工艺流程题(二)-【考前抓大题】备战2021年高考化学(全国通用)(已下线)解密12 实验化学(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)天津市天津一中2020-2021学年高三第二学期五月月考化学试题(已下线)考点31 物质的制备 定量分析-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点31 化学实验与工艺流程-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考向09 工艺流程初探-备战2022年高考化学一轮复习考点微专题(已下线)专题21.化学工艺流程分析-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)解密13 实验化学(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)微专题27 化学工艺流程题-----物质的分离与提纯-备战2023年高考化学一轮复习考点微专题(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
3 . 已知: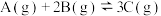
 ,向一恒温恒容的密闭容器中充入
,向一恒温恒容的密闭容器中充入 和
和 发生反应,
发生反应, 时达到平衡状态I,在
时达到平衡状态I,在 时改变某一条件,
时改变某一条件, 时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是
时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是
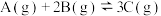
 ,向一恒温恒容的密闭容器中充入
,向一恒温恒容的密闭容器中充入 和
和 发生反应,
发生反应, 时达到平衡状态I,在
时达到平衡状态I,在 时改变某一条件,
时改变某一条件, 时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是
时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是
| A.容器内压强不变,表明反应达到平衡 |
B. 时改变的条件:向容器中加入C 时改变的条件:向容器中加入C |
C.平衡时A的体积分数 : :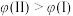 |
D.平衡常数K: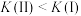 |
您最近一年使用:0次
2021-06-09更新
|
9306次组卷
|
49卷引用:2021年湖南省高考化学试卷变式题11-19
2021年湖南省高考化学试卷变式题11-192021年新高考湖南化学高考真题山东省临沂市沂水县第一中学2020-2021学年高二下学期期末检测化学试题(已下线)考点18 化学平衡状态 化学平衡移动-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点18 化学平衡状态 化学平衡移动-备战2022年高考化学一轮复习考点帮(浙江专用)河北省衡水中学2021-2022学年高二上学期8月份线上调研化学试题(已下线)课时38 化学平衡常规图像-2022年高考化学一轮复习小题多维练(全国通用)(已下线)第20讲 化学平衡常数及转化率的计算(讲) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)第19讲 化学平衡(讲) — 2022年高考化学一轮复习讲练测(新教材新高考)湖南省常德市第一中学2021-2022学年高二上学期第一次月考化学试题(已下线)专题10 化学反应速率与化学平衡-备战2022年高考化学学霸纠错(全国通用)(已下线)解密09 化学反应速率与化学平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密09 化学反应速率与化学平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题12 化学反应速率与化学平衡-2022年高考化学二轮复习重点专题常考点突破练河南省郑州市第四高级中学2021-2022学年高二下学期第二次调研考试化学试题(已下线)秘籍07 化学反应速率及平衡图象剖析-备战2022年高考化学抢分秘籍(全国通用)(已下线)押新高考卷09题 速率和平衡-备战2022年高考化学临考题号押题(新高考通版)(已下线)回归教材重难点06 化学反应速率与化学平衡-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)回归教材重难点07 图像数据和结果的分析-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)专题09 化学反应速率、化学平衡-三年(2020-2022)高考真题分项汇编广东省揭阳市普宁市华侨中学2021-2022学年高二下学期第三次月考化学试题(已下线)考点22 化学平衡状态与化学平衡移动-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点25 化学反应速率与平衡图象-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第27练 化学平衡-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第22讲 化学平衡常数及转化率的计算(练)-2023年高考化学一轮复习讲练测(全国通用)第二章 综合拔高练(已下线)第20讲 化学平衡常数及转化率的计算(讲)-2023年高考化学一轮复习讲练测(新教材新高考)湖南省宁远县第一中学2022-2023学年高二上学期第一次适应性考试化学试题湖南省湘潭凤凰中学2022-2023学年高二上学期10月月考化学试题贵州省黔东南州凯里市第一中学2022-2023学年高二上学期期中考试化学试题湖南省长沙市长郡中学2022-2023学年高二上学期期中考试化学试题湖南省临湘市第五中学2021-2022学年高二上学期第三次月考化学试题安徽省桐城中学2022-2023学年高二上学期月考(1)化学试题湖南省郴州市永兴县童星学校2022-2023学年高二上学期9月月考化学试题河南省郑州市2021-2022学年高二上学期期末考试化学试题湖南省怀化市第三中学2022-2023学年高二上学期期中考试化学试题湖南省株洲市第二中学2022-2023学年高二上学期期中考试化学试题(已下线)专题09 化学反应速率与化学平衡(练)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)专题17 化学平衡图表分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)化学反应速率与化学平衡——进阶学习(已下线)题型124 突破化学反应速率和化学平衡图像题(已下线)专题15 化学平衡图像-2023年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)(已下线)题型23 平衡常数、平衡转化率图象(已下线)专题08 反应速率与化学平衡-2023年高考化学真题题源解密(新高考专用)(已下线)专题11 化学反应速率与化学平衡-2023年高考化学真题题源解密(全国通用)(已下线)考点25 化学反应速率与平衡图象(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点3 化学平衡常数及转化率的计算(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)山东省青岛莱西市2022-2023学年高二上学期期中考试化学试题河南省周口恒大中学2023-2024学年高三下学期4月期中考试化学试题
4 . NO2和N2O4存在平衡:2NO2(g)⇌N2O4(g) △H<0。下列分析正确的是
| A.1 mol平衡混合气体中含1 mol N原子 |
| B.断裂2 mol NO2中的共价键所需能量小于断裂1 mol N2O4中的共价键所需能量 |
| C.恒温时,缩小容积,气体颜色变深,是平衡正向移动导致的 |
| D.恒容时,水浴加热,由于平衡正向移动导致气体颜色变浅 |
您最近一年使用:0次
2021-09-03更新
|
7999次组卷
|
29卷引用:2021年北京高考化学试题变式题1-10
2021年北京高考化学试题变式题1-10北京市房山区2022-2023学年高三二模化学试题2021年新高考北京化学高考真题(已下线)专题23 化学平衡的移动和化学反应进行的方向(限时精炼)-2022年高三毕业班化学常考点归纳与变式演练山东省潍坊市第四中学2021-2022学年高二上学期10月检测化学试卷浙江省吴兴高级中学2021-2022学年高二上学期12月月考化学试题北京市第八中学2021-2022学年高二上学期期末考试化学试题(已下线)卷05 化学能与热能-【小题小卷】冲刺2022年高考化学小题限时集训(全国卷专用)(已下线)卷11 化学反应速率和平衡选择题-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)专题9 平衡移动专练北京市第一六一中学2022-2023学年高三上学期开学测试化学试题湖北省枣阳市第一中学2022-2023学年高三上学期8月化学月考试题山东省临沂市兰陵县第四中学2021-2022学年高三12月月考化学试题北京师范大学第二附属中学2022-2023学年高二上学期期中考试化学试题广东省佛山市顺德区卓越高中(李兆基中学、华侨中学、顺德一中西南学校、郑裕彤中学)2022-2023学年高二上学期期中联考化学试题山东省青岛第十九中学2022-2023学年高二上学期期中考试化学试题天津市第一中学2022-2023学年高三上学期期末考试(第三次月考)化学试题辽宁省本溪市高级中学2022-2023学年高三上学期期中测试化学试题天津市第一中学2022-2023学年高三上学期1月期末质量检测化学试题(已下线)考点2 化学平衡 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)广东省佛山市顺德区郑裕彤中学2023-2024学年上学期高一10月月考化学试题云南省中央民族大学附属中学昆明五华实验学校2023-2024学年高二上学期期中考试化学试题北京市西城外国语学校2023-2024学年高二上学期期中考试化学试题河北省滦州市第二中学2023-2024学年高二上学期期中考试 化学试题福建省福州高新区第一中学(闽侯县第三中学)2023-2024学年高二上学期12月月考化学试题北京师范大学附属中学2023-2024学年高二上学期期末考试化学试卷天津市武清区黄花店中学2023-2024学年高三上学期第二次练习化学试题云南省保山市腾冲市第八中学2021-2022学年高二上学期期中考试化学试题山东省菏泽市郓城县第一中学2023-2024学年高二上学期第一次阶段测试化学试题
2023·上海·模拟预测
5 . 向饱和氯水中加入少量 亚硫酸钠固体,下列说法正确的是
亚硫酸钠固体,下列说法正确的是
 亚硫酸钠固体,下列说法正确的是
亚硫酸钠固体,下列说法正确的是| A.溶液pH减小 | B.溶液颜色变深 | C.漂白性增强 | D.导电性减弱 |
您最近一年使用:0次
名校
解题方法
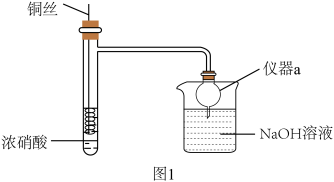
6 . HNO3是重要的化工原料,浓HNO3与Cu反应的装置如图1所示:
回答下列问题:
(1)仪器a的名称是_______ ,在该实验中的作用为_______ 。
(2)关于该实验下列说法错误的是_______。
(3)某小组同学发现Cu与浓HNO3反应所得混合溶液为绿色,Cu与稀HNO3反应所得混合溶液为蓝色,针对绿色产生的原因展开探究。
【提出猜想】
猜想a:Cu(NO3)2浓度大
猜想b:NO2溶解在Cu(NO3)2溶液中
【实验验证】
实验i:配制饱和Cu(NO3)2溶液,溶液呈_______ 色,证明猜想a不成立。
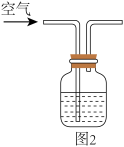
实验ii:取适量Cu与浓HNO3反应后的溶液,置于图2所示装置中,鼓入空气后,溶液上方可观察到_______ ,5min后,溶液完全变为蓝色,证明猜想b成立。
(4)另一组同学查阅资料发现:NO2能与水反应生成HNO2,进而发生下述反应:
①由此该组同学认为通过实验说明猜想b成立不严谨,理由是_______ 。
②写出NO2与水反应生成HNO2的化学方程式_______ 。
③该组同学改进后设计了新的实验:
实验iii:取适量Cu与浓HNO3反应后的溶液,置于图2所示装置中,鼓入氮气后,溶液上方现象与实验ii相同,但5min后,溶液仍为绿色。对比实验ii与实验iii,可推测Cu(NO3)2溶液为绿色的原因主要是_______ 。

回答下列问题:
(1)仪器a的名称是
(2)关于该实验下列说法错误的是_______。
| A.该反应需要加热才能进行 | B.可通过抽动铜丝控制反应开始和停止 |
| C.反应后迅速生成大量红棕色气体 | D.烧杯中仅发生中和反应 |
【提出猜想】
猜想a:Cu(NO3)2浓度大
猜想b:NO2溶解在Cu(NO3)2溶液中
【实验验证】
实验i:配制饱和Cu(NO3)2溶液,溶液呈
实验ii:取适量Cu与浓HNO3反应后的溶液,置于图2所示装置中,鼓入空气后,溶液上方可观察到

(4)另一组同学查阅资料发现:NO2能与水反应生成HNO2,进而发生下述反应:

①由此该组同学认为通过实验说明猜想b成立不严谨,理由是
②写出NO2与水反应生成HNO2的化学方程式
③该组同学改进后设计了新的实验:
实验iii:取适量Cu与浓HNO3反应后的溶液,置于图2所示装置中,鼓入氮气后,溶液上方现象与实验ii相同,但5min后,溶液仍为绿色。对比实验ii与实验iii,可推测Cu(NO3)2溶液为绿色的原因主要是
您最近一年使用:0次
2023-02-09更新
|
1335次组卷
|
3卷引用:广东省佛山市2023届普通高中教学质量检测(一)化学试题
7 . 血红蛋白可与 结合,更易与
结合,更易与 配位,血红蛋白与
配位,血红蛋白与 配位示意如图所示。血红蛋白
配位示意如图所示。血红蛋白 与
与 、
、 结合的反应可表示为
结合的反应可表示为
②
下列说法中错误的是
 结合,更易与
结合,更易与 配位,血红蛋白与
配位,血红蛋白与 配位示意如图所示。血红蛋白
配位示意如图所示。血红蛋白 与
与 、
、 结合的反应可表示为
结合的反应可表示为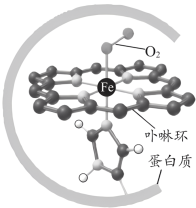

②

下列说法中错误的是
A.相同温度下, | B.反应①②的 、 、 均小于0 均小于0 |
C.图中 的配位数为6 的配位数为6 | D.用高压氧舱治疗 中毒时,平衡①②均逆向移动 中毒时,平衡①②均逆向移动 |
您最近一年使用:0次
2024-01-13更新
|
1150次组卷
|
7卷引用:辽宁省沈阳市部分高中2023-2024学年高三上学期教学质量监测(一)化学试题
辽宁省沈阳市部分高中2023-2024学年高三上学期教学质量监测(一)化学试题2024届辽宁省沈阳市高三教学质量检测(一模)化学试题(已下线)专题06 化学反应速率与化学平衡-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)(已下线)专题04 物质结构与性质 元素推断-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)辽宁省沈阳市2024届高三一模化学试题天津市红桥区2024届高三下学期二模化学试题江西省宜春市丰城市第九中学2023-2024学年高三上学期期末考试化学试题
8 . 碳酸锶(SrCO3)难溶于水,主要用于电磁材料和金属冶炼。一种由工业碳酸锶(含少量Ba2+、Ca2+、Mg2+、 Pb2+等)制备高纯碳酸锶的工艺流程如下:
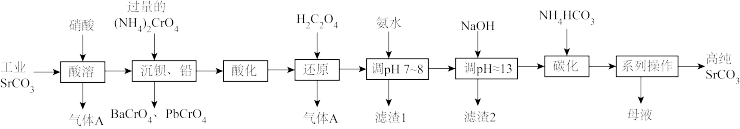
已知:I. Cr(OH)3为两性氢氧化物;
II.常温下,各物质的溶度积常数如下表所示。
回答下列问题:
(1)气体A的电子式为_______ 。
(2)“除钡、铅”时,pH过低会导致(NH4)2CrO4的利用率降低,原因为_______ (用离子方程式解释);“还原”时发生反应的离子方程式为_______ 。
(3)“滤渣1”的主要成分为_______ (填化学式)。
(4)用氨水和NaOH分步调节pH,而不是直接调节溶液的pH≈13的原因为_______ 。
(5)“调pH ≈13”后需对溶液进行煮沸并趁热过滤出滤渣2,煮沸并趁热过滤的原因为_______ 。
(6)已知:碳酸的电离常数Ka1=4.4×10-7、Ka2=4.7×10-11,则“碳化”时,反应Sr2+(aq)+2HCO (aq)
(aq) SrCO3(s)+H2CO3(aq)的平衡常数K=
SrCO3(s)+H2CO3(aq)的平衡常数K=_______ (保留两位有效数字)。
(7)“系列操作”中包含“200°C烘干”操作,烘干过程中除蒸发水分外,还能够除去SrCO3中的微量可溶性杂质,该杂质除NH4HCO3外还可能为_______ (填化学式)。

已知:I. Cr(OH)3为两性氢氧化物;
II.常温下,各物质的溶度积常数如下表所示。
| 化合物 | Cr(OH)3 | Ca(OH)2 | Mg(OH)2 | SrCO3 |
| Ksp近似值 | 1×10-31 | 5.5×10-6 | 1.8×10-11 | 5.6×10-10 |
(1)气体A的电子式为
(2)“除钡、铅”时,pH过低会导致(NH4)2CrO4的利用率降低,原因为
(3)“滤渣1”的主要成分为
(4)用氨水和NaOH分步调节pH,而不是直接调节溶液的pH≈13的原因为
(5)“调pH ≈13”后需对溶液进行煮沸并趁热过滤出滤渣2,煮沸并趁热过滤的原因为
(6)已知:碳酸的电离常数Ka1=4.4×10-7、Ka2=4.7×10-11,则“碳化”时,反应Sr2+(aq)+2HCO
 (aq)
(aq) SrCO3(s)+H2CO3(aq)的平衡常数K=
SrCO3(s)+H2CO3(aq)的平衡常数K=(7)“系列操作”中包含“200°C烘干”操作,烘干过程中除蒸发水分外,还能够除去SrCO3中的微量可溶性杂质,该杂质除NH4HCO3外还可能为
您最近一年使用:0次
2022-04-09更新
|
1198次组卷
|
13卷引用:河北省石家庄市2022届高三毕业班教学质量检测二(一模)化学试题
河北省石家庄市2022届高三毕业班教学质量检测二(一模)化学试题(已下线)化学-2022年高考押题预测卷01(山东卷)(已下线)化学-2022年高考考前押题密卷(湖南卷)(已下线)化学-2022年高考考前押题密卷(重庆卷)湖北省宜昌市夷陵中学2022届高三5月第二次限时训练(四模)化学试题(已下线)秘籍17 工艺流程的条件控制与计算-备战2022年高考化学抢分秘籍(全国通用)(已下线)专项15 工艺流程综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)辽宁省抚顺市第二中学2021-2022学年高三上学期10月月考化学试题山东省鄄城县第一中学2022-2023学年高二上学期期末考试化学试题湖北省宜昌英杰学校2021-2022学年高三上学期9月月考化学试题湖南省株洲市九方中学2022-2023学年高三上学期第一次月考化学试题(已下线)河北省石家庄市2022届高三毕业班教学质量检测二(一模)(工业流程题)湖南省邵阳市第一中学2023届高三第五次月考化学试题
解题方法
9 . 下列实验探究方案不 能达到探究目的的是
| 选项 | 探究方案 | 探究目的 |
| A | 向试管中滴入几滴1-溴丁烷,再加入2mL5%NaOH溶液,振荡后加热,反应一段时间后停止加热,静置。取数滴水层溶液于试管中,加入几滴2%AgNO3溶液,观察现象 | 检验1-溴丁烷中的溴元素 |
| B | 向盛有4mL0.1mol•L-1KBr溶液的试管中加入1mL新制氯水,振荡,观察溶液颜色变化 | Cl2的氧化性比Br2强 |
| C | 室温下,比较等物质的量浓度的NaF溶液和NaClO溶液pH的相对大小 | Ka(HF)>Ka(HClO) |
| D | 向盛有5mL0.005mol•L-1FeCl3溶液的试管中加入5mL0.015mol•L-1KSCN溶液,再加入少量铁粉,振荡,观察溶液颜色变化 | 反应物浓度影响化学平衡 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-03-24更新
|
1017次组卷
|
3卷引用:江苏省南京市盐城市2023届高三3月第二次模拟考试化学试题
江苏省南京市盐城市2023届高三3月第二次模拟考试化学试题 江苏省南京市部分学校2024届高三下学期化学模拟测试 (已下线)江苏省南京市盐城市2023届高三3月第二次模拟考试化学试题变式题(选择题11-13)
10 . 乙酸乙酯是极好的工业溶剂,现用如图所示装置进行制备。
已知:I.由羧酸和醇反应生成酯的机理如下:
 (成质子化)
(成质子化)
II.乙醇可与CaCl2结合形成CaCl2·6C2H5OH难溶物。
(1)实验中乙醇要过量的目的是___________ 。
(2)实验中三颈烧瓶适合的容积为___________(填字母)。
(3)实验温度为80℃时产率最高,此时需要观察温度计___________ ( 填“a”或“b”)的读数,另一只温度计在___________ 操作中使用。
(4)选用FeCl3·6H2O作为催化剂,可不加入碎瓷片,原因是___________ 。根据羧酸和醇生成酯的反应机理推测,下列物质中可用作制备乙酸乙酯催化剂的是___________ (填字母)。
A.NaOH B.BaCl2 C.FeSO4 D.HIO4 (固体)
(5)对得到的粗产品提纯:
①向粗产品中加入碳酸钠粉末,至无___________ 气体逸出。
②向其中加入饱和氯化钙溶液,以除去___________
③向所得有机层中加入无水硫酸钠,以除去___________ ,过滤后再蒸馏,收集77℃左右的馏分。

已知:I.由羧酸和醇反应生成酯的机理如下:
 (成质子化)
(成质子化)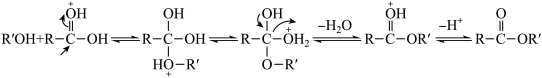
II.乙醇可与CaCl2结合形成CaCl2·6C2H5OH难溶物。
(1)实验中乙醇要过量的目的是
(2)实验中三颈烧瓶适合的容积为___________(填字母)。
| A.50mL | B.100 mL | C.250 mL | D.500 mL |
(4)选用FeCl3·6H2O作为催化剂,可不加入碎瓷片,原因是
A.NaOH B.BaCl2 C.FeSO4 D.HIO4 (固体)
(5)对得到的粗产品提纯:
①向粗产品中加入碳酸钠粉末,至无
②向其中加入饱和氯化钙溶液,以除去
③向所得有机层中加入无水硫酸钠,以除去
您最近一年使用:0次



