名校
1 . CH3CHO在NaOH溶液作用下制取2-丁烯醛的历程如下:
下列说法不正确 的是

下列说法
| A.OH-是该反应的催化剂 |
B.CH3CHO分子中甲基上的“ ”比 ”比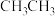 中的“ 中的“ ”更易电离出H+ ”更易电离出H+ |
| C.反应(4)加热失水有利于反应(3)平衡正向移动 |
| D.CH3CHO与CH3CH2CHO的混合液在NaOH溶液作用下最多可得到2种羟基醛 |
您最近一年使用:0次
2024-04-10更新
|
531次组卷
|
5卷引用:湖北省沙市中学2024届高三下学期模拟预测化学试题
湖北省沙市中学2024届高三下学期模拟预测化学试题2024届浙江省嘉兴市高三下学期二模化学试题(已下线)化学(浙江卷01)-2024年高考押题预测卷(已下线)压轴题04 化学反应机理 历程 能垒图分析(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)(已下线)选择题11-16
名校
2 . Sb2O3可用作白色颜料和阻燃剂,常常利用SbCl3的水解反应制备,过程中可适当加热,并在后期加入少量氨水。总反应可表示为2SbCl3+3H2O Sb2O3+6HCl。下列叙述错误的是
Sb2O3+6HCl。下列叙述错误的是
 Sb2O3+6HCl。下列叙述错误的是
Sb2O3+6HCl。下列叙述错误的是| A.SbCl3在热水中的水解程度大于冷水 |
| B.适当加热可使胶态Sb2O3聚沉便于分离 |
| C.反应后期加入氨水能提高Sb2O3的产率 |
| D.分离产品的操作是蒸发浓缩、降温结晶、过滤 |
您最近一年使用:0次
2022-11-18更新
|
678次组卷
|
4卷引用:湖北省高中名校联盟2022-2023学年高三上学期第二次联合测评化学试卷
名校
解题方法
3 .  常用作有机合成催化剂,现有如下两种方法制备
常用作有机合成催化剂,现有如下两种方法制备 。已知:
。已知: 晶体呈白色,微溶于水,不溶于稀盐酸,露置于潮湿空气中易转化为绿色的
晶体呈白色,微溶于水,不溶于稀盐酸,露置于潮湿空气中易转化为绿色的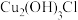 ,且易见光分解。
,且易见光分解。
方法一:利用热分解 (绿色)制备
(绿色)制备 ,并进行相关探究。
,并进行相关探究。
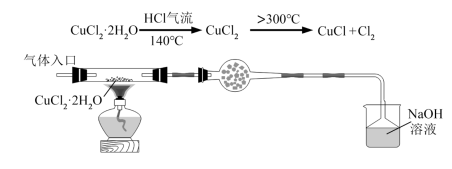
(1)将下列实验操作按先后顺序排列为:a→→→→→→d______
a.检查装置的气密性后加入药品 b.点燃酒精灯加热至 ,反应一段时间
,反应一段时间
c.调整酒精灯温度 ,反应一段时间 d.停止通入
,反应一段时间 d.停止通入
e.停止通入 ,然后通入干燥
,然后通入干燥 f.在“气体入口”处通入干燥
f.在“气体入口”处通入干燥
g.熄灭酒精灯
(2)当观察到___________ 时,反应达到终点,停止加热。
方法二:以 (含少量
(含少量 )粗品为原料制取
)粗品为原料制取 ,设计的合成路线如下:
,设计的合成路线如下:
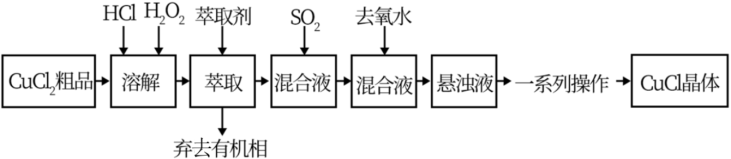
查阅资料可知:①在较高的盐酸浓度下, 能溶解于甲基异丁基甲酮:
能溶解于甲基异丁基甲酮:
② 在溶液中存在:
在溶液中存在: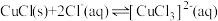 。
。
(3)写出 通入混合液中发生的反应的离子方程式
通入混合液中发生的反应的离子方程式___________ 。
(4)下列叙述正确的是___________(填字母)。

(5)向混合液中加入去氧水的目的是___________ 。
(6)现称取 产品,用硫酸酸化的硫酸铁完全溶解,并稀释成
产品,用硫酸酸化的硫酸铁完全溶解,并稀释成 。每次用移液管移取
。每次用移液管移取 溶液于锥形瓶中,再用
溶液于锥形瓶中,再用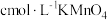 溶液滴定,平均消耗
溶液滴定,平均消耗 。
。
①按该实验方案计算产品的纯度为___________ %。
②有同学认为该实验方案明显不合理,会导致计算的 纯度
纯度___________ (填“偏高”或“偏低”)
 常用作有机合成催化剂,现有如下两种方法制备
常用作有机合成催化剂,现有如下两种方法制备 。已知:
。已知: 晶体呈白色,微溶于水,不溶于稀盐酸,露置于潮湿空气中易转化为绿色的
晶体呈白色,微溶于水,不溶于稀盐酸,露置于潮湿空气中易转化为绿色的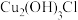 ,且易见光分解。
,且易见光分解。方法一:利用热分解
 (绿色)制备
(绿色)制备 ,并进行相关探究。
,并进行相关探究。
(1)将下列实验操作按先后顺序排列为:a→→→→→→d
a.检查装置的气密性后加入药品 b.点燃酒精灯加热至
 ,反应一段时间
,反应一段时间c.调整酒精灯温度
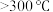 ,反应一段时间 d.停止通入
,反应一段时间 d.停止通入
e.停止通入
 ,然后通入干燥
,然后通入干燥 f.在“气体入口”处通入干燥
f.在“气体入口”处通入干燥
g.熄灭酒精灯
(2)当观察到
方法二:以
 (含少量
(含少量 )粗品为原料制取
)粗品为原料制取 ,设计的合成路线如下:
,设计的合成路线如下:
查阅资料可知:①在较高的盐酸浓度下,
 能溶解于甲基异丁基甲酮:
能溶解于甲基异丁基甲酮:②
 在溶液中存在:
在溶液中存在: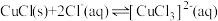 。
。(3)写出
 通入混合液中发生的反应的离子方程式
通入混合液中发生的反应的离子方程式(4)下列叙述正确的是___________(填字母)。

A. 原料中含有的 原料中含有的 经氧化、萃取几乎都在有机相中被除去 经氧化、萃取几乎都在有机相中被除去 |
| B.加入萃取剂后,混合物转移至分液漏斗中,塞上玻璃塞,如图用力振摇 |
| C.上述合成路线中,一系列操作包括:抽滤、洗涤、干燥,且干燥时应注意密封、避光 |
D.该流程中温度越高越有利于将 转化为 转化为 |
(6)现称取
 产品,用硫酸酸化的硫酸铁完全溶解,并稀释成
产品,用硫酸酸化的硫酸铁完全溶解,并稀释成 。每次用移液管移取
。每次用移液管移取 溶液于锥形瓶中,再用
溶液于锥形瓶中,再用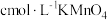 溶液滴定,平均消耗
溶液滴定,平均消耗 。
。①按该实验方案计算产品的纯度为
②有同学认为该实验方案明显不合理,会导致计算的
 纯度
纯度
您最近一年使用:0次
名校
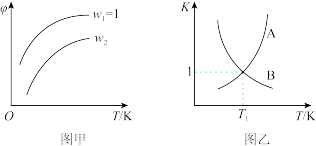
4 . 已知反应:CH2=CHCH3(g)+Cl2(g) CH2=CHCH2Cl(g)+HCl(g)。在一定压强下,按W=
CH2=CHCH2Cl(g)+HCl(g)。在一定压强下,按W= 向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数(φ)与温度T、W的关系,图乙表示正、逆反应的平衡常数与温度的关系。则下列说法中错误的是
向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数(φ)与温度T、W的关系,图乙表示正、逆反应的平衡常数与温度的关系。则下列说法中错误的是
 CH2=CHCH2Cl(g)+HCl(g)。在一定压强下,按W=
CH2=CHCH2Cl(g)+HCl(g)。在一定压强下,按W= 向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数(φ)与温度T、W的关系,图乙表示正、逆反应的平衡常数与温度的关系。则下列说法中错误的是
向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数(φ)与温度T、W的关系,图乙表示正、逆反应的平衡常数与温度的关系。则下列说法中错误的是
| A.图甲中W2>1 |
| B.图乙中,A线表示逆反应的平衡常数 |
| C.温度为T1,W=2时,Cl2的转化率为50% |
| D.若在恒容绝热装置中进行上述反应,达到平衡时,装置内的气体压强增大 |
您最近一年使用:0次
2022-05-18更新
|
1101次组卷
|
25卷引用:湖北省黄冈市2018届高三上学期元月调研考试理综化学试题
湖北省黄冈市2018届高三上学期元月调研考试理综化学试题湖北省恩施咸丰春晖学校2021-2022学年高二上学期第一次月考化学试题湖南省张家界市2023届高三下学期模拟考试化学试题河北省衡水中学2023届高三下学期第五次综合素养测评化学试题(已下线)2019年9月27日 《每日一题》2020年高考一轮复习-化学平衡常数和转化率(已下线)专题7.3 化学平衡常数 化学反应进行的方向(练)-《2020年高考一轮复习讲练测》吉林省白城市通榆县第一中学2020届高三上学期第三次月考化学试题鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 第2节 化学反应的限度课时3 化学平衡图象山东师范大学附属中学2021届高三上学期期中考试(11月)化学试题(已下线)小题必刷28 化学平衡及平衡移动——2021年高考化学一轮复习小题必刷(通用版本)陕西省西安市高新一中2020-2021学年高一下学期5月月考化学试题(已下线)考点19 化学平衡常数 化学反应进行的方向-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点19 化学平衡常数 化学反应进行的方向-备战2022年高考化学一轮复习考点帮(浙江专用)安徽省舒城中学2021-2022学年高二上学期第二次月考化学试题山东省实验中学2021-2022学年高三上学期第二次诊断考试化学试题安徽省青阳县第一中学2021-2022学年高二下学期5月月考化学试题(已下线)第11练 以化学平衡图像突破化学平衡移动原理-2022年【暑假分层作业】高二化学(2023届一轮复习通用)河南省实验中学2021-2022学年高三上学期期末考试化学试题陕西宝鸡市眉县槐芽中学2022-2023学年高二上学期期中考试化学试题广东省深圳外国语学校2022-2023学年高二上学期期末考试化学试题(已下线)第七章 化学反应速率与化学平衡 第42练 化学平衡常数及转化率的计算(已下线)考点23 化学平衡常数(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)湖南省长沙市雅礼中学2023-2024学年高二上学期第一次月考化学试题安徽省芜湖市第十二中学2023-2024学年高二上学期10月月考化学试题江西省宜春市丰城中学2023-2024学年高二下学期开学考试化学试题
5 . 碳酸锶(SrCO3)难溶于水,主要用于电磁材料和金属冶炼。一种由工业碳酸锶(含少量Ba2+、Ca2+、Mg2+、 Pb2+等)制备高纯碳酸锶的工艺流程如下:
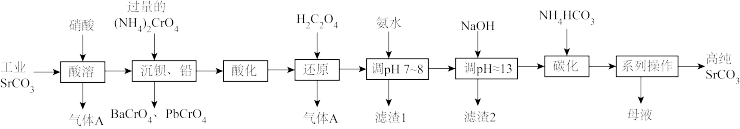
已知:I. Cr(OH)3为两性氢氧化物;
II.常温下,各物质的溶度积常数如下表所示。
回答下列问题:
(1)气体A的电子式为_______ 。
(2)“除钡、铅”时,pH过低会导致(NH4)2CrO4的利用率降低,原因为_______ (用离子方程式解释);“还原”时发生反应的离子方程式为_______ 。
(3)“滤渣1”的主要成分为_______ (填化学式)。
(4)用氨水和NaOH分步调节pH,而不是直接调节溶液的pH≈13的原因为_______ 。
(5)“调pH ≈13”后需对溶液进行煮沸并趁热过滤出滤渣2,煮沸并趁热过滤的原因为_______ 。
(6)已知:碳酸的电离常数Ka1=4.4×10-7、Ka2=4.7×10-11,则“碳化”时,反应Sr2+(aq)+2HCO (aq)
(aq) SrCO3(s)+H2CO3(aq)的平衡常数K=
SrCO3(s)+H2CO3(aq)的平衡常数K=_______ (保留两位有效数字)。
(7)“系列操作”中包含“200°C烘干”操作,烘干过程中除蒸发水分外,还能够除去SrCO3中的微量可溶性杂质,该杂质除NH4HCO3外还可能为_______ (填化学式)。

已知:I. Cr(OH)3为两性氢氧化物;
II.常温下,各物质的溶度积常数如下表所示。
| 化合物 | Cr(OH)3 | Ca(OH)2 | Mg(OH)2 | SrCO3 |
| Ksp近似值 | 1×10-31 | 5.5×10-6 | 1.8×10-11 | 5.6×10-10 |
(1)气体A的电子式为
(2)“除钡、铅”时,pH过低会导致(NH4)2CrO4的利用率降低,原因为
(3)“滤渣1”的主要成分为
(4)用氨水和NaOH分步调节pH,而不是直接调节溶液的pH≈13的原因为
(5)“调pH ≈13”后需对溶液进行煮沸并趁热过滤出滤渣2,煮沸并趁热过滤的原因为
(6)已知:碳酸的电离常数Ka1=4.4×10-7、Ka2=4.7×10-11,则“碳化”时,反应Sr2+(aq)+2HCO
 (aq)
(aq) SrCO3(s)+H2CO3(aq)的平衡常数K=
SrCO3(s)+H2CO3(aq)的平衡常数K=(7)“系列操作”中包含“200°C烘干”操作,烘干过程中除蒸发水分外,还能够除去SrCO3中的微量可溶性杂质,该杂质除NH4HCO3外还可能为
您最近一年使用:0次
2022-04-09更新
|
1198次组卷
|
13卷引用:湖北省宜昌市夷陵中学2022届高三5月第二次限时训练(四模)化学试题
湖北省宜昌市夷陵中学2022届高三5月第二次限时训练(四模)化学试题河北省石家庄市2022届高三毕业班教学质量检测二(一模)化学试题(已下线)化学-2022年高考押题预测卷01(山东卷)(已下线)化学-2022年高考考前押题密卷(湖南卷)(已下线)化学-2022年高考考前押题密卷(重庆卷)湖北省宜昌英杰学校2021-2022学年高三上学期9月月考化学试题(已下线)秘籍17 工艺流程的条件控制与计算-备战2022年高考化学抢分秘籍(全国通用)(已下线)专项15 工艺流程综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)辽宁省抚顺市第二中学2021-2022学年高三上学期10月月考化学试题山东省鄄城县第一中学2022-2023学年高二上学期期末考试化学试题湖南省株洲市九方中学2022-2023学年高三上学期第一次月考化学试题(已下线)河北省石家庄市2022届高三毕业班教学质量检测二(一模)(工业流程题)湖南省邵阳市第一中学2023届高三第五次月考化学试题
名校
解题方法
6 . 下列颜色变化未涉及氧化还原反应的是
A.向 溶液中滴入 溶液中滴入 溶液,溶液由橙色变黄色 溶液,溶液由橙色变黄色 |
B.浓 在光照一段时间后溶液变黄色 在光照一段时间后溶液变黄色 |
C.向 溶液中先滴加 溶液中先滴加 溶液,再滴加氯水,溶液变为红色 溶液,再滴加氯水,溶液变为红色 |
D.淡黄色 固体露置于空气中逐渐变为白色 固体露置于空气中逐渐变为白色 |
您最近一年使用:0次
2020-12-19更新
|
325次组卷
|
3卷引用:湖北省荆州市2021届高三上学期第一次质量检查化学试题
名校
解题方法
7 . 下列实验操作、现象及所得出的结论或解释均正确的是( )
| 选项 | 实验操作 | 现象 | 结论或解释 |
| A | 向次氯酸钙溶液中通入二氧化硫 | 产生白色沉淀 | 酸性:H2SO3>HClO |
| B | 向废FeCl3蚀刻液X中加入少量的铁粉,振荡 | 未出现红色固体 | X中一定不含Cu2+ |
| C | 向饱和硅酸钠溶液中加入浓盐酸 | 产生白色沉淀 | 制取硅酸胶体 |
| D | 铬酸钠溶液中加入浓硫酸 | 溶液由黄色变为橙色 | 氢离子浓度对该反应的化学平衡有影响 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2014·湖北黄冈·一模
8 . 工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5流程:

(1)步骤①所得废渣的成分是____________ (写化学式),操作I的名称__________ ;
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):R2(SO4)n (水层)+ 2nHA(有机层) 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是_____________________________ ;
③中X试剂为(写化学式)______________________________________ ;
(3)④的离子方程式为___________________________________________ ;
(4)25℃时,取样进行实验分析,得到钒沉淀率和溶液pH之间关系如下表:
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为____________ ;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< _____________ ;(已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39)
(5)该工艺流程中,可以循环利用的物质有__________ 和_______________ 。

(1)步骤①所得废渣的成分是
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):R2(SO4)n (水层)+ 2nHA(有机层)
 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层) ②中萃取时必须加入适量碱,其原因是
③中X试剂为(写化学式)
(3)④的离子方程式为
(4)25℃时,取样进行实验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为
(5)该工艺流程中,可以循环利用的物质有
您最近一年使用:0次
2018-09-19更新
|
475次组卷
|
7卷引用:2013-2014湖北省黄冈中学高三5月模拟考试理综化学试卷
(已下线)2013-2014湖北省黄冈中学高三5月模拟考试理综化学试卷(已下线)2014届湖北省黄冈中学高三5月模拟考试理综化学试卷2015届湖南省长沙市长郡中学高三第二次联考理综化学试卷贵州省长顺县民族高级中学2018届高三下学期第一次月考理科综合化学试题2020届高三化学大二轮增分强化练——化学工艺流程题(已下线)专题讲座(八) 无机化工流程题的解题策略(精讲)-2022年一轮复习讲练测(已下线)专题讲座(八) 无机化工流程题的解题策略(讲)-2023年高考化学一轮复习讲练测(全国通用)
2010·云南·一模
名校
9 . 下列说法中,能说明化学平衡一定向正反应方向移动的是
A.N2O4(g) 2NO2(g),改变某一条件后,气体颜色加深 2NO2(g),改变某一条件后,气体颜色加深 |
B.N2(g) + 3H2(g)  2NH3(g),改变某一条件后,NH3的体积分数增加 2NH3(g),改变某一条件后,NH3的体积分数增加 |
C.H2(g) + I2(g)  2HI(g),单位时间内消耗H2和HI的物质的量之比大于1∶2 2HI(g),单位时间内消耗H2和HI的物质的量之比大于1∶2 |
D.2SO2(g) + O2(g)  2SO3(g),恒温恒容充入He 2SO3(g),恒温恒容充入He |
您最近一年使用:0次
2017-06-13更新
|
206次组卷
|
6卷引用:2011届湖北省天门市高三模拟考试(一)(理综)化学部分
(已下线)2011届湖北省天门市高三模拟考试(一)(理综)化学部分(已下线)2010年云南省部分名校高三5月联考试题理科综合化学(已下线)2010-2011学年河北省衡水中学高一下学期期末考试化学试卷(已下线)2010—2011学年度本溪市第一中学高一下学期期末考试化学试卷河南省南阳市第一中学校2016-2017学年高二下学期第三次月考化学试题河南省南阳市第一中学2016-2017学年高二下学期第三次月考化学试题



