解题方法
1 . 根据实验操作及现象,得出结论正确的是
| 选项 | 实验操作及现象 | 结论 |
| A |  和稀硫酸混合产生浅黄色沉淀和刺激性气味的气体 和稀硫酸混合产生浅黄色沉淀和刺激性气味的气体 | 硫酸表现氧化性, 表现还原性 表现还原性 |
| B | 向酸性 溶液中滴加乙苯,溶液褪色 溶液中滴加乙苯,溶液褪色 | 乙苯的苯环中含有碳碳双键 |
| C | Ag与HI溶液生成黄色沉淀和无色气体 |  和 和 生成AgI,促进Ag和HI溶液发生反应生成AgI和 生成AgI,促进Ag和HI溶液发生反应生成AgI和 |
| D | 在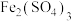 溶液中加入铜粉,溶液变蓝色 溶液中加入铜粉,溶液变蓝色 | 氧化性: , ,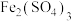 和Cu发生置换反应 和Cu发生置换反应 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2 . 为探究FeCl3溶液与Na2SO3溶液的反应,某研究小组的同学提出两种观点。
(1)观点一:两溶液混合发生氧化还原反应,离子方程式为_______ 。
观点二:_______ ,离子方程式为_______ 。
为验证上述观点,该研究小组的同学设计了探究实验(FeCl3溶液和Na2SO3溶液的浓度均为1.0mol·L-1)。
(2)实验①的目的是_______ 。
(3)对比实验①②的现象,可得结论:_______ 。
(4)将实验②反应后的溶液放置3小时后,溶液变为浅黄绿色,试提出合理的解释:_______ 。
(5)实验③的现象说明二者混合只发生_______ 反应,原因是_______ 。
(6)对比实验②③可得影响反应的因素可能有_______ 。
(1)观点一:两溶液混合发生氧化还原反应,离子方程式为
观点二:
为验证上述观点,该研究小组的同学设计了探究实验(FeCl3溶液和Na2SO3溶液的浓度均为1.0mol·L-1)。
| 实验 | 操作与现象 |
| ① | 在5mL水中滴加2滴FeCl3溶液,呈棕黄色;煮沸,溶液变红褐色 |
| ② | 在5mLFeCl3溶液中滴加2滴Na2SO3溶液,溶液立即变为红褐色;再滴加 溶液,产生蓝色沉淀 溶液,产生蓝色沉淀 |
| ③ | 在5mLNa2SO3溶液中滴加2滴FeCl3溶液,溶液立即变为红褐色;将上述混合液分成两份,一份滴加 溶液,无蓝色沉淀生成;另一份煮沸产生红褐色沉淀,再加 溶液,无蓝色沉淀生成;另一份煮沸产生红褐色沉淀,再加 溶液,无蓝色沉淀生成 溶液,无蓝色沉淀生成 |
(3)对比实验①②的现象,可得结论:
(4)将实验②反应后的溶液放置3小时后,溶液变为浅黄绿色,试提出合理的解释:
(5)实验③的现象说明二者混合只发生
(6)对比实验②③可得影响反应的因素可能有
您最近半年使用:0次
2023-05-16更新
|
472次组卷
|
4卷引用:河南省郑州市等3地2023届高三下学期6月理综化学试题
河南省郑州市等3地2023届高三下学期6月理综化学试题河北省秦皇岛市青龙满族自治县2023届高三三模联考化学试题(已下线)专题19 实验综合题(已下线)专题15 化学实验综合题-2023年高考化学真题题源解密(新高考专用)
3 .  溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
(i)
(ii)
 时,
时, 溶液中
溶液中 随
随 的变化关系如图。
的变化关系如图。

下列有关 溶液的说法正确的是
溶液的说法正确的是
 溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
溶液中存在多个平衡。本题条件下仅需考虑如下平衡:(i)

(ii)

 时,
时, 溶液中
溶液中 随
随 的变化关系如图。
的变化关系如图。
下列有关
 溶液的说法正确的是
溶液的说法正确的是A.加入少量 溶液,反应(i)的平衡逆向移动 溶液,反应(i)的平衡逆向移动 |
B.溶液中 |
C.加入少量 固体,则平衡时 固体,则平衡时 的比值减小 的比值减小 |
D.当pH=9.0时,溶液中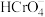 的平衡浓度约为 的平衡浓度约为 |
您最近半年使用:0次
2023-05-16更新
|
318次组卷
|
4卷引用:河南省郑州市等3地2023届高三下学期6月理综化学试题
河南省郑州市等3地2023届高三下学期6月理综化学试题河北省秦皇岛市青龙满族自治县2023届高三三模联考化学试题(已下线)不定项选择题(已下线)考点2 化学平衡 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
4 . 乙酸乙酯是极好的工业溶剂,现用如图所示装置进行制备。

步骤如下:向三颈烧瓶中加入23 mL 95%的乙醇(含CH3CH2OH 0.37 mol),再加入1 g FeCl3·6H2O,向滴液漏斗中加入14.5 mL冰醋酸(含CH3COOH 0.25 mol);按如图所示连接好装置,开始加热,缓缓滴入冰醋酸。
已知:I.由羧酸和醇反应生成酯的机理如下:
 (成质子化)
(成质子化)
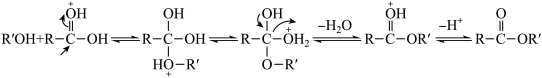
(脱质子化)
II.乙醇可与CaCl2结合形成CaCl2·6C2H5OH难溶物。
(1)实验中乙醇要过量的目的是___________ 。
(2)实验中三颈烧瓶适合的容积为___________(填字母)。
(3)实验温度为80℃时产率最高,此时需要观察温度计___________ ( 填“a”或“b”)的读数,另一只温度计在___________ 操作中使用。
(4)选用FeCl3·6H2O作为催化剂,可不加入碎瓷片,原因是___________ 。根据羧酸和醇生成酯的反应机理推测,下列物质中可用作制备乙酸乙酯催化剂的是___________ (填字母)。
A.NaOH B.BaCl2 C.FeSO4 D.HIO4 (固体)
(5)对得到的粗产品提纯:
①向粗产品中加入碳酸钠粉末,至无___________ 气体逸出。
②向其中加入饱和氯化钙溶液,以除去___________
③向所得有机层中加入无水硫酸钠,以除去___________ ,过滤后再蒸馏,收集77℃左右的馏分。

步骤如下:向三颈烧瓶中加入23 mL 95%的乙醇(含CH3CH2OH 0.37 mol),再加入1 g FeCl3·6H2O,向滴液漏斗中加入14.5 mL冰醋酸(含CH3COOH 0.25 mol);按如图所示连接好装置,开始加热,缓缓滴入冰醋酸。
已知:I.由羧酸和醇反应生成酯的机理如下:
 (成质子化)
(成质子化)
(脱质子化)
II.乙醇可与CaCl2结合形成CaCl2·6C2H5OH难溶物。
(1)实验中乙醇要过量的目的是
(2)实验中三颈烧瓶适合的容积为___________(填字母)。
| A.50mL | B.100 mL | C.250 mL | D.500 mL |
(4)选用FeCl3·6H2O作为催化剂,可不加入碎瓷片,原因是
A.NaOH B.BaCl2 C.FeSO4 D.HIO4 (固体)
(5)对得到的粗产品提纯:
①向粗产品中加入碳酸钠粉末,至无
②向其中加入饱和氯化钙溶液,以除去
③向所得有机层中加入无水硫酸钠,以除去
您最近半年使用:0次
5 . 在碳中和背景下,氢能是新能源领域中与油气行业现有业务结合最紧密的一类,而制氢成本过高,仍是目前氢能产业发展的挑战之一、甲烷水蒸气重整制氢是目前工业制氢最为成熟的方法,涉及的主要反应如下:
反应I CH4(g) +H2O(g) CO(g) +3H2(g) ΔH1>0
CO(g) +3H2(g) ΔH1>0
反应II CH4(g) +2H2O(g) CO2(g) +4H2(g) ΔH2>0
CO2(g) +4H2(g) ΔH2>0
反应III CO(g) +H2O(g) CO2(g) +H2(g) ΔH3
CO2(g) +H2(g) ΔH3
(1)已知部分化学键的键能数据如下表:
则ΔH3=___________ ,若反应III的正反应活化能Ea(正) =83 kJ· mol-1,则逆反应活化能Ea(逆)= ____ kJ·mol-1。
(2)①恒温条件下,在体积不变的密闭容器中充入1 mol CO(g)和2 mol H2O(g),发生反应III,欲使CO的转化率和H2的产率同时提高,可以采取的措施有___________ 。
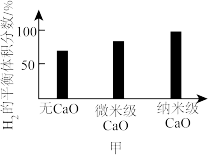
②已知比表面积是指单位质量物料所具有的总面积。实验表明,向体系中投入CaO固体可以增大H2的体积分数,选用相同质量、不同粒径的CaO固体进行实验时,结果如图甲所示。投入微米级CaO比纳米级CaO,H2的平衡体积分数低的原因是___________ 。
③在一恒容绝热容器中以物质的量之比1:2投入CO(g)和H2O(g),发生反应III,下列物理量不再改变能说明该反应到达平衡状态的是___________ (填字母)。
A. H2体积百分含量 B.体系温度
C. CO与H2O的物质的量之比 D.混合气体密度
(3)不同压强下,按照n(CH4):n( H2O) =1:3投料发生上述三个反应,CH4的平衡转化率α(CH4)随温度的变化关系如图乙所示。

压强p1、p2、p3由大到小的顺序是___________ ,CH4的平衡转化率随温度升高而增大的原因是___________ 。
(4)一定温度下,向2 L容器中充入1 mol CH4(g)和3 mol H2O(g) ,t min后反应达到平衡,容器中CO为mmol,CO2为nmol。则tmin内CH4的消耗速率为___________ mol·L-1·min-1,反应III的压强平衡常数Kp=___________ 。(用含m,n,t的代数式表示)
反应I CH4(g) +H2O(g)
 CO(g) +3H2(g) ΔH1>0
CO(g) +3H2(g) ΔH1>0反应II CH4(g) +2H2O(g)
 CO2(g) +4H2(g) ΔH2>0
CO2(g) +4H2(g) ΔH2>0反应III CO(g) +H2O(g)
 CO2(g) +H2(g) ΔH3
CO2(g) +H2(g) ΔH3(1)已知部分化学键的键能数据如下表:
| 化学键 | O-H | H-H | C=O | C≡O( CO) |
| 键能/(kJ·mol -1) | 463 | 436 | 803 | 1075 |
(2)①恒温条件下,在体积不变的密闭容器中充入1 mol CO(g)和2 mol H2O(g),发生反应III,欲使CO的转化率和H2的产率同时提高,可以采取的措施有
②已知比表面积是指单位质量物料所具有的总面积。实验表明,向体系中投入CaO固体可以增大H2的体积分数,选用相同质量、不同粒径的CaO固体进行实验时,结果如图甲所示。投入微米级CaO比纳米级CaO,H2的平衡体积分数低的原因是

③在一恒容绝热容器中以物质的量之比1:2投入CO(g)和H2O(g),发生反应III,下列物理量不再改变能说明该反应到达平衡状态的是
A. H2体积百分含量 B.体系温度
C. CO与H2O的物质的量之比 D.混合气体密度
(3)不同压强下,按照n(CH4):n( H2O) =1:3投料发生上述三个反应,CH4的平衡转化率α(CH4)随温度的变化关系如图乙所示。

压强p1、p2、p3由大到小的顺序是
(4)一定温度下,向2 L容器中充入1 mol CH4(g)和3 mol H2O(g) ,t min后反应达到平衡,容器中CO为mmol,CO2为nmol。则tmin内CH4的消耗速率为
您最近半年使用:0次
名校
解题方法
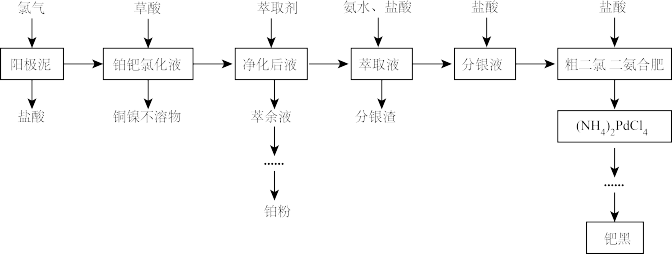
6 . 铂和钯同属于铂族元素,其价格均高于黄金,在工业上有广泛的应用。电解精炼铜阳极泥中除含有较多的铂、钯和银以外,还有少量的镍、铜等元素。一种综合提取阳极泥中贵重金属的工艺流程如下:
请回答以下问题。
(1)铜阳极泥中的铂和钯以游离态存在的理由是_______ 。
(2)阳极泥中的单质钯反应后转化为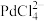 请写出该反应的离子方程式
请写出该反应的离子方程式_______ 。
(3)用草酸除铜镍时,草酸用量对铜镍去除率的影响如下表1。除铜镍时的温度对去除率的影响如下表2。
表1草酸加入量对铜镍去除率的影响
表2反应温度对铜镍去除率的影响
则草酸的过量系数应为_______ 。实际工业中采用的温度为80—85℃。试分析其原因_______ 。
(4)已知 配离子存在解离平衡:
配离子存在解离平衡: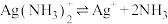 ,根据平衡移动原理说明加盐酸分银的原理
,根据平衡移动原理说明加盐酸分银的原理_______ 。
(5)分银液中加盐酸把 转化为
转化为 沉淀,过滤后用适量的盐酸溶解。则加入盐酸溶解时的化学方程式为
沉淀,过滤后用适量的盐酸溶解。则加入盐酸溶解时的化学方程式为_______ 。
(6)海绵钯具有优良的吸氢功能,其密度为 。标准状况下,吸附氢气的体积是钯体积的a倍,则此条件下海绵钯的吸附容量R=
。标准状况下,吸附氢气的体积是钯体积的a倍,则此条件下海绵钯的吸附容量R=_______  ,氢气的浓度r=
,氢气的浓度r=_______ (吸附容量R是指1g钯吸附氢气的体积;氢气的浓度r为 吸附氢气的物质的量)。
吸附氢气的物质的量)。

请回答以下问题。
(1)铜阳极泥中的铂和钯以游离态存在的理由是
(2)阳极泥中的单质钯反应后转化为
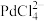 请写出该反应的离子方程式
请写出该反应的离子方程式(3)用草酸除铜镍时,草酸用量对铜镍去除率的影响如下表1。除铜镍时的温度对去除率的影响如下表2。
表1草酸加入量对铜镍去除率的影响
| 过量系数 | 净化后液/( ) ) | 去除率/% | ||
 |  |  |  | |
| 1.0 | 16.93 | 1.47 | 68.44 | 46.15 |
| 1.5 | 4.67 | 0.61 | 91.30 | 77.66 |
| 2.0 | 0.091 | 0.031 | 99.83 | 98.86 |
| 2.5 | 0.25 | 0.042 | 99.53 | 98.46 |
| 3.0 | 0.28 | 0.040 | 99.48 | 98.53 |
| 4.0 | 0.26 | 0.035 | 99.52 | 98.72 |
| 温度 | 净化后液/( ) ) | 去除率/% | ||
 |  |  |  | |
| 70 | 0.65 | 0.130 | 98.799 | 95.24 |
| 75 | 0.26 | 0.091 | 9.52 | 96.67 |
| 80 | 0.18 | 0.043 | 99.66 | 98.42 |
| 85 | 0.15 | 0.045 | 99.72 | 98.35 |
| 90 | 0.14 | 0.042 | 99.74 | 98.46 |
| 95 | 0.14 | 0.040 | 99.74 | 98.53 |
(4)已知
 配离子存在解离平衡:
配离子存在解离平衡: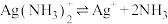 ,根据平衡移动原理说明加盐酸分银的原理
,根据平衡移动原理说明加盐酸分银的原理(5)分银液中加盐酸把
 转化为
转化为 沉淀,过滤后用适量的盐酸溶解。则加入盐酸溶解时的化学方程式为
沉淀,过滤后用适量的盐酸溶解。则加入盐酸溶解时的化学方程式为(6)海绵钯具有优良的吸氢功能,其密度为
 。标准状况下,吸附氢气的体积是钯体积的a倍,则此条件下海绵钯的吸附容量R=
。标准状况下,吸附氢气的体积是钯体积的a倍,则此条件下海绵钯的吸附容量R= ,氢气的浓度r=
,氢气的浓度r= 吸附氢气的物质的量)。
吸附氢气的物质的量)。
您最近半年使用:0次
2022-03-31更新
|
458次组卷
|
5卷引用:河南省郑州市2022届高三第二次质量预测理科综合化学试题
河南省郑州市2022届高三第二次质量预测理科综合化学试题(已下线)化学-2022年高考押题预测卷02(山东卷)(已下线)押江苏卷第15题 化学工业流程综合题 -备战2022年高考化学临考题号押题(江苏卷)(已下线)专项15 工艺流程综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)湖南省湘潭市第一中学2023届高三第六次月考化学试题
名校
解题方法
7 . 由下列实验操作及现象推出的相应结论正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 向两份蛋白质溶液中分别滴加饱和氯化钠溶液和饱和硫酸铜溶液 | 均有固体析出 | 蛋白质均发生变性 |
B | 取1mL 20%的蔗糖溶液,加入3~5滴稀硫酸,水浴加热5min分钟后取少量溶液于一洁净的试管中,加入新制Cu(OH)2溶液,加热 | 无砖红色沉淀产生 | 蔗糖没有发生水解 |
C | 用c(Fe3+)相同的Fe2(SO4)3和FeCl3溶液,分别清洗做完银镜反应的试管 | 用FeCl3溶液清洗较干净 | Fe3++Ag Ag++Fe2+是可逆反应,且AgCl更难溶于水 Ag++Fe2+是可逆反应,且AgCl更难溶于水 |
D | 对于二氧化氮和四氧化二氮的平衡体系,缩小容器体积 | 混合气体颜色逐渐加深 | 符合勒夏特列原理 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2021-01-17更新
|
599次组卷
|
4卷引用:豫皖中学生标准学术能力诊断性测试2021年1月高三测试理综化学试题
2010·湖北武汉·一模
名校
解题方法
8 . 向一容积不变的密闭容器中充入 和
和 发生反应
发生反应 ,在
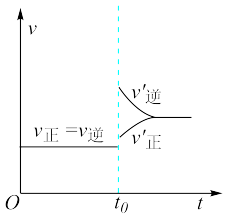
,在 时达到平衡,若保持混合气体总物质的量不变而改变某一反应条件,使平衡发生移动(如图所示),则下列说法正确的是( )
时达到平衡,若保持混合气体总物质的量不变而改变某一反应条件,使平衡发生移动(如图所示),则下列说法正确的是( )
 和
和 发生反应
发生反应 ,在
,在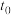 时达到平衡,若保持混合气体总物质的量不变而改变某一反应条件,使平衡发生移动(如图所示),则下列说法正确的是( )
时达到平衡,若保持混合气体总物质的量不变而改变某一反应条件,使平衡发生移动(如图所示),则下列说法正确的是( )
| A.容器内气体颜色变深,平均相对分子质量不变 |
| B.平衡不移动,混合气体密度增大 |
C. 的转化率增大,HI的平衡浓度减小 的转化率增大,HI的平衡浓度减小 |
| D.t0时改变的条件为减小体积或升高体系温度 |
您最近半年使用:0次
2020-10-10更新
|
303次组卷
|
10卷引用:2010年河南郑州四中高考押题卷理综化学试题
(已下线)2010年河南郑州四中高考押题卷理综化学试题(已下线)2010年湖北省武汉市华中师大一附中高三五月适应性考试理综化学试题河南省宋基信阳实验中学2021-2022学年高三上学期12月月考化学试题(已下线)2011届湖南省慈利一中高三上学期期末考试化学试卷(已下线)2014高考化学苏教版总复习 专题7化学反应速率与化学平衡练习卷夯基提能2020届高三化学选择题对题专练——选修四化学反应原理—— 转化率与产率的相关计算鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 第2节 化学反应的限度课时3 化学平衡图象人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 第二节 化学平衡 课时4 化学平衡图象河北省石家庄市第一中学2021-2022学年高二上学期开学考试化学试题吉林省普通高中友好学校联合体2023-2024学年高二上学期第三十七届基础年段期末联考化学试题
9 . 一种用电催化N2还原法制取NH3的反应机理如图所示,其中*表示吸附在催化剂表面的物种。下列说法正确的是


| A.两个氮原子上的加氢过程是分步进行的 |
| B.析氢反应(H++ H+→H2)不会影响NH3的合成 |
| C.NH3从催化剂表而脱附不利于NH3的合成 |
| D.电催化法是一步即能把N2还原为NH3的高效还原法 |
您最近半年使用:0次
10 . 镓(Ga)与铝位于同一主族,金属镓的熔点是29. 8℃,沸点是2403℃,是一种广泛用于电子工业和通讯领域的重要金属。
(1)工业上利用镓与NH3在1000℃高温下合成固体半导体材料氮化镓(GaN),同时生成氢气,每生成lmol H2时放出10.27 kJ热量。
写出该反应.的热化学方程式___________________ 。
(2)在密闭容器中,充入一定量的Ga与NH3发生反应,实验测得反应平衡体系中NH3的体积分数与压强P和温度T的关系曲线如图1所示。
①图1中A点和C点化学平衡常数的大小关系是:KA_____ KC,(填“<”“=”或“>”),理由是____________ 。
②在T1和P6条件下反应至3min时达到平衡,此时改变条件并于D点处重新达到平衡,H2的浓度随反应时间的变化趋势如图2所示(3〜4 min的浓度变化未表示出来),则改变的条件为________ (仅改变温度或压强中的一种)。
(3)气相平衡中用组份的平衡分压(PB)代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),用含P6的式子表示B点的Kp=_____________ 。
(4)电解精炼法提纯嫁的具体原理如下:以粗镓(含Zn、Fe、Cu杂质)为阳极,以高纯镓为阴极,以NaOH溶液为电解质,在电流作用下使粗镓溶解进入电解质溶液,并通过某种离子迁移技术到达阴极并在阴极放电析出高纯镓。
①已知离子氧化性顺序为:Zn2+3+2+2+。电解精炼镓时阳极泥的成分是________________ 。
②镓在阳极溶解生成的Ga3+与.NaOH溶液反应生成GaO2-,该反应的离子方程式为_________________ ;
GaO2-在阴极放电的电极反应式是________________ 。
(1)工业上利用镓与NH3在1000℃高温下合成固体半导体材料氮化镓(GaN),同时生成氢气,每生成lmol H2时放出10.27 kJ热量。
写出该反应.的热化学方程式
(2)在密闭容器中,充入一定量的Ga与NH3发生反应,实验测得反应平衡体系中NH3的体积分数与压强P和温度T的关系曲线如图1所示。
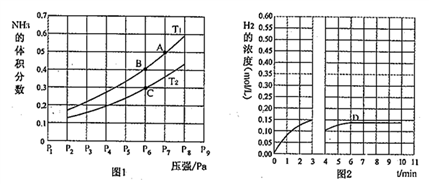
①图1中A点和C点化学平衡常数的大小关系是:KA
②在T1和P6条件下反应至3min时达到平衡,此时改变条件并于D点处重新达到平衡,H2的浓度随反应时间的变化趋势如图2所示(3〜4 min的浓度变化未表示出来),则改变的条件为
(3)气相平衡中用组份的平衡分压(PB)代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),用含P6的式子表示B点的Kp=
(4)电解精炼法提纯嫁的具体原理如下:以粗镓(含Zn、Fe、Cu杂质)为阳极,以高纯镓为阴极,以NaOH溶液为电解质,在电流作用下使粗镓溶解进入电解质溶液,并通过某种离子迁移技术到达阴极并在阴极放电析出高纯镓。
①已知离子氧化性顺序为:Zn2+3+2+2+。电解精炼镓时阳极泥的成分是
②镓在阳极溶解生成的Ga3+与.NaOH溶液反应生成GaO2-,该反应的离子方程式为
GaO2-在阴极放电的电极反应式是
您最近半年使用:0次



