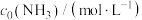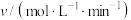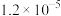在碳中和背景下,氢能是新能源领域中与油气行业现有业务结合最紧密的一类,而制氢成本过高,仍是目前氢能产业发展的挑战之一、甲烷水蒸气重整制氢是目前工业制氢最为成熟的方法,涉及的主要反应如下:
反应I CH4(g) +H2O(g) CO(g) +3H2(g) ΔH1>0
CO(g) +3H2(g) ΔH1>0
反应II CH4(g) +2H2O(g) CO2(g) +4H2(g) ΔH2>0
CO2(g) +4H2(g) ΔH2>0
反应III CO(g) +H2O(g) CO2(g) +H2(g) ΔH3
CO2(g) +H2(g) ΔH3
(1)已知部分化学键的键能数据如下表:
则ΔH3=___________ ,若反应III的正反应活化能Ea(正) =83 kJ· mol-1,则逆反应活化能Ea(逆)= ____ kJ·mol-1。
(2)①恒温条件下,在体积不变的密闭容器中充入1 mol CO(g)和2 mol H2O(g),发生反应III,欲使CO的转化率和H2的产率同时提高,可以采取的措施有___________ 。
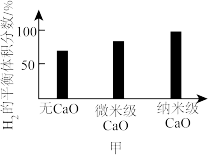
②已知比表面积是指单位质量物料所具有的总面积。实验表明,向体系中投入CaO固体可以增大H2的体积分数,选用相同质量、不同粒径的CaO固体进行实验时,结果如图甲所示。投入微米级CaO比纳米级CaO,H2的平衡体积分数低的原因是___________ 。
③在一恒容绝热容器中以物质的量之比1:2投入CO(g)和H2O(g),发生反应III,下列物理量不再改变能说明该反应到达平衡状态的是___________ (填字母)。
A. H2体积百分含量 B.体系温度
C. CO与H2O的物质的量之比 D.混合气体密度
(3)不同压强下,按照n(CH4):n( H2O) =1:3投料发生上述三个反应,CH4的平衡转化率α(CH4)随温度的变化关系如图乙所示。

压强p1、p2、p3由大到小的顺序是___________ ,CH4的平衡转化率随温度升高而增大的原因是___________ 。
(4)一定温度下,向2 L容器中充入1 mol CH4(g)和3 mol H2O(g) ,t min后反应达到平衡,容器中CO为mmol,CO2为nmol。则tmin内CH4的消耗速率为___________ mol·L-1·min-1,反应III的压强平衡常数Kp=___________ 。(用含m,n,t的代数式表示)
反应I CH4(g) +H2O(g)
 CO(g) +3H2(g) ΔH1>0
CO(g) +3H2(g) ΔH1>0反应II CH4(g) +2H2O(g)
 CO2(g) +4H2(g) ΔH2>0
CO2(g) +4H2(g) ΔH2>0反应III CO(g) +H2O(g)
 CO2(g) +H2(g) ΔH3
CO2(g) +H2(g) ΔH3(1)已知部分化学键的键能数据如下表:
| 化学键 | O-H | H-H | C=O | C≡O( CO) |
| 键能/(kJ·mol -1) | 463 | 436 | 803 | 1075 |
(2)①恒温条件下,在体积不变的密闭容器中充入1 mol CO(g)和2 mol H2O(g),发生反应III,欲使CO的转化率和H2的产率同时提高,可以采取的措施有
②已知比表面积是指单位质量物料所具有的总面积。实验表明,向体系中投入CaO固体可以增大H2的体积分数,选用相同质量、不同粒径的CaO固体进行实验时,结果如图甲所示。投入微米级CaO比纳米级CaO,H2的平衡体积分数低的原因是

③在一恒容绝热容器中以物质的量之比1:2投入CO(g)和H2O(g),发生反应III,下列物理量不再改变能说明该反应到达平衡状态的是
A. H2体积百分含量 B.体系温度
C. CO与H2O的物质的量之比 D.混合气体密度
(3)不同压强下,按照n(CH4):n( H2O) =1:3投料发生上述三个反应,CH4的平衡转化率α(CH4)随温度的变化关系如图乙所示。

压强p1、p2、p3由大到小的顺序是
(4)一定温度下,向2 L容器中充入1 mol CH4(g)和3 mol H2O(g) ,t min后反应达到平衡,容器中CO为mmol,CO2为nmol。则tmin内CH4的消耗速率为
更新时间:2022-06-05 18:02:26
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】反应Ⅰ可用于在国际空间站中处理二氧化碳,同时伴有副反应Ⅱ发生。
主反应Ⅰ.CO2(g)+4H2(g) CH4(g)+2H2O(g) △H1=-270kJ·mol-1
CH4(g)+2H2O(g) △H1=-270kJ·mol-1
副反应Ⅱ.CO2(g)+H2(g) CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
回答下列问题:
(1)几种化学键的键能如表所示:
则a=___ 。
(2)为了进一步研究上述两个反应,某小组在三个容积相同的刚性容器中,分别充入1molCO2和4molH2,在三种不同实验条件(见表)下进行两个反应,反应体系的总压强(p)随时间变化情况如图所示:

①T1____ T2(填“>”“<”或“=”),曲线Ⅲ对应的实验编号是____ 。
②若在曲线Ⅱ的条件下,10min达到平衡时生成1.2molH2O,则10min内反应的平均速率v(H2O)=____ kPa•min-1,反应Ⅱ的平衡常数Kp=____ 。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(3)对于反应Ⅰ,在一定条件下存在:v正(H2)=k1•c4(H2)•c(CO2)或v逆(H2O)=k2•c2(H2O)•c(CH4),相应的速率与温度关系如图所示。

反应Ⅰ的平衡常数K=____ (用含k1,k2的代数式表示);图中A、B、C、D四个点中,能表示反应已达到平衡状态的是____ 。
主反应Ⅰ.CO2(g)+4H2(g)
 CH4(g)+2H2O(g) △H1=-270kJ·mol-1
CH4(g)+2H2O(g) △H1=-270kJ·mol-1副反应Ⅱ.CO2(g)+H2(g)
 CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2回答下列问题:
(1)几种化学键的键能如表所示:
| 化学键 | C—H | H—H | H—O | C=O |
| 键能/kJ·mol-1 | 413 | 436 | 463 | a |
(2)为了进一步研究上述两个反应,某小组在三个容积相同的刚性容器中,分别充入1molCO2和4molH2,在三种不同实验条件(见表)下进行两个反应,反应体系的总压强(p)随时间变化情况如图所示:

| 实验编号 | a | b | c |
| 温度/K | T1 | T1 | T2 |
| 催化剂的比表面积/(m2•g-1) | 80 | 120 | 120 |
②若在曲线Ⅱ的条件下,10min达到平衡时生成1.2molH2O,则10min内反应的平均速率v(H2O)=
(3)对于反应Ⅰ,在一定条件下存在:v正(H2)=k1•c4(H2)•c(CO2)或v逆(H2O)=k2•c2(H2O)•c(CH4),相应的速率与温度关系如图所示。

反应Ⅰ的平衡常数K=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】乙炔是现代合成塑料、橡胶、纤维、染料和溶剂等许多有机产品的基础原料。天然气“非催化部分氧化法”制乙炔的工艺过程中涉及的有关反应为:
①甲烷完全氧化: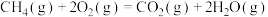

②甲烷部分氧化:

③甲烷裂解:

④乙炔裂解:

回答下列问题:
(1)根据反应③和相关化学键的键能数据(忽略不同环境中C-H键能的差异,如下表所示):
估算
___________ 。
(2)在一绝热等压密闭容器内,以两种不同组成进料,反应中各组分的摩尔分数随温度变化的结果如下图所示(物质i的摩尔分数: )
)

在实际生产中选择初始投料比 的原因可能是
的原因可能是___________ 。
(3)科学家测定和计算了在一定温度范围内以上反应①、②、③的平衡常数 的自然对数
的自然对数 随
随 (温度的倒数)的变化关系如图所示,反应③的压强平衡常数的表达式为
(温度的倒数)的变化关系如图所示,反应③的压强平衡常数的表达式为
___________ (用分压代替平衡浓度表示),表示该反应的曲线是___________ (填字母),判断依据是___________ 。

(4)在1000℃时,若只考虑发生反应②和③,已知起始 ,初始投料比
,初始投料比 ,平衡体系中
,平衡体系中 ,此时CH4的转化率为50%,则平衡时CO的物质的量为
,此时CH4的转化率为50%,则平衡时CO的物质的量为___________ (用以上字母表示,需化简)。
(5)副产物中的CO和H2可以用于合成甲醇(CH3OH),但生产成本较高。科学家设计了以H2O2作为氧化剂,Au-Pd纳米粒子胶体为催化剂,在低温(50℃)下将甲烷直接转化为甲醇的反应路径。CH4在氧化过程中首先生成甲基过氧化氢(CH3OOH),写出此步骤的化学方程式:___________ ;新方法的优点是___________ 。
①甲烷完全氧化:
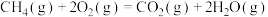

②甲烷部分氧化:


③甲烷裂解:


④乙炔裂解:


回答下列问题:
(1)根据反应③和相关化学键的键能数据(忽略不同环境中C-H键能的差异,如下表所示):
| 化学键 | C≡C | H-H | C-H |
键能/( ) ) | a | 436 | 413.4 |

(2)在一绝热等压密闭容器内,以两种不同组成进料,反应中各组分的摩尔分数随温度变化的结果如下图所示(物质i的摩尔分数:
 )
)
在实际生产中选择初始投料比
 的原因可能是
的原因可能是(3)科学家测定和计算了在一定温度范围内以上反应①、②、③的平衡常数
 的自然对数
的自然对数 随
随 (温度的倒数)的变化关系如图所示,反应③的压强平衡常数的表达式为
(温度的倒数)的变化关系如图所示,反应③的压强平衡常数的表达式为

(4)在1000℃时,若只考虑发生反应②和③,已知起始
 ,初始投料比
,初始投料比 ,平衡体系中
,平衡体系中 ,此时CH4的转化率为50%,则平衡时CO的物质的量为
,此时CH4的转化率为50%,则平衡时CO的物质的量为(5)副产物中的CO和H2可以用于合成甲醇(CH3OH),但生产成本较高。科学家设计了以H2O2作为氧化剂,Au-Pd纳米粒子胶体为催化剂,在低温(50℃)下将甲烷直接转化为甲醇的反应路径。CH4在氧化过程中首先生成甲基过氧化氢(CH3OOH),写出此步骤的化学方程式:
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】氨是化肥工业和基本有机化工的主要原料。回答下列问题,
(1)查阅资料可知,H—H、N≡N、N-H的键能分别为436 、946
、946 、389
、389 ,则
,则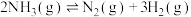 的焓变△H=
的焓变△H=______ ,该反应活化能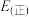
______ (填“>”或“<”)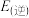 。
。
(2)已知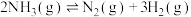 分解反应的速率方程为
分解反应的速率方程为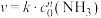 (k为速率常数,只与温度、催化剂有关)。某温度下的实验数据如表所示:
(k为速率常数,只与温度、催化剂有关)。某温度下的实验数据如表所示:
速率方程中n=______________ ;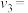
______________ 。
(3)恒压密闭容器中,充入一定量的 和
和 ,在不同催化剂(Ⅰ,Ⅱ,Ⅲ)作用下发生反应
,在不同催化剂(Ⅰ,Ⅱ,Ⅲ)作用下发生反应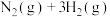
 ,测得相同反应时间内,
,测得相同反应时间内, 的体积分数随温度变化如图所示:
的体积分数随温度变化如图所示: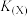
_________ (填“>”或“<”,下同)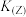 。
。
②240℃时,催化效果最好的催化剂为_______ (填“Ⅰ”“Ⅱ”或“Ⅲ”);T>300℃,曲线重合的原因是________________ 。
(4)恒温、恒容条件下, 和
和 按照物质的量之比1∶1充入容器,下列能说明密闭容器中反应已达平衡状态的是 (填字母)。
按照物质的量之比1∶1充入容器,下列能说明密闭容器中反应已达平衡状态的是 (填字母)。
(5)合成氨的常用催化剂是铁触媒,已知铁为面心立方晶体,其晶胞结构如图所示,若铁原子的半径为a pm,则铁晶体中最近的两个铁原子间的距离(核间距)为____ pm;铁晶体的密度为________  (
( 表示阿伏加德罗常数的值,写出计算表达式)。
表示阿伏加德罗常数的值,写出计算表达式)。
(1)查阅资料可知,H—H、N≡N、N-H的键能分别为436
 、946
、946 、389
、389 ,则
,则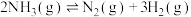 的焓变△H=
的焓变△H=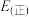
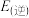 。
。(2)已知
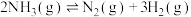 分解反应的速率方程为
分解反应的速率方程为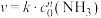 (k为速率常数,只与温度、催化剂有关)。某温度下的实验数据如表所示:
(k为速率常数,只与温度、催化剂有关)。某温度下的实验数据如表所示:组别 |
| 速率常数k |
|
1 | 0.04 | k |
|
2 | 0.16 | k |
|
3 | 0.36 | k |
|
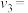
(3)恒压密闭容器中,充入一定量的
 和
和 ,在不同催化剂(Ⅰ,Ⅱ,Ⅲ)作用下发生反应
,在不同催化剂(Ⅰ,Ⅱ,Ⅲ)作用下发生反应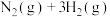
 ,测得相同反应时间内,
,测得相同反应时间内, 的体积分数随温度变化如图所示:
的体积分数随温度变化如图所示: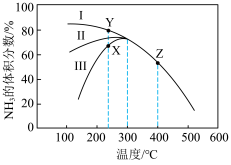
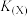
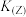 。
。②240℃时,催化效果最好的催化剂为
(4)恒温、恒容条件下,
 和
和 按照物质的量之比1∶1充入容器,下列能说明密闭容器中反应已达平衡状态的是 (填字母)。
按照物质的量之比1∶1充入容器,下列能说明密闭容器中反应已达平衡状态的是 (填字母)。| A.容器内压强不再发生改变 | B.容器内混合气体的平均摩尔质量不变 |
| C.容器内气体密度不再发生改变 | D. 的体积分数保持不变 的体积分数保持不变 |
(5)合成氨的常用催化剂是铁触媒,已知铁为面心立方晶体,其晶胞结构如图所示,若铁原子的半径为a pm,则铁晶体中最近的两个铁原子间的距离(核间距)为
 (
( 表示阿伏加德罗常数的值,写出计算表达式)。
表示阿伏加德罗常数的值,写出计算表达式)。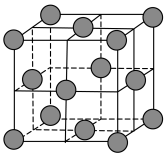
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐1】钒的用途十分广泛,有金属“维生素”之称。以含钒石煤(主要成分是 、
、 ,含有的杂质有
,含有的杂质有 、
、 及Mg、Al、Mn等的化合物)制备单质钒的工艺流程如图所示。
及Mg、Al、Mn等的化合物)制备单质钒的工艺流程如图所示。
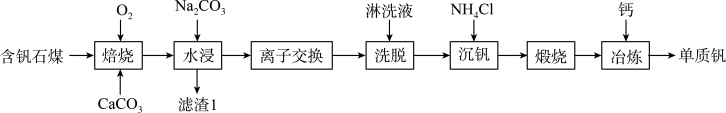
已知:
①该工艺条件下,溶液中金属离子开始沉淀时和完全沉淀时的pH如下表所示:
② ,
, ,
, 远大于
远大于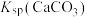 。
。
回答下列问题:
(1)为了提高“焙烧”效率,可采取的措施有___________ 、___________ 。
(2)“焙烧”时, 、
、 都转化为
都转化为 ,写出
,写出 转化为
转化为 的化学方程式:
的化学方程式:___________ 。
(3)“水浸”加入 调节溶液的pH为8.5,可完全除去的金属离子有
调节溶液的pH为8.5,可完全除去的金属离子有___________ ,部分除去的金属离子有___________ 。“水浸”加入过量 不能使
不能使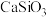 完全转化为
完全转化为 ,原因是
,原因是___________ 。
(4)“离子交换”与“洗脱”可表示为 (
( 为强碱性阴离子交换树脂,
为强碱性阴离子交换树脂, 为
为 在水溶液中的实际存在形式),则“洗脱”过程中“淋洗液”最好选用
在水溶液中的实际存在形式),则“洗脱”过程中“淋洗液”最好选用___________ 。
(5)“沉钒”过程析出 晶体,需要加入过量
晶体,需要加入过量 ,目的是
,目的是___________ 。
(6)下列金属冶炼方法中,与本工艺流程中冶炼钒的方法相似的是___________(填字母)。
 、
、 ,含有的杂质有
,含有的杂质有 、
、 及Mg、Al、Mn等的化合物)制备单质钒的工艺流程如图所示。
及Mg、Al、Mn等的化合物)制备单质钒的工艺流程如图所示。
已知:
①该工艺条件下,溶液中金属离子开始沉淀时和完全沉淀时的pH如下表所示:
| 金属离子 |  |  |  |  |
| 开始沉淀时的pH | 1.9 | 7.0 | 3.0 | 8.1 |
| 完全沉淀时的pH | 3.2 | 9.0 | 4.7 | 10.1 |
 ,
, ,
, 远大于
远大于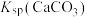 。
。回答下列问题:
(1)为了提高“焙烧”效率,可采取的措施有
(2)“焙烧”时,
 、
、 都转化为
都转化为 ,写出
,写出 转化为
转化为 的化学方程式:
的化学方程式:(3)“水浸”加入
 调节溶液的pH为8.5,可完全除去的金属离子有
调节溶液的pH为8.5,可完全除去的金属离子有 不能使
不能使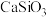 完全转化为
完全转化为 ,原因是
,原因是(4)“离子交换”与“洗脱”可表示为
 (
( 为强碱性阴离子交换树脂,
为强碱性阴离子交换树脂, 为
为 在水溶液中的实际存在形式),则“洗脱”过程中“淋洗液”最好选用
在水溶液中的实际存在形式),则“洗脱”过程中“淋洗液”最好选用(5)“沉钒”过程析出
 晶体,需要加入过量
晶体,需要加入过量 ,目的是
,目的是(6)下列金属冶炼方法中,与本工艺流程中冶炼钒的方法相似的是___________(填字母)。
| A.高炉炼铁 | B.电解熔融氯化钠制钠 |
| C.铝热反应制锰 | D.氧化汞分解制汞 |
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐2】已知A~N分别代表一种物质,它们之间的转化关系如图所示(部分反应的反应条件和生成物已略去)。A、B、C分别是由短周期元素组成的单质,A是金属,D是无色液体。F是一种离子化含物,其阴阳离子的个数比为1:3,且能与水反应得到两种碱。反应①是实验室检验某离子的方法,反应②是工业、生产N的重要反应。请回答下列问题:
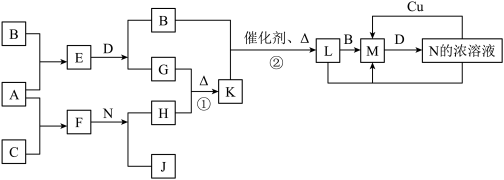
(1)B元素在元素周期表中的位置是__________ ,F的电子式是_____________ 。
(2)写出反应①的离子方程式:___________ ;
(3)Cu与足量的N的浓溶液反应得到的产物主要是M不是L,其原因是__________ (请用上图所示关系中反应的化学方程式回答)。
(4)选择性催化还原(SCR)是在有催化剂的条件下将M转变为无毒的物质,这是目前国外进行尾气治理遍采用的一种方法。亚铬酸铜(Adkin偿化剂)是极好的M催化还原的催化剂,是铜和铬的复合氧化物,成分不固定,如:aCuO·bCr2O3等,统称为亚铬酸铜。其中:CuNH4(OH)CrO4在295℃分解生成复合的氧化物(催化剂)、氮气及水,写出该反应的化学方程式:______________________ 。
(5)已知一定温度(>100℃)下,反应②的平衡常数为1。将0.8molK和1.1molB放入容积为1L的封闭容器中,发生反应②,一段时间后L的浓度为0.4mol/L,此时反应v正_____ v逆(填“>”、“<”或“=”)。当反应到达平衡后,保持温度不变,再加入一定物质的量的B,重新达到平衡,则L的平衡浓度__________ (填“增大”、“不变”或“减小”),B的转化率_________ 。(填“升高”、“不变”或“降低”),L的体积分数___________ (填“增大”、“不变”、“减小”或“无法确定”)。

(1)B元素在元素周期表中的位置是
(2)写出反应①的离子方程式:
(3)Cu与足量的N的浓溶液反应得到的产物主要是M不是L,其原因是
(4)选择性催化还原(SCR)是在有催化剂的条件下将M转变为无毒的物质,这是目前国外进行尾气治理遍采用的一种方法。亚铬酸铜(Adkin偿化剂)是极好的M催化还原的催化剂,是铜和铬的复合氧化物,成分不固定,如:aCuO·bCr2O3等,统称为亚铬酸铜。其中:CuNH4(OH)CrO4在295℃分解生成复合的氧化物(催化剂)、氮气及水,写出该反应的化学方程式:
(5)已知一定温度(>100℃)下,反应②的平衡常数为1。将0.8molK和1.1molB放入容积为1L的封闭容器中,发生反应②,一段时间后L的浓度为0.4mol/L,此时反应v正
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
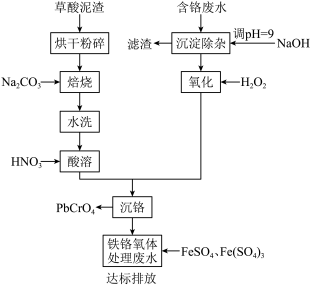
【推荐3】铬酸铅俗称铬黄,主要用于油漆、油墨、塑料以及橡胶等行业。一种以含铬废水(含Cr3+、Fe3+、Cu2+)和草酸泥渣(含草酸铅、硫酸铅)为原料制备铬酸铅的工艺流程如下:
回答下列问题
(1)草酸泥渣“粉碎”的目的是___________ ,“焙烧”时加入碳酸钠是为了将硫酸铅转化为PbO,同时放出CO2,该转化过程的化学方程式为___________ 。
(2)滤渣的主要成分为___________ 、___________ 。(填化学式)
(3)“沉淀除杂”所得滤液中含铬化合物主要为___________ 。(填化学式)
(4)“氧化”工序中发生反应的离子方程式为___________ 。
(5)为了提高沉铬率,用平衡移动原理解释“酸溶”过程中所加硝酸不能过量的原因:___________ 。
(6)处理含 的废水时,Cr(Ⅵ)被还原成Cr(Ⅲ)。若投入10molFeSO4,使金属阳离子恰好完全形成铁铬氧体(FeO·FexCryO3,其中FexCryO3中Fe为+3价)沉淀,理论上还需要投入Fe2(SO4)3的物质的量为
的废水时,Cr(Ⅵ)被还原成Cr(Ⅲ)。若投入10molFeSO4,使金属阳离子恰好完全形成铁铬氧体(FeO·FexCryO3,其中FexCryO3中Fe为+3价)沉淀,理论上还需要投入Fe2(SO4)3的物质的量为___________ mol。

回答下列问题
(1)草酸泥渣“粉碎”的目的是
(2)滤渣的主要成分为
(3)“沉淀除杂”所得滤液中含铬化合物主要为
(4)“氧化”工序中发生反应的离子方程式为
(5)为了提高沉铬率,用平衡移动原理解释“酸溶”过程中所加硝酸不能过量的原因:
(6)处理含
 的废水时,Cr(Ⅵ)被还原成Cr(Ⅲ)。若投入10molFeSO4,使金属阳离子恰好完全形成铁铬氧体(FeO·FexCryO3,其中FexCryO3中Fe为+3价)沉淀,理论上还需要投入Fe2(SO4)3的物质的量为
的废水时,Cr(Ⅵ)被还原成Cr(Ⅲ)。若投入10molFeSO4,使金属阳离子恰好完全形成铁铬氧体(FeO·FexCryO3,其中FexCryO3中Fe为+3价)沉淀,理论上还需要投入Fe2(SO4)3的物质的量为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】甲烷水蒸气重整反应是工业制备氢气的重要方式,在催化剂(如镍)表面发生的主要反应有:
①
 kJ⋅mol-1
kJ⋅mol-1
②

副反应: ,
,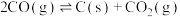 ,
,
Ⅰ.已知: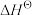 为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成1 mol该物质的焓变。对于稳定相态单质,其
为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成1 mol该物质的焓变。对于稳定相态单质,其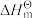 为零。
为零。
例如C(石墨)
 kJ·mol-1,则
kJ·mol-1,则 的标准生成焓为-393.5 kJ⋅mol-1。
的标准生成焓为-393.5 kJ⋅mol-1。
(1)
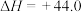 kJ⋅mol-1,结合表中数据计算反应
kJ⋅mol-1,结合表中数据计算反应
___________ 。
(2)在镍催化剂表面甲烷和水蒸气发生反应,最后生成CO、 和
和 ,反应机理如下,请补充其中的两个反应方程式(Z表示催化剂的活性中心)。
,反应机理如下,请补充其中的两个反应方程式(Z表示催化剂的活性中心)。
a. ;
;
b.___________ ;
c. ;
;
d.___________ ;
e.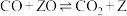
Ⅱ.在一体积可变的密闭容器中,投入一定量的 和
和 发生甲烷水蒸气重整反应。
发生甲烷水蒸气重整反应。
(3)下列有关说法正确的是___________。
(4)维持压强100 kPa,平衡时 、
、 、CO、
、CO、 的体积分数分别为a、b、c、d,反应①的平衡常数
的体积分数分别为a、b、c、d,反应①的平衡常数
___________  (用含字母的式子表示。
(用含字母的式子表示。 是以分压表示的平衡常数,分压=总压×体积分数)。
是以分压表示的平衡常数,分压=总压×体积分数)。
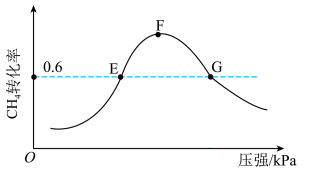
(5)500℃时,反应相同时间后测得 的转化率随压强的变化如图所示。则图中E点和G点CH4的浓度大小关系为c(E)
的转化率随压强的变化如图所示。则图中E点和G点CH4的浓度大小关系为c(E)___________ c(G)(填“>”“<”或“=”)。
(6)通过甲烷水蒸气重整反应的平衡含量计算,以及析碳条件的判断,该转化需适当增大水碳比[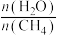 ],请分析可能的原因:
],请分析可能的原因:___________ 。
①

 kJ⋅mol-1
kJ⋅mol-1②


副反应:
 ,
,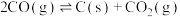 ,
,
Ⅰ.已知:
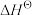 为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成1 mol该物质的焓变。对于稳定相态单质,其
为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成1 mol该物质的焓变。对于稳定相态单质,其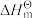 为零。
为零。例如C(石墨)

 kJ·mol-1,则
kJ·mol-1,则 的标准生成焓为-393.5 kJ⋅mol-1。
的标准生成焓为-393.5 kJ⋅mol-1。| 物质 |  |  | CO |
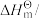 /kJ⋅mol-1 /kJ⋅mol-1 | -285.8 | -393.5 | -110.5 |

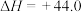 kJ⋅mol-1,结合表中数据计算反应
kJ⋅mol-1,结合表中数据计算反应
(2)在镍催化剂表面甲烷和水蒸气发生反应,最后生成CO、
 和
和 ,反应机理如下,请补充其中的两个反应方程式(Z表示催化剂的活性中心)。
,反应机理如下,请补充其中的两个反应方程式(Z表示催化剂的活性中心)。a.
 ;
; b.
c.
 ;
;d.
e.
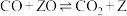
Ⅱ.在一体积可变的密闭容器中,投入一定量的
 和
和 发生甲烷水蒸气重整反应。
发生甲烷水蒸气重整反应。(3)下列有关说法正确的是___________。
A. 浓度不变,说明体系已达平衡状态 浓度不变,说明体系已达平衡状态 |
| B.反应②前后气体物质的量不变,所以此反应熵变为0 |
C.在催化剂表面, 、 、 分子中的化学键被削弱 分子中的化学键被削弱 |
D.在体系中通入适量的 ,有利于减少积碳,从而有利于反应进行 ,有利于减少积碳,从而有利于反应进行 |
 、
、 、CO、
、CO、 的体积分数分别为a、b、c、d,反应①的平衡常数
的体积分数分别为a、b、c、d,反应①的平衡常数
 (用含字母的式子表示。
(用含字母的式子表示。 是以分压表示的平衡常数,分压=总压×体积分数)。
是以分压表示的平衡常数,分压=总压×体积分数)。(5)500℃时,反应相同时间后测得
 的转化率随压强的变化如图所示。则图中E点和G点CH4的浓度大小关系为c(E)
的转化率随压强的变化如图所示。则图中E点和G点CH4的浓度大小关系为c(E)
(6)通过甲烷水蒸气重整反应的平衡含量计算,以及析碳条件的判断,该转化需适当增大水碳比[
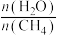 ],请分析可能的原因:
],请分析可能的原因:
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】丙烯腈( )是合成橡胶及合成树脂等工业中的重要原料,以
)是合成橡胶及合成树脂等工业中的重要原料,以
 为原料合成丙烯腈的反应过程如下:
为原料合成丙烯腈的反应过程如下:
反应Ⅰ:
反应Ⅱ:
科学家通过 计算得出反应Ⅱ的历程包含p、q两步,其中p步反应的化学方程式为:
计算得出反应Ⅱ的历程包含p、q两步,其中p步反应的化学方程式为:
| 化学键 |  | 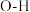 |  | 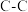 | 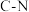 | 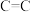 | 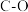 |  |  |
| 键能(kJ·mol-1) | 413 | 463 | 389 | 348 | 305 | 615 | 351 | 745 | 891 |
(2)在盛有催化剂
 、压强为
、压强为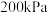 的恒压密闭容器中按体积比
的恒压密闭容器中按体积比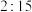 充入
充入 和NH3发生反应,通过实验测得平衡体系中含碳物质(乙醇除外)的物质的量分数随温度的变化如下图所示。
和NH3发生反应,通过实验测得平衡体系中含碳物质(乙醇除外)的物质的量分数随温度的变化如下图所示。

②含碳物质检测过程中,未检测出 ,反应活化能相对大小应为p
,反应活化能相对大小应为p
 的体积分数
的体积分数④N点时,反应Ⅱ的压强平衡常数

 (保留三位有效数字);
(保留三位有效数字); 范围内,物质的量分数表示的平衡常数
范围内,物质的量分数表示的平衡常数 的相对大小:反应Ⅰ
的相对大小:反应Ⅰ⑤上述条件下丙烯腈的平衡产率不高,实际生产中会向反应器中再充入一定量
 (不参与反应),请解释该操作的目的并说明理由
(不参与反应),请解释该操作的目的并说明理由
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】对 的资源化利用是人类常期研究的课题。
的资源化利用是人类常期研究的课题。
(1)1902年, 首次报道了
首次报道了 的甲烷化。
的甲烷化。
①已知:I.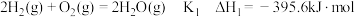
Ⅱ.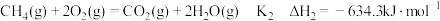
 甲烷化反应Ⅲ.
甲烷化反应Ⅲ.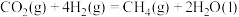 的
的
___________  ,平衡常数
,平衡常数
___________ (用 表示)。
表示)。
② 加氢合成甲烷时,通常控制温度为500℃左右,其原因不可能为
加氢合成甲烷时,通常控制温度为500℃左右,其原因不可能为___________ 。
A.反应速率快 B.平衡转化率高 C.催化剂活性高 D.主反应催化剂选择性好
(2) 负载金属
负载金属 催化
催化 甲烷化可能存在的两种反应机理如图所示。
甲烷化可能存在的两种反应机理如图所示。
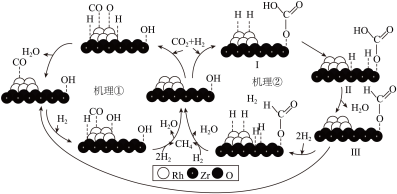
①上述两种不同机理发生机制的关键为: 和
和 在催化剂表面不同活性位点吸附、活化形成中间体。若发生机理①,则
在催化剂表面不同活性位点吸附、活化形成中间体。若发生机理①,则 吸附在
吸附在___________ 上。
②机理①和②都会产生中间体 。其产生的原因可能是
。其产生的原因可能是___________ 或吸附在载体 的
的 原子表面的(
原子表面的( 衍生物中间体)甲酸盐解离产生。
衍生物中间体)甲酸盐解离产生。
③中间体Ⅱ转化为中间体Ⅲ的过程可用反应式表示为___________ 。
(3)利用介孔限域催化温室气体加氢制甲醇,是解决能源问题与实现双碳目标的主要技术之一,主反应如下: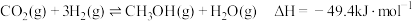 。
。
①此反应在___________ (填“高温”、“低温”或“任何温度”)下能自发进行。
②我国学者研究发现,在单原子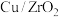 催化时,该反应的历程为:
催化时,该反应的历程为:
第一步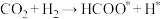
第二步
第三步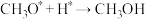
中间体 与
与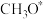 物质的量之比随时间变化如下图:
物质的量之比随时间变化如下图:
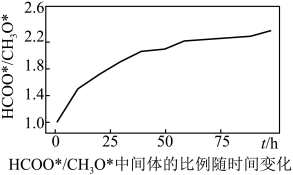
回答下列问题:
i.基态铜原子价层电子轨道表达式:___________ 。
ii.反应历程中,第___________ 步反应的活化能最高,是反应的决速步聚,判断的理由是___________ 。
 的资源化利用是人类常期研究的课题。
的资源化利用是人类常期研究的课题。(1)1902年,
 首次报道了
首次报道了 的甲烷化。
的甲烷化。①已知:I.
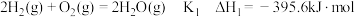
Ⅱ.
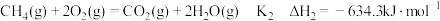
 甲烷化反应Ⅲ.
甲烷化反应Ⅲ.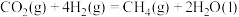 的
的
 ,平衡常数
,平衡常数
 表示)。
表示)。②
 加氢合成甲烷时,通常控制温度为500℃左右,其原因不可能为
加氢合成甲烷时,通常控制温度为500℃左右,其原因不可能为A.反应速率快 B.平衡转化率高 C.催化剂活性高 D.主反应催化剂选择性好
(2)
 负载金属
负载金属 催化
催化 甲烷化可能存在的两种反应机理如图所示。
甲烷化可能存在的两种反应机理如图所示。
①上述两种不同机理发生机制的关键为:
 和
和 在催化剂表面不同活性位点吸附、活化形成中间体。若发生机理①,则
在催化剂表面不同活性位点吸附、活化形成中间体。若发生机理①,则 吸附在
吸附在②机理①和②都会产生中间体
 。其产生的原因可能是
。其产生的原因可能是 的
的 原子表面的(
原子表面的( 衍生物中间体)甲酸盐解离产生。
衍生物中间体)甲酸盐解离产生。③中间体Ⅱ转化为中间体Ⅲ的过程可用反应式表示为
(3)利用介孔限域催化温室气体加氢制甲醇,是解决能源问题与实现双碳目标的主要技术之一,主反应如下:
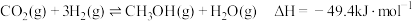 。
。①此反应在
②我国学者研究发现,在单原子
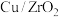 催化时,该反应的历程为:
催化时,该反应的历程为:第一步
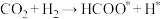
第二步

第三步
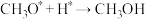
中间体
 与
与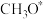 物质的量之比随时间变化如下图:
物质的量之比随时间变化如下图:
回答下列问题:
i.基态铜原子价层电子轨道表达式:
ii.反应历程中,第
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】五氧化二碘( )是一种重要的工业试剂,常温下为白色针状晶体,可作氧化剂,除去空气中的一氧化碳。
)是一种重要的工业试剂,常温下为白色针状晶体,可作氧化剂,除去空气中的一氧化碳。
反应Ⅰ: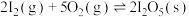
 K1;
K1;
反应Ⅱ: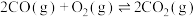
 K2;
K2;
反应Ⅲ:
 K3。
K3。
回答下列问题:
(1)对于上述反应Ⅰ、Ⅱ、Ⅲ:
___________ (用含 、
、 的代数式表示),K3=
的代数式表示),K3=___________ (用含K1、K2的代数式表示)。
(2) 时向盛有足量
时向盛有足量 的V L恒容密闭容器中通入0.8 mol CO,此时压强为p,仅发生反应
的V L恒容密闭容器中通入0.8 mol CO,此时压强为p,仅发生反应
 ,
, 时,
时, min后,该反应达到平衡,且反应达到平衡后固体质量减小6.4 g。
min后,该反应达到平衡,且反应达到平衡后固体质量减小6.4 g。
①下列关于反应 的说法正确的是
的说法正确的是___________ (填标号)。
A.仅加入合适的催化剂,反应速率加快且 的值变大
的值变大
B.平衡后,移除少量I2(s),CO的转化率不变
C.每断裂1 mol C=O键,同时消耗0.5 mol CO,则该反应达到平衡
D.仅充入少量稀有气体,正、逆反应速率均增大
②T1℃时,该反应达到平衡时的平衡常数Kp=___________ (分压=总压×物质的量分数)。
 )是一种重要的工业试剂,常温下为白色针状晶体,可作氧化剂,除去空气中的一氧化碳。
)是一种重要的工业试剂,常温下为白色针状晶体,可作氧化剂,除去空气中的一氧化碳。反应Ⅰ:
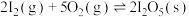
 K1;
K1;反应Ⅱ:
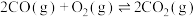
 K2;
K2;反应Ⅲ:

 K3。
K3。回答下列问题:
(1)对于上述反应Ⅰ、Ⅱ、Ⅲ:

 、
、 的代数式表示),K3=
的代数式表示),K3=(2)
 时向盛有足量
时向盛有足量 的V L恒容密闭容器中通入0.8 mol CO,此时压强为p,仅发生反应
的V L恒容密闭容器中通入0.8 mol CO,此时压强为p,仅发生反应
 ,
, 时,
时, min后,该反应达到平衡,且反应达到平衡后固体质量减小6.4 g。
min后,该反应达到平衡,且反应达到平衡后固体质量减小6.4 g。①下列关于反应
 的说法正确的是
的说法正确的是A.仅加入合适的催化剂,反应速率加快且
 的值变大
的值变大B.平衡后,移除少量I2(s),CO的转化率不变
C.每断裂1 mol C=O键,同时消耗0.5 mol CO,则该反应达到平衡
D.仅充入少量稀有气体,正、逆反应速率均增大
②T1℃时,该反应达到平衡时的平衡常数Kp=
您最近一年使用:0次
【推荐2】科学家开发催化剂实现 催化还原制备附加值高的产品。利用
催化还原制备附加值高的产品。利用 制备甲醇的有关反应如下:
制备甲醇的有关反应如下:
Ⅰ.
Ⅱ.
(1)已知几种共价键的键能如下:
利用键能数据计算:
___________  。
。
(2)一定温度下,在恒容密闭容器中充入等体积的 、
、 ,仅发生反应Ⅰ,下列叙述正确的是
,仅发生反应Ⅰ,下列叙述正确的是___________ (填标号)。
A.平衡后充入氦气,正反应速率增大
B. 的体积分数不变时达到平衡状态
的体积分数不变时达到平衡状态
C.平衡后充入少量 ,
, 平衡转化率增大
平衡转化率增大
(3)在一恒容反应器中充入一定量的 、
、 ,仅发生反应Ⅱ,平衡常数(K)与温度(T)的关系如下:
,仅发生反应Ⅱ,平衡常数(K)与温度(T)的关系如下:
①
___________ (填“>”“<”或“=”)0。
②1200℃时,某时刻反应体系中 ,
, ,此时平衡
,此时平衡___________ (填“向正反应方向”“向逆反应方向”或“不”)移动。
(4)一定条件下,速率常数与活化能、温度的关系式为 +C(R、C为常数,
+C(R、C为常数, 为速率常数,
为速率常数, 为活化能,T为温度)。一定温度下,合成甲醇的速率常数在不同催化剂(Catl、Cat2)作用下,与温度的关系如图1所示。
为活化能,T为温度)。一定温度下,合成甲醇的速率常数在不同催化剂(Catl、Cat2)作用下,与温度的关系如图1所示。 为
为___________  ;催化效果更好的是
;催化效果更好的是___________ (填“Cat1”或“Cat2”)。
(5)在一定温度下,向甲、乙两密闭反应器中分别充入 和
和 ,分别在有水分子隔离膜、无水分子隔离膜作用下发生上述两个反应,测得
,分别在有水分子隔离膜、无水分子隔离膜作用下发生上述两个反应,测得 平衡转化率与压强的关系如图2所示。
平衡转化率与压强的关系如图2所示。___________ (填“甲”或“乙”),理由是___________ 。
②已知M点 选择性为80%,该温度下,M点反应Ⅱ的平衡常数
选择性为80%,该温度下,M点反应Ⅱ的平衡常数 为
为___________ (结果保留三位有效数字)。提示:分压=总压×物质的量分数, 选择性等于
选择性等于 的物质的量与
的物质的量与 转化的总物质的量之比。
转化的总物质的量之比。
 催化还原制备附加值高的产品。利用
催化还原制备附加值高的产品。利用 制备甲醇的有关反应如下:
制备甲醇的有关反应如下:Ⅰ.

Ⅱ.

(1)已知几种共价键的键能如下:
| 共价键 |  |  |  |  |  |
| 键能/(kJ/mol) | 799 | 436 | 413 | 358 | 467 |

 。
。(2)一定温度下,在恒容密闭容器中充入等体积的
 、
、 ,仅发生反应Ⅰ,下列叙述正确的是
,仅发生反应Ⅰ,下列叙述正确的是A.平衡后充入氦气,正反应速率增大
B.
 的体积分数不变时达到平衡状态
的体积分数不变时达到平衡状态C.平衡后充入少量
 ,
, 平衡转化率增大
平衡转化率增大(3)在一恒容反应器中充入一定量的
 、
、 ,仅发生反应Ⅱ,平衡常数(K)与温度(T)的关系如下:
,仅发生反应Ⅱ,平衡常数(K)与温度(T)的关系如下: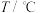 | 700 | 800 | 830 | 1000 | 1200 |
 | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |

②1200℃时,某时刻反应体系中
 ,
, ,此时平衡
,此时平衡(4)一定条件下,速率常数与活化能、温度的关系式为
 +C(R、C为常数,
+C(R、C为常数, 为速率常数,
为速率常数, 为活化能,T为温度)。一定温度下,合成甲醇的速率常数在不同催化剂(Catl、Cat2)作用下,与温度的关系如图1所示。
为活化能,T为温度)。一定温度下,合成甲醇的速率常数在不同催化剂(Catl、Cat2)作用下,与温度的关系如图1所示。
 为
为 ;催化效果更好的是
;催化效果更好的是(5)在一定温度下,向甲、乙两密闭反应器中分别充入
 和
和 ,分别在有水分子隔离膜、无水分子隔离膜作用下发生上述两个反应,测得
,分别在有水分子隔离膜、无水分子隔离膜作用下发生上述两个反应,测得 平衡转化率与压强的关系如图2所示。
平衡转化率与压强的关系如图2所示。
②已知M点
 选择性为80%,该温度下,M点反应Ⅱ的平衡常数
选择性为80%,该温度下,M点反应Ⅱ的平衡常数 为
为 选择性等于
选择性等于 的物质的量与
的物质的量与 转化的总物质的量之比。
转化的总物质的量之比。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】重庆市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2. 5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:

根据表中数据判断PM2.5待测试样的pH约为____________ 。
(2)为减少SO2的排放,常采取的措施有:将煤转化为清洁气体燃料。
已知:①2H2(g)+O2(g)═2H2O(g)K1 ②2C(s)+O2(g)═2CO(g)K2
C(s)+H2O(g)=CO(g)+H2(g) K=___________________ (用含K1、K2的式子表示)。
(3)汽车尾气净化的主要原理为:2NO(g)+2CO(g) 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。
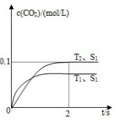
①在T2温度下,0~2s内的平均反应速率υ(N2)=______________ 。
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2,在如图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。___________
(4)①已知气缸中生成NO的反应为:N2(g)+O2(g) 2NO(g) △H>0,若1mol空气含0.8molN2和0.2molO2, 1300°C时在密闭容器内反应达到平衡,测得NO为8×10-4mol.计算该温度下的平衡常数K=
2NO(g) △H>0,若1mol空气含0.8molN2和0.2molO2, 1300°C时在密闭容器内反应达到平衡,测得NO为8×10-4mol.计算该温度下的平衡常数K=____________ 。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)═2C(s)+O2(g)已知该反应的△H>0,简述该设想能否实现的依据:__________________ 。
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:

根据表中数据判断PM2.5待测试样的pH约为
(2)为减少SO2的排放,常采取的措施有:将煤转化为清洁气体燃料。
已知:①2H2(g)+O2(g)═2H2O(g)K1 ②2C(s)+O2(g)═2CO(g)K2
C(s)+H2O(g)=CO(g)+H2(g) K=
(3)汽车尾气净化的主要原理为:2NO(g)+2CO(g)
 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。
①在T2温度下,0~2s内的平均反应速率υ(N2)=
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2,在如图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
(4)①已知气缸中生成NO的反应为:N2(g)+O2(g)
 2NO(g) △H>0,若1mol空气含0.8molN2和0.2molO2, 1300°C时在密闭容器内反应达到平衡,测得NO为8×10-4mol.计算该温度下的平衡常数K=
2NO(g) △H>0,若1mol空气含0.8molN2和0.2molO2, 1300°C时在密闭容器内反应达到平衡,测得NO为8×10-4mol.计算该温度下的平衡常数K=②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)═2C(s)+O2(g)已知该反应的△H>0,简述该设想能否实现的依据:
您最近一年使用:0次