名校
解题方法
1 . 下列说法不正确的是
A.向 溶液中加入稀硫酸,溶液颜色由橙色变为黄色 溶液中加入稀硫酸,溶液颜色由橙色变为黄色 |
| B.中和滴定实验中,锥形瓶用水洗涤后,不能用待测液润洗 |
| C.中和反应反应热测定实验中,一组完整实验数据需要测温度3次 |
D.配制 溶液时,应将 溶液时,应将 固体溶于较浓的盐酸中,再加水稀释到所需浓度 固体溶于较浓的盐酸中,再加水稀释到所需浓度 |
您最近一年使用:0次
名校
2 . 已知: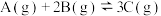
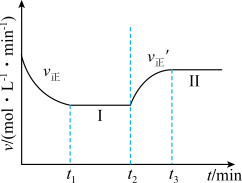
 向一恒温恒容的密闭容器中充入1mol A和3mol B发生反应,
向一恒温恒容的密闭容器中充入1mol A和3mol B发生反应, 时达到平衡状态Ⅰ,在
时达到平衡状态Ⅰ,在 时改变某一条件,
时改变某一条件, 时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是
时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是
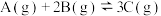
 向一恒温恒容的密闭容器中充入1mol A和3mol B发生反应,
向一恒温恒容的密闭容器中充入1mol A和3mol B发生反应, 时达到平衡状态Ⅰ,在
时达到平衡状态Ⅰ,在 时改变某一条件,
时改变某一条件, 时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是
时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是
A.平衡时A的体积分数 |
| B.容器内气体的平均相对分子质量不变,表明反应达到平衡 |
C. 时改变的条件:向容器中加入B 时改变的条件:向容器中加入B |
D.平衡常数 |
您最近一年使用:0次
2023-11-04更新
|
326次组卷
|
4卷引用:河南省焦作市博爱县第一中学2023-2024学年高二下学期开学化学试题
名校
解题方法
3 . 某小组同学探究盐对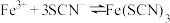 平衡体系的影响。
平衡体系的影响。
实验Ⅰ:探究KCl对 和
和 平衡体系的影响
平衡体系的影响
将等体积、低浓度的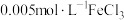 溶液(已用稀盐酸酸化)和
溶液(已用稀盐酸酸化)和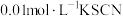 溶液混合,静置至体系达平衡,得红色浴液a.各取3mL溶液a放入3支比色皿中,分别滴加0.1mL不同浓度的KCl溶液,并测定各溶液的透光率随时间的变化,结果如图所示。
溶液混合,静置至体系达平衡,得红色浴液a.各取3mL溶液a放入3支比色皿中,分别滴加0.1mL不同浓度的KCl溶液,并测定各溶液的透光率随时间的变化,结果如图所示。

已知:①溶液的透光率与溶液颜色深浅有关,颜色深,透光率低。
② 在水溶液中由于水解而显黄色;
在水溶液中由于水解而显黄色; 溶液中存在
溶液中存在 (黄色)。
(黄色)。
(1)稀盐酸酸化 溶液的目的是
溶液的目的是___________ 。采用浓度较低的 溶液制备
溶液制备 和
和 平衡体系,是为了避免
平衡体系,是为了避免___________ (填离子符号)的颜色对实验干扰。
(2)从实验结果来看,KCl溶液确实对 和
和 平衡体系有影响,且随着KCl浓度增大,
平衡体系有影响,且随着KCl浓度增大, 平衡向
平衡向___________ (填“正”或“逆”)反应方向移动。
同学查阅相关资料,认为可能的原因有:
原因1:溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。KCl溶液的加入使 和
和 平衡状态因盐效应而发生变化。
平衡状态因盐效应而发生变化。
原因2:溶液中存在副反应 ,离子浓度发生变化,导致
,离子浓度发生变化,导致 和
和 平衡状态发生变化。
平衡状态发生变化。
(3)基于以上分析,该组同学取等体积的溶液a,分别加入等物质的量的不同种类的盐晶体(忽略溶液体积变化),观察颜色变化,结果如下表。
①上述实验可证明盐效应影响了 和
和 平衡体系的是
平衡体系的是___________ (填字母序号)。
a.1和2 b.1和3 c.1和4
②选择实验___________ (填序号)可得出结论: 的盐效应弱于
的盐效应弱于 的盐效应。
的盐效应。
(4)取等体积的溶液a继续进行实验,结果如下表。
上述实验可证明副反应影响了 和
和 平衡体系,结合实验现象及化学用语分析副反应对
平衡体系,结合实验现象及化学用语分析副反应对 和
和 平衡体系有影响的原因:
平衡体系有影响的原因:___________ 。
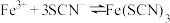 平衡体系的影响。
平衡体系的影响。实验Ⅰ:探究KCl对
 和
和 平衡体系的影响
平衡体系的影响将等体积、低浓度的
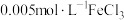 溶液(已用稀盐酸酸化)和
溶液(已用稀盐酸酸化)和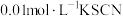 溶液混合,静置至体系达平衡,得红色浴液a.各取3mL溶液a放入3支比色皿中,分别滴加0.1mL不同浓度的KCl溶液,并测定各溶液的透光率随时间的变化,结果如图所示。
溶液混合,静置至体系达平衡,得红色浴液a.各取3mL溶液a放入3支比色皿中,分别滴加0.1mL不同浓度的KCl溶液,并测定各溶液的透光率随时间的变化,结果如图所示。
已知:①溶液的透光率与溶液颜色深浅有关,颜色深,透光率低。
②
 在水溶液中由于水解而显黄色;
在水溶液中由于水解而显黄色; 溶液中存在
溶液中存在 (黄色)。
(黄色)。(1)稀盐酸酸化
 溶液的目的是
溶液的目的是 溶液制备
溶液制备 和
和 平衡体系,是为了避免
平衡体系,是为了避免(2)从实验结果来看,KCl溶液确实对
 和
和 平衡体系有影响,且随着KCl浓度增大,
平衡体系有影响,且随着KCl浓度增大, 平衡向
平衡向同学查阅相关资料,认为可能的原因有:
原因1:溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。KCl溶液的加入使
 和
和 平衡状态因盐效应而发生变化。
平衡状态因盐效应而发生变化。原因2:溶液中存在副反应
 ,离子浓度发生变化,导致
,离子浓度发生变化,导致 和
和 平衡状态发生变化。
平衡状态发生变化。(3)基于以上分析,该组同学取等体积的溶液a,分别加入等物质的量的不同种类的盐晶体(忽略溶液体积变化),观察颜色变化,结果如下表。
| 序号 | 加入少量盐 | 溶液颜色 |
| 1 | 无 | 红色 |
| 2 | KCl | 变浅 |
| 3 |  | 略变浅 |
| 4 | NaCl | 变浅程度较大 |
 和
和 平衡体系的是
平衡体系的是a.1和2 b.1和3 c.1和4
②选择实验
 的盐效应弱于
的盐效应弱于 的盐效应。
的盐效应。(4)取等体积的溶液a继续进行实验,结果如下表。
| 序号 | 加入溶液 | 溶液颜色 |
| 5 | 1mL浓盐酸 | 明显变浅,溶液偏黄 |
| 6 | 1mL去离子水 | 略变浅 |
 和
和 平衡体系,结合实验现象及化学用语分析副反应对
平衡体系,结合实验现象及化学用语分析副反应对 和
和 平衡体系有影响的原因:
平衡体系有影响的原因:
您最近一年使用:0次
2023-04-20更新
|
117次组卷
|
4卷引用:河南省郑州市宇华实验学校2023-2024学年高二下学期开学考试化学试题
名校
4 . 某MOFs多孔材料孔径大小和形状恰好将N2O4“固定”,能高选择性吸附NO2。废气中的NO2被吸附后,经处理能全部转化为HNO3。原理如图。已知: ,△H<0,下列说法不正确的是
,△H<0,下列说法不正确的是
 ,△H<0,下列说法不正确的是
,△H<0,下列说法不正确的是
| A.气体温度升高后有利于N2O4的固定 |
B.使用多孔材料不能改变 的焓变 的焓变 |
C.使用多孔材料能促进 平衡正向移动,有利于NO2的去除 平衡正向移动,有利于NO2的去除 |
D.加入 H2O和O2,发生化学反应方程式为: |
您最近一年使用:0次
2023-02-22更新
|
311次组卷
|
2卷引用:河南省周口市川汇区周口恒大中学2023-2024学年高二下学期开学化学试题
名校
5 . 已知:水溶液中,[Cu(H2O)4]2+呈蓝色,[CuCl4]2-呈绿色,二者存在如下转化:[Cu(H2O)4]2+(aq)+4Cl-(aq) [CuCl4]2-(aq)+4H2O(l)。用CuCl2的稀溶液做如图实验,溶液的颜色变化如图所示:
[CuCl4]2-(aq)+4H2O(l)。用CuCl2的稀溶液做如图实验,溶液的颜色变化如图所示:
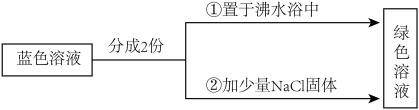
下列说法正确的是
 [CuCl4]2-(aq)+4H2O(l)。用CuCl2的稀溶液做如图实验,溶液的颜色变化如图所示:
[CuCl4]2-(aq)+4H2O(l)。用CuCl2的稀溶液做如图实验,溶液的颜色变化如图所示:
下列说法正确的是
| A.由实验①可知,该反应为放热反应 |
B.该反应的平衡常数表达式为K= |
| C.实验②中由于c(Cl-)增大,导致平衡正向移动 |
| D.由实验①可知配离子的热稳定性:[Cu(H2O)4]2+>[CuCl4]2- |
您最近一年使用:0次
2023-02-05更新
|
143次组卷
|
3卷引用:河南省焦作市普通高中2022-2023学年高二下学期开学诊断考试化学试题
名校
6 . 某小组同学对FeCl3与KI的反应进行探究。
【初步探究】室温下进行下表所列实验。
(1)证明实验Ⅰ中有I2生成,加入的试剂为_______ 。
(2)实验Ⅱ可以证明Fe3+与I-发生可逆反应,其操作为_______ 。
(3)写出实验Ⅰ反应的离子方程式:_______ 。
(4)实验Ⅰ中溶液的颜色不变后再进行后续实验,其目的是_______ 。
【深入探究】20min后继续观察实验现象:实验Ⅰ溶液棕黄色变深;实验Ⅱ溶液红色变浅。
(5)已知在酸性较强的条件下,I-可被空气氧化为I2,故甲同学提出假设:该反应条件下空气将I-氧化为I2,使实验Ⅰ中溶液棕黄色变深。甲同学设计实验:_______ ,20 min内溶液不变蓝,证明该假设不成立,导致溶液不变蓝的因素 可能是_______ (写出1条即可)。
(6)乙同学查阅资料可知:FeCl3与KI的反应体系中还存在I-+I2 I
I ,I
,I 呈棕褐色。依据资料从平衡移动原理解释实验Ⅱ中20 min后溶液红色变浅的原因:
呈棕褐色。依据资料从平衡移动原理解释实验Ⅱ中20 min后溶液红色变浅的原因:_______ 。
【初步探究】室温下进行下表所列实验。
| 序号 | 操作 | 现象 |
| 实验Ⅰ | 取5 mL0.1 mol·L-1KI溶液,滴加0.1 mol·L-1FeCl3溶液5~6滴(混合溶液pH=5) | 溶液变为棕黄色 |
| 实验Ⅱ | _______ | 溶液变红 |
(2)实验Ⅱ可以证明Fe3+与I-发生可逆反应,其操作为
(3)写出实验Ⅰ反应的离子方程式:
(4)实验Ⅰ中溶液的颜色不变后再进行后续实验,其目的是
【深入探究】20min后继续观察实验现象:实验Ⅰ溶液棕黄色变深;实验Ⅱ溶液红色变浅。
(5)已知在酸性较强的条件下,I-可被空气氧化为I2,故甲同学提出假设:该反应条件下空气将I-氧化为I2,使实验Ⅰ中溶液棕黄色变深。甲同学设计实验:
(6)乙同学查阅资料可知:FeCl3与KI的反应体系中还存在I-+I2
 I
I ,I
,I 呈棕褐色。依据资料从平衡移动原理解释实验Ⅱ中20 min后溶液红色变浅的原因:
呈棕褐色。依据资料从平衡移动原理解释实验Ⅱ中20 min后溶液红色变浅的原因:
您最近一年使用:0次
2022-10-22更新
|
212次组卷
|
3卷引用:河南省周口恒大中学2022-2023学年高二下学期开学考试化学试题
名校
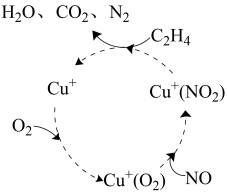
7 . 为减少大气污染,科学家采取多种措施处理工业废气中排放的氮氧化物(NOx)、SO2等。回答下列问题:
(1)某脱硝反应机理如图所示,Cu+的作用为____ ,C2H4参与的反应方程式为____ 。
(2)选择性催化还原技术(SCR)是目前较为成熟的烟气脱硝技术,其反应原理主要为:4NH3(g)+4NO(g)+O2(g) 4N2(g)+6H2O(g) △H=-1627kJ·mol-1。
4N2(g)+6H2O(g) △H=-1627kJ·mol-1。
①若有3molNO参与反应,则被NO氧化的NH3的物质的量为____ 。
②催化还原时应控制反应温度在315~400℃之间,反应温度不宜过高的原因是____ 。
③350℃时NO的百分含量与氨氮比的关系如图所示,若只改变氨气的投放量,当 >1.0时,烟气中NO含量反而增大,主要原因是
>1.0时,烟气中NO含量反而增大,主要原因是____ (用化学方程式表示)。

(3)烟气脱硫、脱硝一体化技术是大气污染防治研究的热点,ClO2在酸性条件下稳定,是性能优良的脱硫脱硝试剂。
①ClO 也是性能优良的脱硫脱硝试剂,ClO2与NaOH溶液反应生成NaClO3和NaClO2,反应的离子方程式为
也是性能优良的脱硫脱硝试剂,ClO2与NaOH溶液反应生成NaClO3和NaClO2,反应的离子方程式为____ 。
②某研究小组用ClO2进行单独脱除SO2实验时,测得SO2的脱除率随溶液pH变化如图所示。
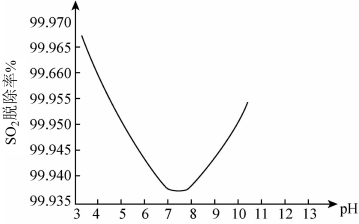
当3<pH<7时,随pH的增大,SO2脱除率逐渐降低,其原因是:____ ;在pH约7.8之后,随pH的增大,SO2脱除率又开始升高,其原因是____ 。
(1)某脱硝反应机理如图所示,Cu+的作用为

(2)选择性催化还原技术(SCR)是目前较为成熟的烟气脱硝技术,其反应原理主要为:4NH3(g)+4NO(g)+O2(g)
 4N2(g)+6H2O(g) △H=-1627kJ·mol-1。
4N2(g)+6H2O(g) △H=-1627kJ·mol-1。①若有3molNO参与反应,则被NO氧化的NH3的物质的量为
②催化还原时应控制反应温度在315~400℃之间,反应温度不宜过高的原因是
③350℃时NO的百分含量与氨氮比的关系如图所示,若只改变氨气的投放量,当
 >1.0时,烟气中NO含量反而增大,主要原因是
>1.0时,烟气中NO含量反而增大,主要原因是
(3)烟气脱硫、脱硝一体化技术是大气污染防治研究的热点,ClO2在酸性条件下稳定,是性能优良的脱硫脱硝试剂。
①ClO
 也是性能优良的脱硫脱硝试剂,ClO2与NaOH溶液反应生成NaClO3和NaClO2,反应的离子方程式为
也是性能优良的脱硫脱硝试剂,ClO2与NaOH溶液反应生成NaClO3和NaClO2,反应的离子方程式为②某研究小组用ClO2进行单独脱除SO2实验时,测得SO2的脱除率随溶液pH变化如图所示。

当3<pH<7时,随pH的增大,SO2脱除率逐渐降低,其原因是:
您最近一年使用:0次
2022-08-29更新
|
240次组卷
|
4卷引用:河南省百所名校2023届高三上学期开学摸底联考化学试题
名校
8 . 如图所示,三个烧瓶中分别充满NO2气体并分别装在盛有水的三个烧杯中,在①烧杯中加入CaO,在②烧杯中不加其他任何物质,在③烧杯中加入NH4Cl晶体,发现①中红棕色变深,③中红棕色变浅。已知:2NO2(红棕色) N2O4(无色),下列叙述正确的是
N2O4(无色),下列叙述正确的是
 N2O4(无色),下列叙述正确的是
N2O4(无色),下列叙述正确的是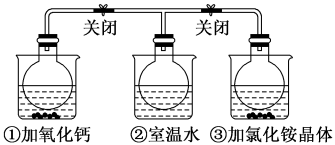
A.2NO2 N2O4是吸热反应 N2O4是吸热反应 |
| B.NH4Cl溶于水时吸收热量 |
| C.①烧瓶中平衡时混合气体的平均相对分子质量增大 |
| D.③烧瓶中气体的压强增大 |
您最近一年使用:0次
2022-08-28更新
|
1132次组卷
|
23卷引用:河南省信阳高级中学2020-2021学年高二下学期回顾测试化学试题
河南省信阳高级中学2020-2021学年高二下学期回顾测试化学试题【全国百强校】辽宁省鞍山市第一中学2018-2019学年高二下学期开学考试化学试题江西省赣州市第一中学2020-2021学年高二下学期开学测试化学试题(已下线)2010年北京市八一中学高二第二学期期末考试化学试卷2018版化学(苏教版)高考总复习专题七课时跟踪训练--化学平衡的移动新疆生产建设兵团第二中学2017-2018学年高二上学期第四次月考(期末)化学试题新疆自治区生产建设兵团第二中学2018-2019学年高二第一次月考化学试题陕西省延安市第一中学2019-2020学年高二上学期期中考试化学试题(已下线)专题7.2 化学平衡状态 化学平衡移动(练)-《2020年高考一轮复习讲练测》云南省普洱市江城县第一中学2019—2020学年高二上学期期末考试化学试题四川省泸州市泸县第二中学2019-2020学年高二下学期第一次在线月考化学试题黑龙江省大庆市第四中学2019-2020学年高二上学期第一次检测化学试题(已下线)2.3.2+影响化学平衡状态的因素-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)安徽省蚌埠田家炳中学2020-2021学年高二10月月考化学试题江西省上饶市2020-2021学年高二上学期期末教学质量测试化学试题福建省三明第一中学2021-2022学年高二上学期第一次月考化学试题福建省莆田市擢英中学2021-2022学年高二上学期第一次月考化学试卷(已下线)2.2.2 浓度商、温度对化学平衡的影响-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)黑龙江省伊春市伊美区第二中学2021-2022学年高二上学期期中考试化学试题广东省深圳市宝安区宝安中学2022-2023学年高一上学期期中考试化学试题新疆奇台县第一中学2022-2023学年高二上学期期中考试化学试题山东省淄博市部分学校联考2022-2023学年高一下学期4月期中考试化学试题(已下线)选择题11-15
9 . 元素铬(Cr)的几种化合物存在下列转化关系:

下列判断不正确的是

下列判断不正确的是
A.反应①表明 有酸性氧化物的性质 有酸性氧化物的性质 |
B.反应②中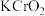 体现还原性 体现还原性 |
| C.反应③中溶液颜色变化是由化学平衡移动引起的 |
| D.反应①②③中铬元素的化合价均发生了变化 |
您最近一年使用:0次
10 . 如图是关于反应A2(g)+3B2(g)⇌2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是


| A.升高温度,同时加压 |
| B.降低温度,同时减压 |
| C.增大反应物浓度,同时减小生成物浓度 |
| D.增大反应物浓度,同时使用催化剂 |
您最近一年使用:0次
2021-09-02更新
|
868次组卷
|
52卷引用:河南省林州市第一中学分校(林虑中学)2017-2018学年高二上学期开学检测化学试题
河南省林州市第一中学分校(林虑中学)2017-2018学年高二上学期开学检测化学试题安徽省六安市第一中学2017-2018学年高二上学期开学考试化学试题河北省定州中学2017-2018学年高二上学期开学考试化学试题(已下线)2010—2011学年海南省洋浦中学高二上学期期末考试化学试卷(已下线)2011-2012年吉林省长春外国语学校高二上学期第一次月考化学试卷(已下线)2011-2012学年云南省蒙自县文澜高级中学高二上学期期中考试化学试卷(已下线)2011-2012学年贵州省凯里一中高二上学期期中考试化学试卷(已下线)2011-2012学年云南蒙自高中高二上学期期中考试化学试卷(已下线)2012-2013学年安徽省舒城晓天中学高二上学期第一次月考化学试卷(已下线)2012-2013学年浙江省宁海县正学中学高二下学期第一次阶段性测试化学试卷(已下线)2012-2013学年山东省临沭一中高二10月学情调查化学试卷(已下线)2014年高二化学人教版选修四 8化学平衡移动练习卷(已下线)2013-2014四川省雅安中学下学期期中考试高二化学试卷(已下线)2011-2012贵州省凯里一中第一学期期末考试高二化学试卷(已下线)2014-2015学年云南省玉溪市第一中学高二上学期期中考试化学试卷(已下线)2014-2015学年湖南省娄底市高二上学期期中联考化学试卷(已下线)2014-2015学年湖北省部分重点中学高二上学期期中考试化学试卷(已下线)2014秋河北省唐山一中高二上学期期中化学试卷(已下线)2014-2015学年辽宁师范大学附中高二10月模考化学试卷2015届吉林省东北师大附中高三上学期第三次摸底化学试卷2014-2015学年山东省微山一中高二下学期期末考试化学试卷2015-2016学年河北省成安一中高二上学期10月月考化学试卷2015-2016学年江苏省海安实验中学高二上学期期中选修化学试卷2015-2016学年四川省成都市六校高二上学期期中联考化学试卷2015-2016学年山东省泰安市高二上学期期末考试化学试卷2016-2017学年贵州省安顺平坝第一高级中学高二上期中化学卷2016-2017学年浙江省余姚中学高二上期中化学试卷河北省深州中学2016-2017学年高二下学期期末考试化学试题云南省姚安县第一中学2017-2018学年高二10月月考化学试题河北省故城县高级中学2018届高三12月月考化学试题甘肃省武威市第十八中2018-2019学年高二上学期第一次月考化学试题【区级联考】山东省济南市莱芜区2019届高三第一学期期末质量检测化学试题步步为赢 高二化学寒假作业:作业五 化学平衡的图像分析2020届人教版高三专题基础复习专题7《化学反应速率与化学平衡》测试卷黑龙江桦南二中2019-2020学年高二上学期期中考试化学试题天津市和平区2018-2019高二期末考试化学试题黑龙江省海林市朝鲜族中学2020-2021学年高二上学期第一次月考化学试题江苏省宿迁市沭阳县潼阳中学2020-2021学年高二下学期第一次月考化学试题山西省运城市稷山中学2022届高三上学期月考(一)化学试题(已下线)第19讲 化学平衡 (练) — 2022年高考化学一轮复习讲练测(新教材新高考)湖南省长沙市周南中学2021-2022学年高二上学期第一次月考化学试题(已下线)2.3.3 温度变化对化学平衡的影响-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)(已下线)考向22 化学平衡状态 化学平衡的移动-备战2022年高考化学一轮复习考点微专题(已下线)章末培优2 专题2 化学反应速率与化学平衡-2021-2022学年高二化学课后培优练(苏教教版2019选择性必修1)湖南省怀化市第五中学2021-2022学年高二上学期期中考试化学试题云南省玉溪师范学院附属中学2021-2022学年高三 上学期期末考试化学试题(已下线)第6章 化学反应速率和化学平衡复习-【帮课堂】2021-2022学年高一化学同步精品讲义(沪科版2020必修第二册)上海市嘉定区第一中学2021-2022学年高一下学期期期末考试化学试题(已下线)第19讲 化学平衡(练)-2023年高考化学一轮复习讲练测(新教材新高考)甘肃省武威市凉州区2020-2021学年高二上学期期末考试化学试题浙江省嘉兴市海盐第二高级中学2021-2022学年高二上学期(10月)阶段检测化学试题新疆乌鲁木齐八一中学2023-2024学年高二上学期11月期中化学试题



