名校
解题方法
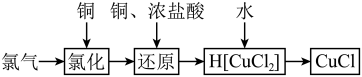
1 . 氯化亚铜为白色难溶于水,不溶于乙醇的固体。可用作催化剂、脱色剂,实验室制备它的流程之一如下: 的装置如图所示:
的装置如图所示:
(1)B中试剂是________ (填名称),装置A中发生反应的物质不可能是下列中的___________ (填标号)。
A. 、浓盐酸 B.浓盐酸、
、浓盐酸 B.浓盐酸、 C.浓硫酸、NaCl、KClO
C.浓硫酸、NaCl、KClO
(2)适合点燃C处酒精灯的标志是______________ ,进入C处反应装置中的气体中含有少量HCl,实验中没有除去HCl的原因是________________________ 。
(3)试剂a可以是NaOH,也可以是_________ (填一种),写出NaOH与尾气主要反应的化学方程式____________________ 。
(4)“还原”过程中浓盐酸的作用是_____________ 。向 中加水后,析出的CuCl经水洗后立即用乙醇洗涤,真空干燥,密封保存,真空干燥的目的是
中加水后,析出的CuCl经水洗后立即用乙醇洗涤,真空干燥,密封保存,真空干燥的目的是____________________ 。
 的装置如图所示:
的装置如图所示: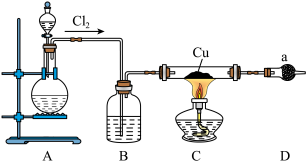
(1)B中试剂是
A.
 、浓盐酸 B.浓盐酸、
、浓盐酸 B.浓盐酸、 C.浓硫酸、NaCl、KClO
C.浓硫酸、NaCl、KClO(2)适合点燃C处酒精灯的标志是
(3)试剂a可以是NaOH,也可以是
(4)“还原”过程中浓盐酸的作用是
 中加水后,析出的CuCl经水洗后立即用乙醇洗涤,真空干燥,密封保存,真空干燥的目的是
中加水后,析出的CuCl经水洗后立即用乙醇洗涤,真空干燥,密封保存,真空干燥的目的是
您最近一年使用:0次
名校
2 . 草酸钴在化学中应用广泛,可用于制备催化剂等。以钻矿[主要成分为 、
、 、
、 ,含少量的
,含少量的 、
、 、
、 、
、 、
、 等]为原料制取草酸钴晶体
等]为原料制取草酸钴晶体 的工艺流程如图所示。
的工艺流程如图所示。
(1) 位于元素周期表中第
位于元素周期表中第___________ 周期第___________ 族。
(2)浸出渣的主要成分是___________ (填化学式)。“浸取”时 发生反应的化学方程式为
发生反应的化学方程式为___________ 。
(3)“氧化”过程中消耗 的量明显偏高的原因是
的量明显偏高的原因是___________ (用化学方程式表示)。
(4)取“调节 ”后所得滤液,将
”后所得滤液,将 调至9.4,可得到
调至9.4,可得到 沉淀,在空气中
沉淀,在空气中 煅烧该沉淀得到
煅烧该沉淀得到 的化学方程式为
的化学方程式为___________ 。
(5)“提纯”分为萃取和反萃取两步进行。向除杂后的溶液中加入某有机酸萃取剂 发生反应
发生反应 当溶液
当溶液 处于一定范围内时,测得
处于一定范围内时,测得 萃取率随溶液
萃取率随溶液 的增大而增大,其原因是
的增大而增大,其原因是___________ 。反萃取时,应加入___________ 。
(6)取 草酸钴晶体,在空气中加热至恒重,得到
草酸钴晶体,在空气中加热至恒重,得到 和
和 的混合物
的混合物 ,则该混合物中
,则该混合物中 的质量为
的质量为___________  。
。
 、
、 、
、 ,含少量的
,含少量的 、
、 、
、 、
、 、
、 等]为原料制取草酸钴晶体
等]为原料制取草酸钴晶体 的工艺流程如图所示。
的工艺流程如图所示。
(1)
 位于元素周期表中第
位于元素周期表中第(2)浸出渣的主要成分是
 发生反应的化学方程式为
发生反应的化学方程式为(3)“氧化”过程中消耗
 的量明显偏高的原因是
的量明显偏高的原因是(4)取“调节
 ”后所得滤液,将
”后所得滤液,将 调至9.4,可得到
调至9.4,可得到 沉淀,在空气中
沉淀,在空气中 煅烧该沉淀得到
煅烧该沉淀得到 的化学方程式为
的化学方程式为(5)“提纯”分为萃取和反萃取两步进行。向除杂后的溶液中加入某有机酸萃取剂
 发生反应
发生反应 当溶液
当溶液 处于一定范围内时,测得
处于一定范围内时,测得 萃取率随溶液
萃取率随溶液 的增大而增大,其原因是
的增大而增大,其原因是(6)取
 草酸钴晶体,在空气中加热至恒重,得到
草酸钴晶体,在空气中加热至恒重,得到 和
和 的混合物
的混合物 ,则该混合物中
,则该混合物中 的质量为
的质量为 。
。
您最近一年使用:0次
3 . 下列实验操作及现象不能得出相应实验结论的是
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向 溶液中通入与 溶液中通入与 等物质的量的 等物质的量的 ,再加入 ,再加入 ,振荡后静置,溶液分层,下层溶液变为红棕色 ,振荡后静置,溶液分层,下层溶液变为红棕色 | 还原性: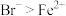 |
| B | 将 溶液和 溶液和 溶液混合,达到平衡后再滴加4滴 溶液混合,达到平衡后再滴加4滴 的 的 溶液,溶液红色变深 溶液,溶液红色变深 | 反应物浓度对化学平衡有影响 |
| C | 向滴有酚酞的 溶液中加入少量 溶液中加入少量 固体,溶液红色变浅并有白色沉淀生成 固体,溶液红色变浅并有白色沉淀生成 |  存在水解平衡 存在水解平衡 |
| D | 常温下,将 晶体研细后与 晶体研细后与 晶体置于烧杯中,快速搅拌混合物,并触摸杯壁,杯壁变冷,同时闻到刺激性气味 晶体置于烧杯中,快速搅拌混合物,并触摸杯壁,杯壁变冷,同时闻到刺激性气味 |  与 与 反应对应的 反应对应的 和 和 均大于0 均大于0 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
4 . 为探究FeCl3溶液与Na2SO3溶液的反应,某研究小组的同学提出两种观点。
(1)观点一:两溶液混合发生氧化还原反应,离子方程式为_______ 。
观点二:_______ ,离子方程式为_______ 。
为验证上述观点,该研究小组的同学设计了探究实验(FeCl3溶液和Na2SO3溶液的浓度均为1.0mol·L-1)。
(2)实验①的目的是_______ 。
(3)对比实验①②的现象,可得结论:_______ 。
(4)将实验②反应后的溶液放置3小时后,溶液变为浅黄绿色,试提出合理的解释:_______ 。
(5)实验③的现象说明二者混合只发生_______ 反应,原因是_______ 。
(6)对比实验②③可得影响反应的因素可能有_______ 。
(1)观点一:两溶液混合发生氧化还原反应,离子方程式为
观点二:
为验证上述观点,该研究小组的同学设计了探究实验(FeCl3溶液和Na2SO3溶液的浓度均为1.0mol·L-1)。
| 实验 | 操作与现象 |
| ① | 在5mL水中滴加2滴FeCl3溶液,呈棕黄色;煮沸,溶液变红褐色 |
| ② | 在5mLFeCl3溶液中滴加2滴Na2SO3溶液,溶液立即变为红褐色;再滴加 溶液,产生蓝色沉淀 溶液,产生蓝色沉淀 |
| ③ | 在5mLNa2SO3溶液中滴加2滴FeCl3溶液,溶液立即变为红褐色;将上述混合液分成两份,一份滴加 溶液,无蓝色沉淀生成;另一份煮沸产生红褐色沉淀,再加 溶液,无蓝色沉淀生成;另一份煮沸产生红褐色沉淀,再加 溶液,无蓝色沉淀生成 溶液,无蓝色沉淀生成 |
(3)对比实验①②的现象,可得结论:
(4)将实验②反应后的溶液放置3小时后,溶液变为浅黄绿色,试提出合理的解释:
(5)实验③的现象说明二者混合只发生
(6)对比实验②③可得影响反应的因素可能有
您最近一年使用:0次
2023-05-16更新
|
477次组卷
|
4卷引用:河南省郑州市等3地2023届高三下学期6月理综化学试题
河南省郑州市等3地2023届高三下学期6月理综化学试题河北省秦皇岛市青龙满族自治县2023届高三三模联考化学试题(已下线)专题19 实验综合题(已下线)专题15 化学实验综合题-2023年高考化学真题题源解密(新高考专用)
5 .  溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
(i)
(ii)
 时,
时, 溶液中
溶液中 随
随 的变化关系如图。
的变化关系如图。

下列有关 溶液的说法正确的是
溶液的说法正确的是
 溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
溶液中存在多个平衡。本题条件下仅需考虑如下平衡:(i)

(ii)

 时,
时, 溶液中
溶液中 随
随 的变化关系如图。
的变化关系如图。
下列有关
 溶液的说法正确的是
溶液的说法正确的是A.加入少量 溶液,反应(i)的平衡逆向移动 溶液,反应(i)的平衡逆向移动 |
B.溶液中 |
C.加入少量 固体,则平衡时 固体,则平衡时 的比值减小 的比值减小 |
D.当pH=9.0时,溶液中 的平衡浓度约为 的平衡浓度约为 |
您最近一年使用:0次
2023-05-16更新
|
328次组卷
|
4卷引用:河南省郑州市等3地2023届高三下学期6月理综化学试题
河南省郑州市等3地2023届高三下学期6月理综化学试题河北省秦皇岛市青龙满族自治县2023届高三三模联考化学试题(已下线)不定项选择题(已下线)考点2 化学平衡 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
6 . 在碳中和背景下,氢能是新能源领域中与油气行业现有业务结合最紧密的一类,而制氢成本过高,仍是目前氢能产业发展的挑战之一、甲烷水蒸气重整制氢是目前工业制氢最为成熟的方法,涉及的主要反应如下:
反应I CH4(g) +H2O(g) CO(g) +3H2(g) ΔH1>0
CO(g) +3H2(g) ΔH1>0
反应II CH4(g) +2H2O(g) CO2(g) +4H2(g) ΔH2>0
CO2(g) +4H2(g) ΔH2>0
反应III CO(g) +H2O(g) CO2(g) +H2(g) ΔH3
CO2(g) +H2(g) ΔH3
(1)已知部分化学键的键能数据如下表:
则ΔH3=___________ ,若反应III的正反应活化能Ea(正) =83 kJ· mol-1,则逆反应活化能Ea(逆)= ____ kJ·mol-1。
(2)①恒温条件下,在体积不变的密闭容器中充入1 mol CO(g)和2 mol H2O(g),发生反应III,欲使CO的转化率和H2的产率同时提高,可以采取的措施有___________ 。
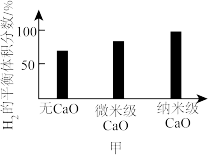
②已知比表面积是指单位质量物料所具有的总面积。实验表明,向体系中投入CaO固体可以增大H2的体积分数,选用相同质量、不同粒径的CaO固体进行实验时,结果如图甲所示。投入微米级CaO比纳米级CaO,H2的平衡体积分数低的原因是___________ 。
③在一恒容绝热容器中以物质的量之比1:2投入CO(g)和H2O(g),发生反应III,下列物理量不再改变能说明该反应到达平衡状态的是___________ (填字母)。
A. H2体积百分含量 B.体系温度
C. CO与H2O的物质的量之比 D.混合气体密度
(3)不同压强下,按照n(CH4):n( H2O) =1:3投料发生上述三个反应,CH4的平衡转化率α(CH4)随温度的变化关系如图乙所示。

压强p1、p2、p3由大到小的顺序是___________ ,CH4的平衡转化率随温度升高而增大的原因是___________ 。
(4)一定温度下,向2 L容器中充入1 mol CH4(g)和3 mol H2O(g) ,t min后反应达到平衡,容器中CO为mmol,CO2为nmol。则tmin内CH4的消耗速率为___________ mol·L-1·min-1,反应III的压强平衡常数Kp=___________ 。(用含m,n,t的代数式表示)
反应I CH4(g) +H2O(g)
 CO(g) +3H2(g) ΔH1>0
CO(g) +3H2(g) ΔH1>0反应II CH4(g) +2H2O(g)
 CO2(g) +4H2(g) ΔH2>0
CO2(g) +4H2(g) ΔH2>0反应III CO(g) +H2O(g)
 CO2(g) +H2(g) ΔH3
CO2(g) +H2(g) ΔH3(1)已知部分化学键的键能数据如下表:
| 化学键 | O-H | H-H | C=O | C≡O( CO) |
| 键能/(kJ·mol -1) | 463 | 436 | 803 | 1075 |
(2)①恒温条件下,在体积不变的密闭容器中充入1 mol CO(g)和2 mol H2O(g),发生反应III,欲使CO的转化率和H2的产率同时提高,可以采取的措施有
②已知比表面积是指单位质量物料所具有的总面积。实验表明,向体系中投入CaO固体可以增大H2的体积分数,选用相同质量、不同粒径的CaO固体进行实验时,结果如图甲所示。投入微米级CaO比纳米级CaO,H2的平衡体积分数低的原因是

③在一恒容绝热容器中以物质的量之比1:2投入CO(g)和H2O(g),发生反应III,下列物理量不再改变能说明该反应到达平衡状态的是
A. H2体积百分含量 B.体系温度
C. CO与H2O的物质的量之比 D.混合气体密度
(3)不同压强下,按照n(CH4):n( H2O) =1:3投料发生上述三个反应,CH4的平衡转化率α(CH4)随温度的变化关系如图乙所示。

压强p1、p2、p3由大到小的顺序是
(4)一定温度下,向2 L容器中充入1 mol CH4(g)和3 mol H2O(g) ,t min后反应达到平衡,容器中CO为mmol,CO2为nmol。则tmin内CH4的消耗速率为
您最近一年使用:0次
名校
解题方法
7 . 铂和钯同属于铂族元素,其价格均高于黄金,在工业上有广泛的应用。电解精炼铜阳极泥中除含有较多的铂、钯和银以外,还有少量的镍、铜等元素。一种综合提取阳极泥中贵重金属的工艺流程如下:
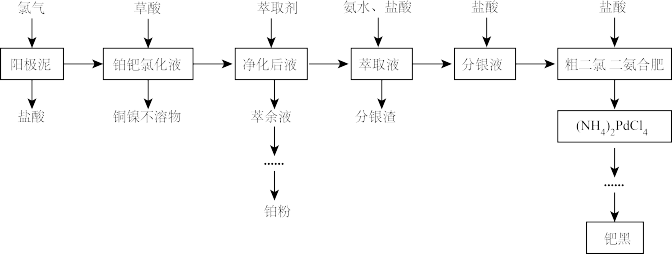
请回答以下问题。
(1)铜阳极泥中的铂和钯以游离态存在的理由是_______ 。
(2)阳极泥中的单质钯反应后转化为 请写出该反应的离子方程式
请写出该反应的离子方程式_______ 。
(3)用草酸除铜镍时,草酸用量对铜镍去除率的影响如下表1。除铜镍时的温度对去除率的影响如下表2。
表1草酸加入量对铜镍去除率的影响
表2反应温度对铜镍去除率的影响
则草酸的过量系数应为_______ 。实际工业中采用的温度为80—85℃。试分析其原因_______ 。
(4)已知 配离子存在解离平衡:
配离子存在解离平衡: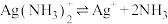 ,根据平衡移动原理说明加盐酸分银的原理
,根据平衡移动原理说明加盐酸分银的原理_______ 。
(5)分银液中加盐酸把 转化为
转化为 沉淀,过滤后用适量的盐酸溶解。则加入盐酸溶解时的化学方程式为
沉淀,过滤后用适量的盐酸溶解。则加入盐酸溶解时的化学方程式为_______ 。
(6)海绵钯具有优良的吸氢功能,其密度为 。标准状况下,吸附氢气的体积是钯体积的a倍,则此条件下海绵钯的吸附容量R=
。标准状况下,吸附氢气的体积是钯体积的a倍,则此条件下海绵钯的吸附容量R=_______  ,氢气的浓度r=
,氢气的浓度r=_______ (吸附容量R是指1g钯吸附氢气的体积;氢气的浓度r为 吸附氢气的物质的量)。
吸附氢气的物质的量)。

请回答以下问题。
(1)铜阳极泥中的铂和钯以游离态存在的理由是
(2)阳极泥中的单质钯反应后转化为
 请写出该反应的离子方程式
请写出该反应的离子方程式(3)用草酸除铜镍时,草酸用量对铜镍去除率的影响如下表1。除铜镍时的温度对去除率的影响如下表2。
表1草酸加入量对铜镍去除率的影响
| 过量系数 | 净化后液/( ) ) | 去除率/% | ||
 |  |  |  | |
| 1.0 | 16.93 | 1.47 | 68.44 | 46.15 |
| 1.5 | 4.67 | 0.61 | 91.30 | 77.66 |
| 2.0 | 0.091 | 0.031 | 99.83 | 98.86 |
| 2.5 | 0.25 | 0.042 | 99.53 | 98.46 |
| 3.0 | 0.28 | 0.040 | 99.48 | 98.53 |
| 4.0 | 0.26 | 0.035 | 99.52 | 98.72 |
| 温度 | 净化后液/( ) ) | 去除率/% | ||
 |  |  |  | |
| 70 | 0.65 | 0.130 | 98.799 | 95.24 |
| 75 | 0.26 | 0.091 | 9.52 | 96.67 |
| 80 | 0.18 | 0.043 | 99.66 | 98.42 |
| 85 | 0.15 | 0.045 | 99.72 | 98.35 |
| 90 | 0.14 | 0.042 | 99.74 | 98.46 |
| 95 | 0.14 | 0.040 | 99.74 | 98.53 |
(4)已知
 配离子存在解离平衡:
配离子存在解离平衡: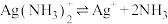 ,根据平衡移动原理说明加盐酸分银的原理
,根据平衡移动原理说明加盐酸分银的原理(5)分银液中加盐酸把
 转化为
转化为 沉淀,过滤后用适量的盐酸溶解。则加入盐酸溶解时的化学方程式为
沉淀,过滤后用适量的盐酸溶解。则加入盐酸溶解时的化学方程式为(6)海绵钯具有优良的吸氢功能,其密度为
 。标准状况下,吸附氢气的体积是钯体积的a倍,则此条件下海绵钯的吸附容量R=
。标准状况下,吸附氢气的体积是钯体积的a倍,则此条件下海绵钯的吸附容量R= ,氢气的浓度r=
,氢气的浓度r= 吸附氢气的物质的量)。
吸附氢气的物质的量)。
您最近一年使用:0次
2022-03-31更新
|
458次组卷
|
5卷引用:河南省郑州市2022届高三第二次质量预测理科综合化学试题
河南省郑州市2022届高三第二次质量预测理科综合化学试题(已下线)化学-2022年高考押题预测卷02(山东卷)(已下线)押江苏卷第15题 化学工业流程综合题 -备战2022年高考化学临考题号押题(江苏卷)(已下线)专项15 工艺流程综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)湖南省湘潭市第一中学2023届高三第六次月考化学试题
名校
解题方法
8 . 由下列实验操作及现象推出的相应结论正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 向两份蛋白质溶液中分别滴加饱和氯化钠溶液和饱和硫酸铜溶液 | 均有固体析出 | 蛋白质均发生变性 |
B | 取1mL 20%的蔗糖溶液,加入3~5滴稀硫酸,水浴加热5min分钟后取少量溶液于一洁净的试管中,加入新制Cu(OH)2溶液,加热 | 无砖红色沉淀产生 | 蔗糖没有发生水解 |
C | 用c(Fe3+)相同的Fe2(SO4)3和FeCl3溶液,分别清洗做完银镜反应的试管 | 用FeCl3溶液清洗较干净 | Fe3++Ag Ag++Fe2+是可逆反应,且AgCl更难溶于水 Ag++Fe2+是可逆反应,且AgCl更难溶于水 |
D | 对于二氧化氮和四氧化二氮的平衡体系,缩小容器体积 | 混合气体颜色逐渐加深 | 符合勒夏特列原理 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-01-17更新
|
604次组卷
|
4卷引用:豫皖中学生标准学术能力诊断性测试2021年1月高三测试理综化学试题
名校
9 . 已知K2Cr2O7溶液中存在平衡: Cr2O72-(橙色)+H2O 2CrO42-(黄色)+2H+。保持温度不变,用K2Cr2O7溶液进行下列实验:
2CrO42-(黄色)+2H+。保持温度不变,用K2Cr2O7溶液进行下列实验:
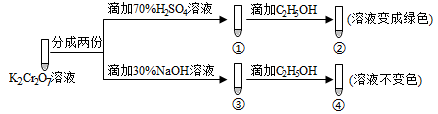
结合实验,下列说法正确的是
 2CrO42-(黄色)+2H+。保持温度不变,用K2Cr2O7溶液进行下列实验:
2CrO42-(黄色)+2H+。保持温度不变,用K2Cr2O7溶液进行下列实验:
结合实验,下列说法正确的是
| A.①中溶液变黄,③中溶液橙色加深 |
| B.上述可逆反应的平衡常数:①<③ |
| C.K2Cr2O7溶液的氧化性在酸性条件下更强 |
| D.若向④中加入70%H2S04溶液至过量,溶液变为橙色 |
您最近一年使用:0次
2017-03-31更新
|
560次组卷
|
4卷引用:2017届河南省郑州、平顶山、濮阳市高三第二次质量预测(二模)理综化学试卷
10-11高三上·甘肃兰州·期中
10 . 在某固定容积的密闭容器中充入1molA,一定条件下建立如下化学平衡:aA(g)  bB(g)+cC(g),在温度不变的条件下,再充入一定量的A物质。下列说法正确的是 ( )
bB(g)+cC(g),在温度不变的条件下,再充入一定量的A物质。下列说法正确的是 ( )
 bB(g)+cC(g),在温度不变的条件下,再充入一定量的A物质。下列说法正确的是 ( )
bB(g)+cC(g),在温度不变的条件下,再充入一定量的A物质。下列说法正确的是 ( )| A.在建立新平衡的过程中,A分解的速率与B消耗的速率之比为a:b |
| B.在建立新平衡的过程中,混合气体的密度逐渐减小 |
| C.重新达平衡时,A的转化率一定增大 |
| D.若a=b+c,重新达平衡时,B的体积分数不变 |
您最近一年使用:0次



