名校
1 . 以方铅矿(主要成分 ,含少量
,含少量 )和软锰矿(主要成分
)和软锰矿(主要成分 )为原料制备电池材料
)为原料制备电池材料 和
和 ,过程可表示为
,过程可表示为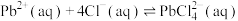
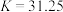
②
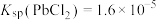
(1) 时,“协同浸取”生成
时,“协同浸取”生成 和
和 的离子方程式为
的离子方程式为___________ ;“协同浸取”时加入 可避免生成
可避免生成 沉积在矿石表面,其原因是
沉积在矿石表面,其原因是___________ 。
(2)“沉降分铅”的目的是将滤液中的 沉降为
沉降为 沉淀。沉降反应
沉淀。沉降反应 的平衡常数
的平衡常数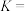
___________ 。
(3)络合萃取剂全氟聚醚-二(甲基吡啶)胺通过氮原子与 形成配位键的方式萃取铅。已知氮原子的电子云密度越大配位能力越强,全氟聚醚-二(甲基吡啶)胺中氮原子和含氟基团相连使得配位能力下降,若在氮原子和含氟基团间引入
形成配位键的方式萃取铅。已知氮原子的电子云密度越大配位能力越强,全氟聚醚-二(甲基吡啶)胺中氮原子和含氟基团相连使得配位能力下降,若在氮原子和含氟基团间引入 基团配位能力会增强,其原因分别是
基团配位能力会增强,其原因分别是________ 。
(4)制备 。
。 (难溶于水的黑色晶体)可通过空气氧化
(难溶于水的黑色晶体)可通过空气氧化 制得,制备时溶液的温度和
制得,制备时溶液的温度和 对
对 的产率影响如图所示。请补充完整由净化后的含
的产率影响如图所示。请补充完整由净化后的含 的滤液制备较纯净的
的滤液制备较纯净的 的实验方案:取一定量的含
的实验方案:取一定量的含 的滤液于三颈烧瓶中,
的滤液于三颈烧瓶中,___________ ,真空40干燥得产品 。(必须使用的试剂:空气、蒸馏水、氨水、稀硝酸、
。(必须使用的试剂:空气、蒸馏水、氨水、稀硝酸、 溶液。)
溶液。)
 ,含少量
,含少量 )和软锰矿(主要成分
)和软锰矿(主要成分 )为原料制备电池材料
)为原料制备电池材料 和
和 ,过程可表示为
,过程可表示为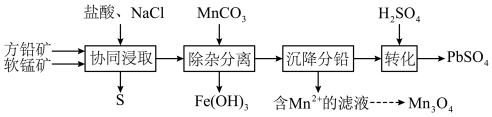
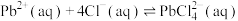
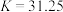
②

(1)
 时,“协同浸取”生成
时,“协同浸取”生成 和
和 的离子方程式为
的离子方程式为 可避免生成
可避免生成 沉积在矿石表面,其原因是
沉积在矿石表面,其原因是(2)“沉降分铅”的目的是将滤液中的
 沉降为
沉降为 沉淀。沉降反应
沉淀。沉降反应 的平衡常数
的平衡常数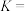
(3)络合萃取剂全氟聚醚-二(甲基吡啶)胺通过氮原子与
 形成配位键的方式萃取铅。已知氮原子的电子云密度越大配位能力越强,全氟聚醚-二(甲基吡啶)胺中氮原子和含氟基团相连使得配位能力下降,若在氮原子和含氟基团间引入
形成配位键的方式萃取铅。已知氮原子的电子云密度越大配位能力越强,全氟聚醚-二(甲基吡啶)胺中氮原子和含氟基团相连使得配位能力下降,若在氮原子和含氟基团间引入 基团配位能力会增强,其原因分别是
基团配位能力会增强,其原因分别是(4)制备
 。
。 (难溶于水的黑色晶体)可通过空气氧化
(难溶于水的黑色晶体)可通过空气氧化 制得,制备时溶液的温度和
制得,制备时溶液的温度和 对
对 的产率影响如图所示。请补充完整由净化后的含
的产率影响如图所示。请补充完整由净化后的含 的滤液制备较纯净的
的滤液制备较纯净的 的实验方案:取一定量的含
的实验方案:取一定量的含 的滤液于三颈烧瓶中,
的滤液于三颈烧瓶中, 。(必须使用的试剂:空气、蒸馏水、氨水、稀硝酸、
。(必须使用的试剂:空气、蒸馏水、氨水、稀硝酸、 溶液。)
溶液。)
您最近半年使用:0次
2024-03-01更新
|
626次组卷
|
2卷引用:江苏省泰州市2024年高三下学期一模调研考试化学试题
2 .  催化重整可获得合成气
催化重整可获得合成气 。重整过程中主要反应的热化学方程式为
。重整过程中主要反应的热化学方程式为
反应①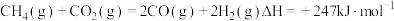
反应②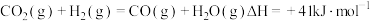
反应③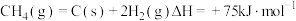
反应④
研究发现在密闭容器中 下,
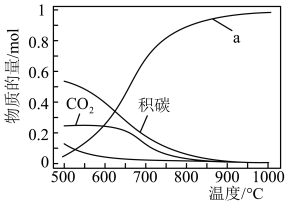
下,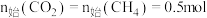 ,平衡时各含碳物种的物质的量随温度的变化如图所示。下列说法正确的是
,平衡时各含碳物种的物质的量随温度的变化如图所示。下列说法正确的是
 催化重整可获得合成气
催化重整可获得合成气 。重整过程中主要反应的热化学方程式为
。重整过程中主要反应的热化学方程式为反应①
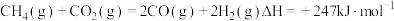
反应②
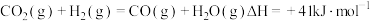
反应③
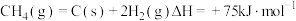
反应④

研究发现在密闭容器中
 下,
下,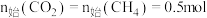 ,平衡时各含碳物种的物质的量随温度的变化如图所示。下列说法正确的是
,平衡时各含碳物种的物质的量随温度的变化如图所示。下列说法正确的是
A.图中a表示 |
B. 的 的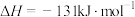 |
C.其他条件不变,在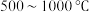 范围,随着温度的升高,平衡时 范围,随着温度的升高,平衡时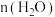 不断增大 不断增大 |
D.当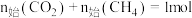 ,其他条件不变时,提高 ,其他条件不变时,提高 的值,能减少平衡时积碳量 的值,能减少平衡时积碳量 |
您最近半年使用:0次
2024-02-13更新
|
1111次组卷
|
4卷引用:江苏省南通市2024届高三上学期第一次调研测试(一模)化学试题
江苏省南通市2024届高三上学期第一次调研测试(一模)化学试题江苏省南京市2023-2024学年高二下学期期初学业质量调研化学试卷(已下线)专题05 化学反应与能量-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)山东省潍坊市2024届高高考模拟训练调研化学试题
名校
3 . 卤族元素单质及其化合物应用广泛。 具有与卤素单质相似的化学性质。
具有与卤素单质相似的化学性质。 在常温下能与Cu反应生成致密的氟化物薄膜,还能与熔融的
在常温下能与Cu反应生成致密的氟化物薄膜,还能与熔融的 反应生成硫酰氟(
反应生成硫酰氟( )。
)。 与浓硫酸反应可制得HF,常温下,测得氟化氢的相对分子质量约为37.
与浓硫酸反应可制得HF,常温下,测得氟化氢的相对分子质量约为37. 通入
通入 酸性溶液中可制得黄绿色气体
酸性溶液中可制得黄绿色气体 ,该气体常用作自来水消毒剂。工业用
,该气体常用作自来水消毒剂。工业用 制备
制备 的热化学方程式为
的热化学方程式为

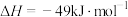 。下列关于反应
。下列关于反应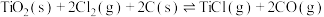 的说法
的说法不正确 的是
 具有与卤素单质相似的化学性质。
具有与卤素单质相似的化学性质。 在常温下能与Cu反应生成致密的氟化物薄膜,还能与熔融的
在常温下能与Cu反应生成致密的氟化物薄膜,还能与熔融的 反应生成硫酰氟(
反应生成硫酰氟( )。
)。 与浓硫酸反应可制得HF,常温下,测得氟化氢的相对分子质量约为37.
与浓硫酸反应可制得HF,常温下,测得氟化氢的相对分子质量约为37. 通入
通入 酸性溶液中可制得黄绿色气体
酸性溶液中可制得黄绿色气体 ,该气体常用作自来水消毒剂。工业用
,该气体常用作自来水消毒剂。工业用 制备
制备 的热化学方程式为
的热化学方程式为

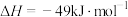 。下列关于反应
。下列关于反应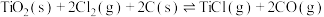 的说法
的说法A.保持其他条件不变,平衡时升高温度,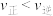 |
B.保持其他条件不变,平衡时通入 ,达到新平衡时 ,达到新平衡时 变小 变小 |
C.反应生成1mol ,转移电子数目为 ,转移电子数目为 |
D.及时分离出CO,有利于 生成 生成 |
您最近半年使用:0次
名校
4 . 下列物质性质与用途具有对应关系的是
| A.FeS具有氧化性,可用于制取硫酸 |
B. 不溶于水,可以作半导体材料 不溶于水,可以作半导体材料 |
C. 具有还原性,可用于漂白某些有色物质 具有还原性,可用于漂白某些有色物质 |
D. 具有难挥发性,可用于制取挥发性酸 具有难挥发性,可用于制取挥发性酸 |
您最近半年使用:0次
解题方法
5 . 某铜矿酸性废水除去不溶性固体杂质后,仍含有c(H+)=0.1mol•L-1,c(Cu2+)=0.05mol•L-1,需净化处理。
已知:①含铜污水的排放标准为pH=7,c(Cu2+)≤1×10-7mol•L-1。
②Ksp[Cu(OH)2]=2.2×10-20,Ksp(CuS)=6.4×10-36,Ksp(FeS)=6.3×10-18;Kb(NH3•H2O)=1.7×10-25,Ka1(H2S)=1.3×10-7,Ka2(H2S)=7.0×10-15。
(1)中和沉淀法处理。
①向酸性废水中加入氨水,调节pH,溶液中铜的去除率与pH关系如图所示。则pH由7到10时,铜的去除率下降的主要原因为_______ (用离子方程式表示)。

②若加入石灰乳处理废水,结合计算判断生成氢氧化铜沉淀能否达到排放标准______ (写出计算过程)。
(2)硫化物沉淀法处理。
①加入Na2S处理废水,pH=7时,Na2S溶液中硫元素的主要存在的微粒为_______ 。
②用FeS处理含铜废水比Na2S效果好。请通过必要的计算和说明采用FeS处理的优点的原因______ 。
(3)溶剂萃取法。用萃取剂RH可萃取废水中的铜离子,再加入20%的硫酸进行反萃取。
①实验室进行萃取操作时,振荡静置后,需对分液漏斗放气,正确放气的图示为_______ (填标号)。
A.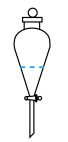 B.
B. 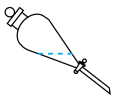 C.
C.
②萃取时,适度增大溶液的pH,Cu2+萃取率升高的原因是_______ 。
(4)实验中需测定废液中铜离子含量。
已知:2Cu2++4I-=2CuI↓+I2,I2+2S2O =2I-+S4O
=2I-+S4O 。
。
请运用上述原理完成测定某弱酸性溶液中铜离子含量的实验方案:量取25.00mL废水于锥形瓶中,_______ (实验中须使用的试剂:0.1mol•L-1KI溶液、0.05000mol•L-1Na2S2O3标准溶液、0.5%淀粉溶液)。
已知:①含铜污水的排放标准为pH=7,c(Cu2+)≤1×10-7mol•L-1。
②Ksp[Cu(OH)2]=2.2×10-20,Ksp(CuS)=6.4×10-36,Ksp(FeS)=6.3×10-18;Kb(NH3•H2O)=1.7×10-25,Ka1(H2S)=1.3×10-7,Ka2(H2S)=7.0×10-15。
(1)中和沉淀法处理。
①向酸性废水中加入氨水,调节pH,溶液中铜的去除率与pH关系如图所示。则pH由7到10时,铜的去除率下降的主要原因为

②若加入石灰乳处理废水,结合计算判断生成氢氧化铜沉淀能否达到排放标准
(2)硫化物沉淀法处理。
①加入Na2S处理废水,pH=7时,Na2S溶液中硫元素的主要存在的微粒为
②用FeS处理含铜废水比Na2S效果好。请通过必要的计算和说明采用FeS处理的优点的原因
(3)溶剂萃取法。用萃取剂RH可萃取废水中的铜离子,再加入20%的硫酸进行反萃取。
①实验室进行萃取操作时,振荡静置后,需对分液漏斗放气,正确放气的图示为
A.
 B.
B.  C.
C.
②萃取时,适度增大溶液的pH,Cu2+萃取率升高的原因是
(4)实验中需测定废液中铜离子含量。
已知:2Cu2++4I-=2CuI↓+I2,I2+2S2O
 =2I-+S4O
=2I-+S4O 。
。请运用上述原理完成测定某弱酸性溶液中铜离子含量的实验方案:量取25.00mL废水于锥形瓶中,
您最近半年使用:0次
6 . 下列实验方案设计、现象和结论都正确的是
| 选项 | 目的 | 方案设计和现象 | 结论 |
| A | 比较乙醇和苯酚中羟基的活泼性 | 在两支干燥的试管中各加入2mL乙醚,再分别加入相同物质的量的乙醇和苯酚,振荡溶解后,各加入一小块金属钠,苯酚溶液与金属钠反应较剧烈 | 羟基的活泼性:苯酚>乙醇 |
| B | 比较S与C的非金属性 | 测定同温同浓度Na2CO3溶液和Na2SO3溶液的pH,前者的pH大于后者 | S的非金属性比C强 |
| C | 探究浓度对化学平衡的影响 | 向试管中加入4mL0.1mol/LNa2Cr2O7溶液,再滴加数滴浓盐酸,溶液橙色变浅 | 增大生成物浓度,平衡向正反应方向移动 |
| D | 探究蔗糖是否水解 | 向蔗糖溶液中加入稀硫酸并水浴加热,一段时间后,再向混合溶液中加入新制的Cu(OH)2悬浊液并加热,无砖红色沉淀 | 蔗糖未水解 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
解题方法
7 . 下列实验探究方案不 能达到探究目的的是
| 选项 | 探究方案 | 探究目的 |
| A | 向试管中滴入几滴1-溴丁烷,再加入2mL5%NaOH溶液,振荡后加热,反应一段时间后停止加热,静置。取数滴水层溶液于试管中,加入几滴2%AgNO3溶液,观察现象 | 检验1-溴丁烷中的溴元素 |
| B | 向盛有4mL0.1mol•L-1KBr溶液的试管中加入1mL新制氯水,振荡,观察溶液颜色变化 | Cl2的氧化性比Br2强 |
| C | 室温下,比较等物质的量浓度的NaF溶液和NaClO溶液pH的相对大小 | Ka(HF)>Ka(HClO) |
| D | 向盛有5mL0.005mol•L-1FeCl3溶液的试管中加入5mL0.015mol•L-1KSCN溶液,再加入少量铁粉,振荡,观察溶液颜色变化 | 反应物浓度影响化学平衡 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
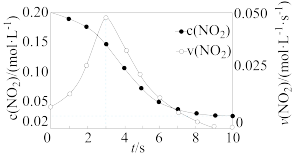
8 . 容积均为1L的甲、乙两个刚性容器,其中甲为绝热容器,乙为恒温容器。相同温度下,分别充入 ,发生反应
,发生反应 。甲容器中
。甲容器中 的相关量随时间变化关系如下图所示。下列说法正确的是
的相关量随时间变化关系如下图所示。下列说法正确的是
 ,发生反应
,发生反应 。甲容器中
。甲容器中 的相关量随时间变化关系如下图所示。下列说法正确的是
的相关量随时间变化关系如下图所示。下列说法正确的是
| A.3s时甲容器中反应达到化学平衡状态 |
B.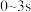 内,甲容器中 内,甲容器中 反应速率增大说明该反应的速率与 反应速率增大说明该反应的速率与 浓度无关 浓度无关 |
C.3s时乙容器中c( )小于0.20mol/L,乙容器中该反应的化学平衡常数大于225 )小于0.20mol/L,乙容器中该反应的化学平衡常数大于225 |
D.甲、乙两容器均达平衡后,欲使两者 的体积分数相等,可向乙容器中再充入少量 的体积分数相等,可向乙容器中再充入少量 气体 气体 |
您最近半年使用:0次
2022-07-28更新
|
613次组卷
|
3卷引用:江苏省南京市第十三中学2022届高三下学期适应性考试化学试题
江苏省南京市第十三中学2022届高三下学期适应性考试化学试题(已下线)第七章 化学反应速率和化学平衡(测)-2023年高考化学一轮复习讲练测(全国通用)河北省滦南县第四中学2023届高三上学期开学考试化学试题
9 . 20世纪初,德国化学家哈伯首次利用氨气和氢气合成了氨气N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ·mol-1,以氨气为原料可制得各种氮肥,大大提高了粮食产量。下列有关合成氨反应说法正确的是
2NH3(g) ΔH=-92.4kJ·mol-1,以氨气为原料可制得各种氮肥,大大提高了粮食产量。下列有关合成氨反应说法正确的是
 2NH3(g) ΔH=-92.4kJ·mol-1,以氨气为原料可制得各种氮肥,大大提高了粮食产量。下列有关合成氨反应说法正确的是
2NH3(g) ΔH=-92.4kJ·mol-1,以氨气为原料可制得各种氮肥,大大提高了粮食产量。下列有关合成氨反应说法正确的是| A.使用催化剂能改变反应途径,提高反应的活化能 |
| B.及时液化分离出氨气,有利于提高反应物的转化率 |
| C.用E总表示物质能量之和,E总(反应物)<E总(生成物) |
| D.向合成塔中充入1molN2和3molH2,充分反应后放出92.4kJ 的热量 |
您最近半年使用:0次
2022·江苏·模拟预测
名校
10 . NH3是一种重要的化工原料,主要用于化肥工业,也广泛用于硝酸、纯碱、制药等工业,同时氨能作为小分子零碳资源,又是“十四五”规划布局的新型储能。大气中过量的NOx和水体中过量的NH 、NO
、NO 均是污染物。通过催化还原的方法,实施无害化处理。科研小组在相同条件下分别通过反应处理等量的NO:Ⅰ.
均是污染物。通过催化还原的方法,实施无害化处理。科研小组在相同条件下分别通过反应处理等量的NO:Ⅰ.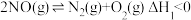 ,Ⅱ.
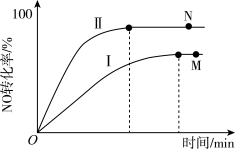
,Ⅱ.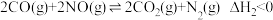 。实验测得NO转化率与时间的关系如图所示,下列说法错误的是
。实验测得NO转化率与时间的关系如图所示,下列说法错误的是
 、NO
、NO 均是污染物。通过催化还原的方法,实施无害化处理。科研小组在相同条件下分别通过反应处理等量的NO:Ⅰ.
均是污染物。通过催化还原的方法,实施无害化处理。科研小组在相同条件下分别通过反应处理等量的NO:Ⅰ.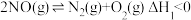 ,Ⅱ.
,Ⅱ.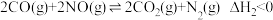 。实验测得NO转化率与时间的关系如图所示,下列说法错误的是
。实验测得NO转化率与时间的关系如图所示,下列说法错误的是
| A.反应Ⅱ为熵减反应 |
| B.2 mol NO(g)的能量高于1 molN2(g)和1 molO2(g)的能量之和 |
| C.反应Ⅰ的热力学趋势小于反应Ⅱ的热力学趋势 |
D.M点反应Ⅰ的平均速率 (NO)大于N点反应Ⅱ的平均速率 (NO)大于N点反应Ⅱ的平均速率 (NO) (NO) |
您最近半年使用:0次
2022-05-02更新
|
200次组卷
|
4卷引用:化学-2022年高考押题预测卷01(江苏卷)
(已下线)化学-2022年高考押题预测卷01(江苏卷)(已下线)专项12 化学反应速率与化学平衡-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)湖南省攸县第三中学2022-2023学年高三上学期第五次月考化学试题湖南省株洲市第二中学2022-2023学年高三上学期第五次月考化学试题



