名校
1 . 已知CH4-CO2重整制氢的主要反应如下:
反应Ⅰ:

反应Ⅱ:

反应Ⅲ: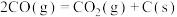

 下,将
下,将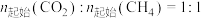 的混合气体置于密闭容器中时,在不同温度下重整体系中CH4和CO2的平衡转化率如右图所示(T2>T1)。下列说法正确的是
的混合气体置于密闭容器中时,在不同温度下重整体系中CH4和CO2的平衡转化率如右图所示(T2>T1)。下列说法正确的是
反应Ⅰ:


反应Ⅱ:


反应Ⅲ:
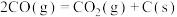

 下,将
下,将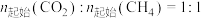 的混合气体置于密闭容器中时,在不同温度下重整体系中CH4和CO2的平衡转化率如右图所示(T2>T1)。下列说法正确的是
的混合气体置于密闭容器中时,在不同温度下重整体系中CH4和CO2的平衡转化率如右图所示(T2>T1)。下列说法正确的是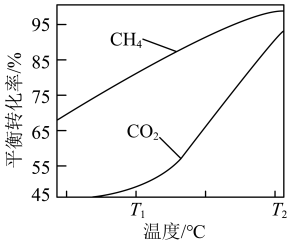
A.由图可知 |
| B.向重整体系中通入适量的H2O(g),不能减少C(s)的生成 |
| C.选择合适的催化剂可以提高T1时CH4的平衡转化率 |
D.相对 时, 时, 温度下 温度下 和 和 的转化率接近的主要原因是从 的转化率接近的主要原因是从 到 到 反应Ⅱ变化幅度大于反应Ⅲ变化幅度 反应Ⅱ变化幅度大于反应Ⅲ变化幅度 |
您最近半年使用:0次
名校
2 . 氢能是一种绿色能源,研发新型制氢技术具有重要意义。
(1)甘油 、水蒸气、氧气自热式催化重整制氢时无需加热,主要反应如下:
、水蒸气、氧气自热式催化重整制氢时无需加热,主要反应如下:
反应I: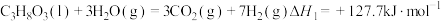
反应Ⅱ: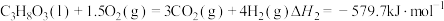
①
___________ 。
②除 外,可能还会产生
外,可能还会产生 等副产物,为了提高原子利用率,最需要抑制
等副产物,为了提高原子利用率,最需要抑制 的生成,原因是
的生成,原因是___________ 。
(2)“表面改性铝粉分解水制氢”因 储量丰富和较强的还原活性得到广泛应用。铝粉表面的致密氧化膜是影响
储量丰富和较强的还原活性得到广泛应用。铝粉表面的致密氧化膜是影响 还原活性的主要因素,工业上常用
还原活性的主要因素,工业上常用 溶液或锡酸钠
溶液或锡酸钠 溶液作为
溶液作为 粉的改性试剂。已知:
粉的改性试剂。已知: 。
。
①利用 溶液改性
溶液改性 粉的原理可用化学方程式表示为
粉的原理可用化学方程式表示为___________ 。
② 下,向两份质量和粒径均相同的
下,向两份质量和粒径均相同的 粉中,分别加入等体积
粉中,分别加入等体积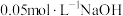 溶液和
溶液和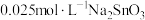 溶液来改性
溶液来改性 粉,氢气产率随时间的变化关系如图1所示。
粉,氢气产率随时间的变化关系如图1所示。 溶液改性效果明显优于
溶液改性效果明显优于 溶液的可能原因是
溶液的可能原因是___________ 。 溶液浓度的变化关系如图2所示。当
溶液浓度的变化关系如图2所示。当 溶液浓度为
溶液浓度为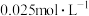 时,氢气产率接近
时,氢气产率接近 。但
。但 溶液过大或过小会大大降低氢气产率,其可能原因分别是
溶液过大或过小会大大降低氢气产率,其可能原因分别是___________ 。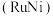 催化氨硼烷水解制氢”主要经过吸附和还原的过程,其反应机理如图所示(每个步骤只画出了可能参与该步反应的1个水分子,氨硼烷中与
催化氨硼烷水解制氢”主要经过吸附和还原的过程,其反应机理如图所示(每个步骤只画出了可能参与该步反应的1个水分子,氨硼烷中与 原子相连的3个
原子相连的3个 原子分别用
原子分别用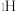 、
、 和
和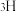 标记)。根据元素电负性的变化规律推测题图的虚线框内微粒
标记)。根据元素电负性的变化规律推测题图的虚线框内微粒 和
和 的化学式分别为
的化学式分别为___________ ;步骤Ⅱ可描述为___________ 。
(1)甘油
 、水蒸气、氧气自热式催化重整制氢时无需加热,主要反应如下:
、水蒸气、氧气自热式催化重整制氢时无需加热,主要反应如下:反应I:
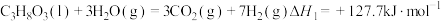
反应Ⅱ:
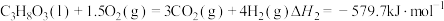
①

②除
 外,可能还会产生
外,可能还会产生 等副产物,为了提高原子利用率,最需要抑制
等副产物,为了提高原子利用率,最需要抑制 的生成,原因是
的生成,原因是(2)“表面改性铝粉分解水制氢”因
 储量丰富和较强的还原活性得到广泛应用。铝粉表面的致密氧化膜是影响
储量丰富和较强的还原活性得到广泛应用。铝粉表面的致密氧化膜是影响 还原活性的主要因素,工业上常用
还原活性的主要因素,工业上常用 溶液或锡酸钠
溶液或锡酸钠 溶液作为
溶液作为 粉的改性试剂。已知:
粉的改性试剂。已知: 。
。①利用
 溶液改性
溶液改性 粉的原理可用化学方程式表示为
粉的原理可用化学方程式表示为②
 下,向两份质量和粒径均相同的
下,向两份质量和粒径均相同的 粉中,分别加入等体积
粉中,分别加入等体积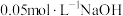 溶液和
溶液和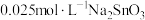 溶液来改性
溶液来改性 粉,氢气产率随时间的变化关系如图1所示。
粉,氢气产率随时间的变化关系如图1所示。 溶液改性效果明显优于
溶液改性效果明显优于 溶液的可能原因是
溶液的可能原因是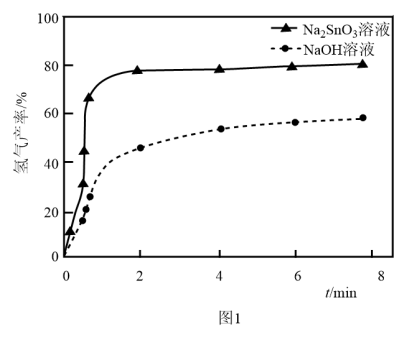
 溶液浓度的变化关系如图2所示。当
溶液浓度的变化关系如图2所示。当 溶液浓度为
溶液浓度为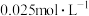 时,氢气产率接近
时,氢气产率接近 。但
。但 溶液过大或过小会大大降低氢气产率,其可能原因分别是
溶液过大或过小会大大降低氢气产率,其可能原因分别是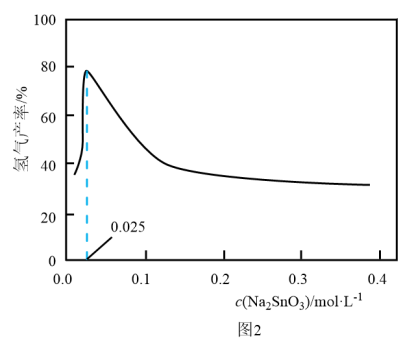
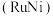 催化氨硼烷水解制氢”主要经过吸附和还原的过程,其反应机理如图所示(每个步骤只画出了可能参与该步反应的1个水分子,氨硼烷中与
催化氨硼烷水解制氢”主要经过吸附和还原的过程,其反应机理如图所示(每个步骤只画出了可能参与该步反应的1个水分子,氨硼烷中与 原子相连的3个
原子相连的3个 原子分别用
原子分别用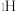 、
、 和
和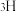 标记)。根据元素电负性的变化规律推测题图的虚线框内微粒
标记)。根据元素电负性的变化规律推测题图的虚线框内微粒 和
和 的化学式分别为
的化学式分别为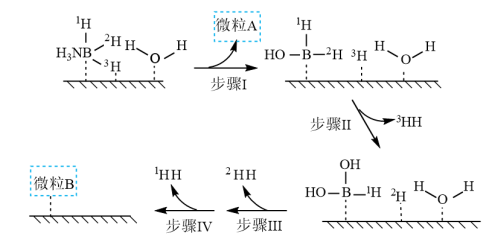
您最近半年使用:0次
名校
解题方法
3 . 反应 ,可用于去除氮氧化物。
,可用于去除氮氧化物。 催化该反应的过程如图所示。下列说法正确的是
催化该反应的过程如图所示。下列说法正确的是
 ,可用于去除氮氧化物。
,可用于去除氮氧化物。 催化该反应的过程如图所示。下列说法正确的是
催化该反应的过程如图所示。下列说法正确的是
A. 位于元素周期表 位于元素周期表 区 区 |
B.反应过程中, 参与反应,降低了反应的焓变 参与反应,降低了反应的焓变 |
C.该反应的平衡常数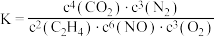 |
D.其他条件不变时,增大 , ,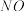 的平衡转化率下降 的平衡转化率下降 |
您最近半年使用:0次
名校
4 . 下列叙述不能用勒夏特列原理解释的是
| A.氯气在饱和食盐水中的溶解度比在水中小 |
| B.利用TiCl4水解制备TiO2时,需加入大量水并加热 |
| C.由H2、I2(g)和HI组成的平衡体系,加压后颜色变深 |
| D.在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置后溶液颜色变浅或褪去 |
您最近半年使用:0次
名校
5 . 含铬化合物在生产生活中有着广泛的用途。利用含铬废液(主要含Cr3+、Cl-、K+、 等)可制备强氧化剂K2Cr2O7。
等)可制备强氧化剂K2Cr2O7。

已知:pH>6.5时Cr(Ⅵ)主要以 的形式存在,pH<6.5时Cr(Ⅵ)主要以
的形式存在,pH<6.5时Cr(Ⅵ)主要以 的形式存在。
的形式存在。
(1)含铬废液中存在Cr3+,该微粒的核外电子排布式为___________ 。
(2)写出调节pH的为12时Cr3+被氧化为Cr(Ⅵ)的离子方程式:___________ 。
(3)加稀硫酸至溶液pH约为1,若“酸化”前不将溶液煮沸,则K2Cr2O7产率明显偏低,原因是___________ 。
(4)利用K2Cr2O7制备Cr2O3。向密闭反应釜中加入1L1mol/L K2Cr2O7溶液,再加入蔗糖(C12H22O11)充分反应生成Cr(OH)3、K2CO3和CO2。焙烧Cr(OH)3得到Cr2O3。理论上需要向反应釜中加入蔗糖的物质的量为___________ 。
(5)利用K2Cr2O7滴定法测定钢渣(主要含有Fe、Fe2O3、FeO及少量惰性杂质)中Fe的含量的方法如下:取钢渣样品0.2500g,加入足量FeCl3溶液充分反应(Fe2O3、FeO及惰性杂质不反应)后过滤,洗涤滤渣。将洗涤液与滤液合并,用0.1000mol/L K2Cr2O7溶液滴定至终点,消耗K2Cr2O7溶液20.00mL。计算钢渣中Fe的质量分数_______ (写出计算过程,结果保留1位小数)。
 等)可制备强氧化剂K2Cr2O7。
等)可制备强氧化剂K2Cr2O7。
已知:pH>6.5时Cr(Ⅵ)主要以
 的形式存在,pH<6.5时Cr(Ⅵ)主要以
的形式存在,pH<6.5时Cr(Ⅵ)主要以 的形式存在。
的形式存在。(1)含铬废液中存在Cr3+,该微粒的核外电子排布式为
(2)写出调节pH的为12时Cr3+被氧化为Cr(Ⅵ)的离子方程式:
(3)加稀硫酸至溶液pH约为1,若“酸化”前不将溶液煮沸,则K2Cr2O7产率明显偏低,原因是
(4)利用K2Cr2O7制备Cr2O3。向密闭反应釜中加入1L1mol/L K2Cr2O7溶液,再加入蔗糖(C12H22O11)充分反应生成Cr(OH)3、K2CO3和CO2。焙烧Cr(OH)3得到Cr2O3。理论上需要向反应釜中加入蔗糖的物质的量为
(5)利用K2Cr2O7滴定法测定钢渣(主要含有Fe、Fe2O3、FeO及少量惰性杂质)中Fe的含量的方法如下:取钢渣样品0.2500g,加入足量FeCl3溶液充分反应(Fe2O3、FeO及惰性杂质不反应)后过滤,洗涤滤渣。将洗涤液与滤液合并,用0.1000mol/L K2Cr2O7溶液滴定至终点,消耗K2Cr2O7溶液20.00mL。计算钢渣中Fe的质量分数
您最近半年使用:0次
名校
解题方法
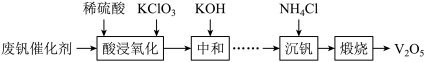
6 . 五氧化二钒(V2O5)广泛用作合金添加剂及有机化工催化剂。从废钒催化剂(含有V2O5、VOSO4及少量Fe2O3、Al2O3等杂质)回收V2O5的部分工艺流程如下:
已知:a.常温下,部分含钒物质在水中的溶解性见下表:
b.+5价钒在溶液中的主要存在形式与溶液pH的关系见下表:
(1)“酸浸、氧化”时,VO2+发生反应的离子方程式为___________ 。
(2)“中和”时调节pH为7的目的,一是沉淀部分杂质离子;二是___________ 。
(3)①“沉钒”前需将溶液先进行“离子交换”和“洗脱”,再加入NH4Cl生成NH4VO3;“离子交换”和“洗脱”两步操作可表示为ROH+VO
 RVO3+OH-(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈
RVO3+OH-(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈___________ (填“酸性”或“碱性”),理由是___________ 。
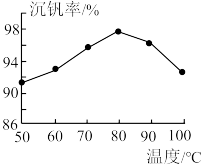
②用沉钒率(NH4VO3沉淀中V的质量和废钒催化剂中V的质量之比)表示该工艺钒的回收率。图1中是沉钒率随温度变化的关系曲线,沉钒时,温度超过80℃以后,沉钒率下降的可能原因是___________ 。
(4)在Ar气氛中加热“煅烧”NH4VO3,测得加热升温过程中固体的质量变化如图2所示,加热分解NH4VO3制备V2O5需要控制的温度为___________ 。


已知:a.常温下,部分含钒物质在水中的溶解性见下表:
| 物质 | V2O5 | VOSO4 | (VO2)2SO4 | NH4VO3 |
| 溶解性 | 难溶 | 可溶 | 易溶 | 难溶 |
| pH | <6 | 6~8 | 8~10 | 10~12 |
| 主要离子 | VO | VO | V2O | VO |
(1)“酸浸、氧化”时,VO2+发生反应的离子方程式为
(2)“中和”时调节pH为7的目的,一是沉淀部分杂质离子;二是
(3)①“沉钒”前需将溶液先进行“离子交换”和“洗脱”,再加入NH4Cl生成NH4VO3;“离子交换”和“洗脱”两步操作可表示为ROH+VO

 RVO3+OH-(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈
RVO3+OH-(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈②用沉钒率(NH4VO3沉淀中V的质量和废钒催化剂中V的质量之比)表示该工艺钒的回收率。图1中是沉钒率随温度变化的关系曲线,沉钒时,温度超过80℃以后,沉钒率下降的可能原因是

(4)在Ar气氛中加热“煅烧”NH4VO3,测得加热升温过程中固体的质量变化如图2所示,加热分解NH4VO3制备V2O5需要控制的温度为

您最近半年使用:0次
名校
7 . 以方铅矿(主要成分 ,含少量
,含少量 )和软锰矿(主要成分
)和软锰矿(主要成分 )为原料制备电池材料
)为原料制备电池材料 和
和 ,过程可表示为
,过程可表示为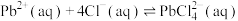
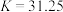
②
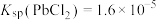
(1) 时,“协同浸取”生成
时,“协同浸取”生成 和
和 的离子方程式为
的离子方程式为___________ ;“协同浸取”时加入 可避免生成
可避免生成 沉积在矿石表面,其原因是
沉积在矿石表面,其原因是___________ 。
(2)“沉降分铅”的目的是将滤液中的 沉降为
沉降为 沉淀。沉降反应
沉淀。沉降反应 的平衡常数
的平衡常数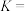
___________ 。
(3)络合萃取剂全氟聚醚-二(甲基吡啶)胺通过氮原子与 形成配位键的方式萃取铅。已知氮原子的电子云密度越大配位能力越强,全氟聚醚-二(甲基吡啶)胺中氮原子和含氟基团相连使得配位能力下降,若在氮原子和含氟基团间引入
形成配位键的方式萃取铅。已知氮原子的电子云密度越大配位能力越强,全氟聚醚-二(甲基吡啶)胺中氮原子和含氟基团相连使得配位能力下降,若在氮原子和含氟基团间引入 基团配位能力会增强,其原因分别是
基团配位能力会增强,其原因分别是________ 。
(4)制备 。
。 (难溶于水的黑色晶体)可通过空气氧化
(难溶于水的黑色晶体)可通过空气氧化 制得,制备时溶液的温度和
制得,制备时溶液的温度和 对
对 的产率影响如图所示。请补充完整由净化后的含
的产率影响如图所示。请补充完整由净化后的含 的滤液制备较纯净的
的滤液制备较纯净的 的实验方案:取一定量的含
的实验方案:取一定量的含 的滤液于三颈烧瓶中,
的滤液于三颈烧瓶中,___________ ,真空40干燥得产品 。(必须使用的试剂:空气、蒸馏水、氨水、稀硝酸、
。(必须使用的试剂:空气、蒸馏水、氨水、稀硝酸、 溶液。)
溶液。)
 ,含少量
,含少量 )和软锰矿(主要成分
)和软锰矿(主要成分 )为原料制备电池材料
)为原料制备电池材料 和
和 ,过程可表示为
,过程可表示为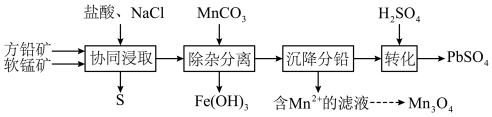
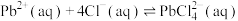
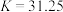
②

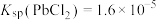
(1)
 时,“协同浸取”生成
时,“协同浸取”生成 和
和 的离子方程式为
的离子方程式为 可避免生成
可避免生成 沉积在矿石表面,其原因是
沉积在矿石表面,其原因是(2)“沉降分铅”的目的是将滤液中的
 沉降为
沉降为 沉淀。沉降反应
沉淀。沉降反应 的平衡常数
的平衡常数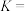
(3)络合萃取剂全氟聚醚-二(甲基吡啶)胺通过氮原子与
 形成配位键的方式萃取铅。已知氮原子的电子云密度越大配位能力越强,全氟聚醚-二(甲基吡啶)胺中氮原子和含氟基团相连使得配位能力下降,若在氮原子和含氟基团间引入
形成配位键的方式萃取铅。已知氮原子的电子云密度越大配位能力越强,全氟聚醚-二(甲基吡啶)胺中氮原子和含氟基团相连使得配位能力下降,若在氮原子和含氟基团间引入 基团配位能力会增强,其原因分别是
基团配位能力会增强,其原因分别是(4)制备
 。
。 (难溶于水的黑色晶体)可通过空气氧化
(难溶于水的黑色晶体)可通过空气氧化 制得,制备时溶液的温度和
制得,制备时溶液的温度和 对
对 的产率影响如图所示。请补充完整由净化后的含
的产率影响如图所示。请补充完整由净化后的含 的滤液制备较纯净的
的滤液制备较纯净的 的实验方案:取一定量的含
的实验方案:取一定量的含 的滤液于三颈烧瓶中,
的滤液于三颈烧瓶中, 。(必须使用的试剂:空气、蒸馏水、氨水、稀硝酸、
。(必须使用的试剂:空气、蒸馏水、氨水、稀硝酸、 溶液。)
溶液。)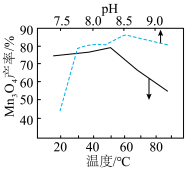
您最近半年使用:0次
2024-03-01更新
|
626次组卷
|
2卷引用:江苏省无锡市锡东高级中学2023-2024学年高三下学期4月月考化学试题
名校
解题方法
8 . 利用甲烷可以除去SO2,反应为
 。下列说法正确的是
。下列说法正确的是

 。下列说法正确的是
。下列说法正确的是| A.该反应在任何温度下均可自发进行 |
| B.该反应中每断开4mol碳氢σ键同时形成2mol碳氧σ键 |
C.该反应的平衡常数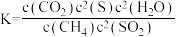 |
D.其他条件相同,增大 可提高SO2的平衡转化率 可提高SO2的平衡转化率 |
您最近半年使用:0次
名校
9 . 实验室以二氧化铈( )废渣为原料制备
)废渣为原料制备 含量少的
含量少的 ,其部分实验过程如下:
,其部分实验过程如下:
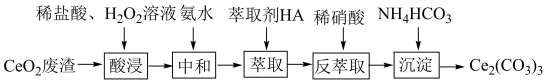
(1)“酸浸”时 与
与 反应生成
反应生成 并放出
并放出 ,该反应的离子方程式为
,该反应的离子方程式为___________
(2)pH约为7的 溶液与
溶液与 溶液反应可生成
溶液反应可生成 沉淀,同时放出
沉淀,同时放出 ,该沉淀中
,该沉淀中 含量与加料方式有关。
含量与加料方式有关。
①得到含 量较少的
量较少的 的加料方式为
的加料方式为___________ (填序号)。
A.将 溶液滴加到
溶液滴加到 溶液中 B.将
溶液中 B.将 溶液滴加到
溶液滴加到 溶液中
溶液中
② 溶液与
溶液与 溶液反应的离子方程式:
溶液反应的离子方程式:___________
(3)通过中和、萃取、反萃取、沉淀等过程,可制备 含量少的
含量少的 。已知
。已知 能被有机萃取剂(简称HA)萃取,其萃取原理可表示为
能被有机萃取剂(简称HA)萃取,其萃取原理可表示为
①加氨水“中和”去除过量盐酸,使溶液接近中性。去除过量盐酸的目的是___________ 。
②反萃取的目的是将有机层 转移到水层。使
转移到水层。使 尽可能多地发生上述转移,应选择的实验条件或采取的实验操作有
尽可能多地发生上述转移,应选择的实验条件或采取的实验操作有___________ 。
(4)实验中需要测定溶液中 的含量。已知水溶液中
的含量。已知水溶液中 可用准确浓度的
可用准确浓度的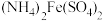 溶液滴定。以苯代邻氨基苯甲酸为指示剂,滴定终点时溶液由紫红色变为亮黄色,滴定反应为
溶液滴定。以苯代邻氨基苯甲酸为指示剂,滴定终点时溶液由紫红色变为亮黄色,滴定反应为 。请补充完整实验方案:①准确量取25.00 mL
。请补充完整实验方案:①准确量取25.00 mL  溶液[
溶液[ 约为
约为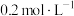 ],加氧化剂将
],加氧化剂将 完全氧化并去除多余氧化剂后,用稀硫酸酸化,将溶液完全转移到250 mL容量瓶中后定容;②按规定操作分别将
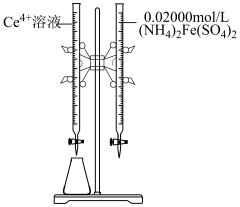
完全氧化并去除多余氧化剂后,用稀硫酸酸化,将溶液完全转移到250 mL容量瓶中后定容;②按规定操作分别将
 和待测
和待测 溶液装入如图所示的滴定管中:③
溶液装入如图所示的滴定管中:③___________
 )废渣为原料制备
)废渣为原料制备 含量少的
含量少的 ,其部分实验过程如下:
,其部分实验过程如下:
(1)“酸浸”时
 与
与 反应生成
反应生成 并放出
并放出 ,该反应的离子方程式为
,该反应的离子方程式为(2)pH约为7的
 溶液与
溶液与 溶液反应可生成
溶液反应可生成 沉淀,同时放出
沉淀,同时放出 ,该沉淀中
,该沉淀中 含量与加料方式有关。
含量与加料方式有关。①得到含
 量较少的
量较少的 的加料方式为
的加料方式为A.将
 溶液滴加到
溶液滴加到 溶液中 B.将
溶液中 B.将 溶液滴加到
溶液滴加到 溶液中
溶液中②
 溶液与
溶液与 溶液反应的离子方程式:
溶液反应的离子方程式:(3)通过中和、萃取、反萃取、沉淀等过程,可制备
 含量少的
含量少的 。已知
。已知 能被有机萃取剂(简称HA)萃取,其萃取原理可表示为
能被有机萃取剂(简称HA)萃取,其萃取原理可表示为
①加氨水“中和”去除过量盐酸,使溶液接近中性。去除过量盐酸的目的是
②反萃取的目的是将有机层
 转移到水层。使
转移到水层。使 尽可能多地发生上述转移,应选择的实验条件或采取的实验操作有
尽可能多地发生上述转移,应选择的实验条件或采取的实验操作有(4)实验中需要测定溶液中
 的含量。已知水溶液中
的含量。已知水溶液中 可用准确浓度的
可用准确浓度的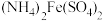 溶液滴定。以苯代邻氨基苯甲酸为指示剂,滴定终点时溶液由紫红色变为亮黄色,滴定反应为
溶液滴定。以苯代邻氨基苯甲酸为指示剂,滴定终点时溶液由紫红色变为亮黄色,滴定反应为 。请补充完整实验方案:①准确量取25.00 mL
。请补充完整实验方案:①准确量取25.00 mL  溶液[
溶液[ 约为
约为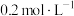 ],加氧化剂将
],加氧化剂将 完全氧化并去除多余氧化剂后,用稀硫酸酸化,将溶液完全转移到250 mL容量瓶中后定容;②按规定操作分别将
完全氧化并去除多余氧化剂后,用稀硫酸酸化,将溶液完全转移到250 mL容量瓶中后定容;②按规定操作分别将
 和待测
和待测 溶液装入如图所示的滴定管中:③
溶液装入如图所示的滴定管中:③
您最近半年使用:0次
名校
10 . 在体积为1 L的恒温密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应: CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ,测得CO2和CH3OH(g)的浓度随时间变化如图所示。下列说法正确的是
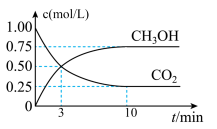
| A.该化学反应在3 min时达到平衡状态 |
| B.保持其他条件不变,降低温度,平衡时c(CH3OH)=0.85 mol·L-1,则该反应的ΔH >0 |
| C.相同温度下,起始时向上述容器中充入0.5 mol CO2、1.5 mol H2,平衡时CO2的转化率为75% |
| D.12 min时,向上述容器中再充入0.25 mol CO2、0.25 mol H2O(g),此时反应将向正反应方向进行 |
您最近半年使用:0次
2023-12-23更新
|
121次组卷
|
3卷引用:江苏省徐州市第七中学2023-2024学年高二下学期3月考试化学试题



