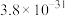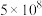1 . 某兴趣小组以重铬酸钾( )溶液为研究对象,改变条件使其发生“色彩变幻”。
)溶液为研究对象,改变条件使其发生“色彩变幻”。
已知:① 溶液存在平衡:
溶液存在平衡: 。
。
②含铬元素的离子在溶液中的颜色: (橙色);
(橙色); (黄色);Cr3+(绿色)。
(黄色);Cr3+(绿色)。 的正反应是
的正反应是_____ (填“吸热”或“放热”)反应。
(2)ⅱ是验证“只降低生成物的浓度,该平衡正向移动”,试剂a是_____ (填化学式)。
(3)ⅲ的目的是要验证“增大生成物的浓度,该平衡逆向移动”,此实验不能达到预期目的,理由是______ 。
(4)根据实验Ⅱ中不同现象,可以得出的结论是______ 。
(5)继续实验Ⅲ:______ 。
②第二步溶液变绿色:该反应的离子方程式是_______ 。
 )溶液为研究对象,改变条件使其发生“色彩变幻”。
)溶液为研究对象,改变条件使其发生“色彩变幻”。已知:①
 溶液存在平衡:
溶液存在平衡: 。
。②含铬元素的离子在溶液中的颜色:
 (橙色);
(橙色); (黄色);Cr3+(绿色)。
(黄色);Cr3+(绿色)。
 的正反应是
的正反应是(2)ⅱ是验证“只降低生成物的浓度,该平衡正向移动”,试剂a是
(3)ⅲ的目的是要验证“增大生成物的浓度,该平衡逆向移动”,此实验不能达到预期目的,理由是
(4)根据实验Ⅱ中不同现象,可以得出的结论是
(5)继续实验Ⅲ:
实验Ⅲ: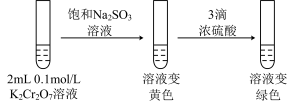
②第二步溶液变绿色:该反应的离子方程式是
您最近半年使用:0次
名校
解题方法
2 . 以黄铁矿和硫黄为原料生产硫酸,并将产生的尾气综合利用制备焦亚硫酸钠( )的流程如图所示。下列说法错误的是
)的流程如图所示。下列说法错误的是
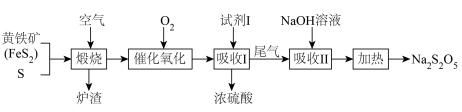
 )的流程如图所示。下列说法错误的是
)的流程如图所示。下列说法错误的是
A.黄铁矿煆烧的化学方程式为 |
B.催化氧化过程中,为提高 的利用率,可加大氧气的通入量 的利用率,可加大氧气的通入量 |
C.为提高 的吸收效率,试剂I宜采用水进行吸收 的吸收效率,试剂I宜采用水进行吸收 |
D.吸收Ⅱ后得到 溶液,则生成焦亚硫酸钠的化学方程式为 溶液,则生成焦亚硫酸钠的化学方程式为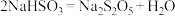 |
您最近半年使用:0次
名校
3 . 反应①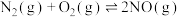 、②
、②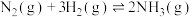 在不同温度时的化学平衡常数(K)值如下表所示。
在不同温度时的化学平衡常数(K)值如下表所示。
下列说法正确的是
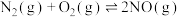 、②
、②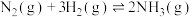 在不同温度时的化学平衡常数(K)值如下表所示。
在不同温度时的化学平衡常数(K)值如下表所示。反应 | ① | ② | |||
温度/℃ | 27 | 2000 | 25 | 400 | 450 |
K |
| 0.1 |
| 0.507 | 0.152 |
| A.升高温度,反应①、②的正反应速率增大程度均大于逆反应速率增大程度 |
B.一定温度下,反应①、②分别达到平衡,压缩容器体积(加压)均可使 的转化率增大 的转化率增大 |
C.提高反应②中 与 与 的投料比 的投料比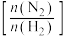 可增大 可增大 的转化率 的转化率 |
D.已知①、②的 ,可以求算反应 ,可以求算反应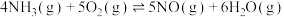 的△H 的△H |
您最近半年使用:0次
名校
4 . 下列说法正确的是
A.向 溶液样品中加入硫酸酸化的 溶液样品中加入硫酸酸化的 溶液,紫色褪去,说明该样品中一定混有 溶液,紫色褪去,说明该样品中一定混有 |
B. 在一定条件下能自发进行,则该反应的 在一定条件下能自发进行,则该反应的 |
C.25℃,向 的氨水溶液中加水, 的氨水溶液中加水, 增大 增大 |
D.反应 达到平衡后,加入KCl固体逆反应速率加快 达到平衡后,加入KCl固体逆反应速率加快 |
您最近半年使用:0次
2023-12-02更新
|
91次组卷
|
2卷引用:河北省泊头市第一中学2023-2024学年高二上学期10月月考化学试题
名校
5 . 实验室配制碘水时,通常将 溶于KI溶液:
溶于KI溶液: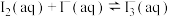 。关于该溶液,下列说法正确的是
。关于该溶液,下列说法正确的是
 溶于KI溶液:
溶于KI溶液: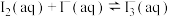 。关于该溶液,下列说法正确的是
。关于该溶液,下列说法正确的是| A.加入苯,平衡逆向移动 | B.滴入淀粉溶液,不变蓝 |
| C.加水稀释,平衡正向移动 | D.加少量 固体,平衡正向移动 固体,平衡正向移动 |
您最近半年使用:0次
2023-11-20更新
|
114次组卷
|
3卷引用:河北省石家庄市部分学校2023-2024学年高二上学期11月联考化学试题
名校
解题方法
6 . 在一密闭容器中,反应 达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法正确的是
达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法正确的是
 达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法正确的是
达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法正确的是| A.平衡向逆反应方向移动了 | B.物质A的转化率减小了 |
| C.物质B的质量分数增大了 | D. |
您最近半年使用:0次
2023-11-14更新
|
357次组卷
|
25卷引用:河北省石家庄市第十五中学2023-2024学年高二上学期12月阶段考试化学试题
河北省石家庄市第十五中学2023-2024学年高二上学期12月阶段考试化学试题黑龙江省伊春市伊美区第二中学2018-2019学年高二上学期阶段考试(12月)化学试题(已下线)【浙江新东方】双师118安徽省淮北市树人高级中学2020-2021学年高二上学期第一次联考化学试题天津市武清区梅厂中学2021-2022学年高二上学期阶段性练习化学试题广西百色中学2021-2022学年高二上学期第一次月考化学试题黑龙江省哈尔滨市依兰县高级中学2021-2022学年高二上学期第一次月考化学试题天津市第二南开学校2022-2023学年高二上学期9月阶段性线上练习化学试题 天津市宁河区芦台第一中学2022-2023学年高二上学期第一次学习诊断化学试题宁夏回族自治区中宁县第一中学2022-2023学年高二上学期10月月考化学试题山西省太原市第五中学校2023-2024学年高二上学期10月月考化学试题新疆石河子第一中学2023-2024学年高二上学期11月月考化学试题广东省汕头市潮阳区河溪中学2023-2024学年高二上学期月考化学试题天津市外国语大学附属外国语学校2021-2022学年高二上学期期中阶段性检测化学试题黑龙江省大庆市东风中学2021-2022学年高二下学期开学考试化学试题黑龙江省绥化市第一中学2021-2022学年高二上学期期末考试化学试题吉林省长春希望高中2021-2022学年高二上学期期末考试化学试题广西桂林市第十八中学2021-2022学年高二下学期开学考试化学试题浙江省金华第一中学2022-2023学年高一下学期6月期末化学试题浙江省浙东北联盟(ZDB)2023-2024学年高二上学期期中考试化学试题北京师范大学附属实验中学2023-2024学年高二上学期期中考试化学试题 北京师范大学附属实验中学2023-2024学年高二上学期期中考试化学试题(已下线)寒假作业03 化学平衡-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)北京师范大学附属实验中学2023-2024学年高二上学期期中考试化学试题安徽省阜阳市临泉第一中学(高铁分校)2023-2024学年高二上学期期末考试化学试题
名校
7 . 下列说法正确的是
A.稀氨水中存在平衡NH3•H2O NH NH +OH-,若要使平衡逆向移动且c(OH-)增大,可加入NH4Cl固体 +OH-,若要使平衡逆向移动且c(OH-)增大,可加入NH4Cl固体 |
| B.某固体化合物M不导电,但熔融时能完全电离,则M一定是强电解质 |
| C.熵值增大的反应都能自发进行 |
D.溶液中存在平衡FeCl3+3KSCN Fe(SCN)3+3KCl,平衡时加入KCl固体时,平衡逆向移动 Fe(SCN)3+3KCl,平衡时加入KCl固体时,平衡逆向移动 |
您最近半年使用:0次
名校
8 . K2Cr2O7溶液中存在平衡: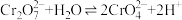 ,已知:含铬元素的离子在溶液中的颜色:
,已知:含铬元素的离子在溶液中的颜色: (橙色)、
(橙色)、 (黄色)、Cr3+(绿色)。用0.1mol/LK2Cr2O7溶液分别进行如下实验,下列说法不正确的是
(黄色)、Cr3+(绿色)。用0.1mol/LK2Cr2O7溶液分别进行如下实验,下列说法不正确的是
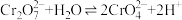 ,已知:含铬元素的离子在溶液中的颜色:
,已知:含铬元素的离子在溶液中的颜色: (橙色)、
(橙色)、 (黄色)、Cr3+(绿色)。用0.1mol/LK2Cr2O7溶液分别进行如下实验,下列说法不正确的是
(黄色)、Cr3+(绿色)。用0.1mol/LK2Cr2O7溶液分别进行如下实验,下列说法不正确的是A.加热K2Cr2O7溶液,溶液橙色加深,可得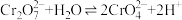 的正反应放热 的正反应放热 |
| B.向K2Cr2O7溶液中加入5~l0滴NaOH浓溶液,溶液变黄色 |
| C.加水稀释K2Cr2O7溶液,溶液中各离子浓度均减小 |
| D.向K2Cr2O7溶液中加入乙醇,溶液将由橙色变为绿色 |
您最近半年使用:0次
2023-11-08更新
|
102次组卷
|
2卷引用:河北省张家口市张垣联盟2023-2024学年高二上学期11月月考化学试题
9 . 氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
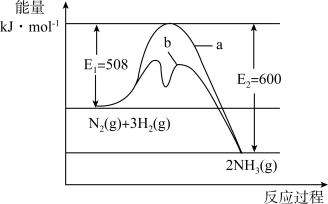
(1)根据图提供的信息,写出该反应的热化学方程式___________ ,在图中曲线___________ (填“a”或“b”)表示加入铁触媒的能量变化曲线,判断理由是___________ 。
(2)在恒容容器中,下列描述中能说明上述反应已达平衡的是___________
(3)一定温度下,向2 L密闭容器中充入1 mol N2和3 mol H2,保持体积不变,0.5 min后达到平衡,测得容器中有0.4 mol NH3,则平均反应速率v(N2)=___________ ,该温度下的平衡常数K=___________ 。(小数点后保留3位有效数字)
(4)保持温度和体积不变,向上述平衡体系中再加入1 mol N2、1 mol H2 、1 mol NH3 后该反应的速率大小关系为v正___________ v逆(填“大于”、“小于”或“等于”)。

(1)根据图提供的信息,写出该反应的热化学方程式
(2)在恒容容器中,下列描述中能说明上述反应已达平衡的是___________
| A.3v(H2)正=2v(NH3)逆 |
| B.单位时间内生成n mol N2的同时生成2n mol NH3 |
| C.混合气体的密度不再改变 |
| D.容器内压强不随时间的变化而变化 |
(3)一定温度下,向2 L密闭容器中充入1 mol N2和3 mol H2,保持体积不变,0.5 min后达到平衡,测得容器中有0.4 mol NH3,则平均反应速率v(N2)=
(4)保持温度和体积不变,向上述平衡体系中再加入1 mol N2、1 mol H2 、1 mol NH3 后该反应的速率大小关系为v正
您最近半年使用:0次
2023-11-04更新
|
80次组卷
|
2卷引用:河北省石家庄市辛集市育才中学2023-2024学年高三上学期12月月考化学试题
名校
10 . 通过2NO(g)+2CO(g) 2CO2(g)+N2(g) △H=-746.5kJ•mol-1催化还原的方法,可将汽车尾气中有害气体转化为无害气体。下列说法正确的是
2CO2(g)+N2(g) △H=-746.5kJ•mol-1催化还原的方法,可将汽车尾气中有害气体转化为无害气体。下列说法正确的是
 2CO2(g)+N2(g) △H=-746.5kJ•mol-1催化还原的方法,可将汽车尾气中有害气体转化为无害气体。下列说法正确的是
2CO2(g)+N2(g) △H=-746.5kJ•mol-1催化还原的方法,可将汽车尾气中有害气体转化为无害气体。下列说法正确的是| A.该反应在任何条件下都能自发进行 |
B.反应的平衡常数可表示为K=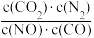 |
C.其它条件不变,增大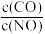 的值,NO的转化率下降 的值,NO的转化率下降 |
| D.使用高效的催化剂可以降低反应的焓变 |
您最近半年使用:0次