名校
1 . I2O5是白色粉末状固体,在合成氨工业中常用I2O5来定量测量CO的含量。
已知:(I)2I2(s)+5O2(g)=2I2O5(s)
(Π)I2O5(s)+5CO(g) 5CO2(g)+I2(s)
5CO2(g)+I2(s)
(1)结合反应I和反应II分析,I2在CO转化为CO2的反应中所起的作用是______ 。20℃时向装有足量I2O5的2L恒容密闭容器中充入2molCO,发生反应II,反应达到平衡后固体质量减小8g,该温度下反应的平衡常数K=______ (写出计算过程,结果用分数表示)。
(2)若在恒温恒容的密闭体系中进行上述反应II,下列不能说明反应II达到平衡状态的是______ 。
(3)10℃时,某恒容密闭容器中充有足量的I2O5,向该容器中充入CO,发生反应II,平衡时CO2与充入CO的物质的量关系如图所示。
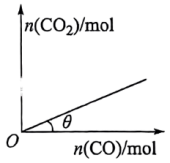
若压缩容器体积;θ值______ (填“增大”“减小”或“不变”),理由是______ 。
已知:(I)2I2(s)+5O2(g)=2I2O5(s)
(Π)I2O5(s)+5CO(g)
 5CO2(g)+I2(s)
5CO2(g)+I2(s)(1)结合反应I和反应II分析,I2在CO转化为CO2的反应中所起的作用是
(2)若在恒温恒容的密闭体系中进行上述反应II,下列不能说明反应II达到平衡状态的是
| A.混合气体的密度保持不变 | B.CO和CO2的物质的量相等 |
| C.v(CO)=v(CO2) | D.混合气体的平均分子量不变 |
(3)10℃时,某恒容密闭容器中充有足量的I2O5,向该容器中充入CO,发生反应II,平衡时CO2与充入CO的物质的量关系如图所示。

若压缩容器体积;θ值
您最近一年使用:0次
名校
2 . 下列情况不能用勒夏特列原理解释的是
| A.新制氯水久置,会变为无色透明 | B.工业合成氨采用高温 |
| C.蒸干、灼烧氯化铝溶液得到氧化铝 | D.用热的纯碱溶液去油污 |
您最近一年使用:0次
名校
解题方法
3 . Ⅰ.高铁电池:高铁酸钾(K2FeO4)不仅是一种理想的水处理剂,并且以其为主体的高铁电池研制也在进行中。如图所示是高铁电池的模拟实验装置。___________ 。
(2)盐桥中盛有饱和 溶液,此盐桥中氯离子向
溶液,此盐桥中氯离子向___________ (填“左”或“右”)移动。
(3)下图为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有:___________ 。
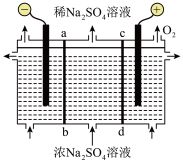
利用如图所示装置,以惰性电极进行电解,ab、cd均为离子交换膜,可进行烧碱与硫酸的制备。___________ ,ab为___________ (填“阴”或“阳”)离子交换膜。阳极对应的电极反应式:___________ 。
Ⅲ.碱性银锌二次航空电池为价格昂贵的高能电池。
该电池的总反应为: ,其电池中的基本单元示意图如下:
,其电池中的基本单元示意图如下: ___________ (填“正极”或“负极”)。
(6)以 溶液为电解液,放电时,锌电极板区域中发生的电极反应可分为两步:
溶液为电解液,放电时,锌电极板区域中发生的电极反应可分为两步:
反应(ⅰ)锌电极板的溶解:
反应(ⅱ)锌电极板上 的析出:
的析出:
放电时,析出的 会覆盖在锌电极板表面,影响电池使用效果。用浓
会覆盖在锌电极板表面,影响电池使用效果。用浓 溶液可大大改善此情况,请结合化学用语,从速率和平衡的角度说明原因:
溶液可大大改善此情况,请结合化学用语,从速率和平衡的角度说明原因:___________ 。
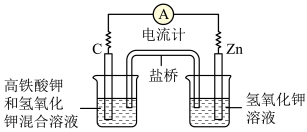
(2)盐桥中盛有饱和
 溶液,此盐桥中氯离子向
溶液,此盐桥中氯离子向(3)下图为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有:

利用如图所示装置,以惰性电极进行电解,ab、cd均为离子交换膜,可进行烧碱与硫酸的制备。
Ⅲ.碱性银锌二次航空电池为价格昂贵的高能电池。
该电池的总反应为:
 ,其电池中的基本单元示意图如下:
,其电池中的基本单元示意图如下: 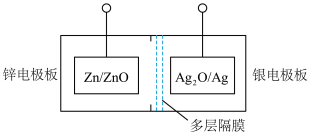
(6)以
 溶液为电解液,放电时,锌电极板区域中发生的电极反应可分为两步:
溶液为电解液,放电时,锌电极板区域中发生的电极反应可分为两步:反应(ⅰ)锌电极板的溶解:

反应(ⅱ)锌电极板上
 的析出:
的析出:
放电时,析出的
 会覆盖在锌电极板表面,影响电池使用效果。用浓
会覆盖在锌电极板表面,影响电池使用效果。用浓 溶液可大大改善此情况,请结合化学用语,从速率和平衡的角度说明原因:
溶液可大大改善此情况,请结合化学用语,从速率和平衡的角度说明原因:
您最近一年使用:0次
名校
4 . 对SO2、NOx、CO2和CO进行回收利用是节能减排的重要课题。某温度下,向恒容密闭容器中充入NO2、SO2发生反应:NO2(g)+SO2(g) SO3(g)+NO(g)。能说明该可逆反应的正反应为吸热反应的是
SO3(g)+NO(g)。能说明该可逆反应的正反应为吸热反应的是
 SO3(g)+NO(g)。能说明该可逆反应的正反应为吸热反应的是
SO3(g)+NO(g)。能说明该可逆反应的正反应为吸热反应的是| A.升高温度正反应速率增大 |
| B.达到平衡降低温度后,NO的体积分数减小 |
| C.恒压时充入氩气,逆反应速率降低 |
| D.达到平衡使用催化剂后,各物质浓度不变 |
您最近一年使用:0次
5 . 羰基硫(COS)可作为一种粮食熏蒸剂。在恒容密闭容器中,将CO和 混合加热并达到下列平衡:
混合加热并达到下列平衡: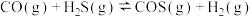
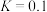 。反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是
。反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是
 混合加热并达到下列平衡:
混合加热并达到下列平衡: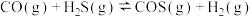
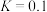 。反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是
。反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是A.若升高温度, 浓度增加,表明该反应是吸热反应 浓度增加,表明该反应是吸热反应 |
| B.通入CO后,正反应速率瞬间增大随后逐渐减小,逆反应速率逐渐增大 |
C.反应前 物质的量为8mol 物质的量为8mol |
| D.CO的平衡转化率为80% |
您最近一年使用:0次
23-24高三上·上海浦东新·阶段练习
名校
6 . 某研究性学习小组通过亚硫酸钠固体和浓硫酸反应制备SO2并进行性质探究。
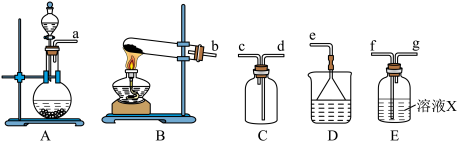
Ⅰ.制备干燥的SO2
(1)制备SO2反应的方程式为___________ 。
(2)根据上述原理制备收集干燥SO2的实验装置连接顺序为___________ (填序号)。
(3)溶液X中盛放的试剂为___________ ,装置D的作用为___________ 。
Ⅱ.SO2性质的探究
研究性学校小组将纯净的SO2通100 mL溶液Y中,进行SO2性质的探究。
探究活动1:SO2的氧化性
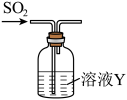
(4)Y是Na2S溶液,可观察到的现象___________ 。Na2S溶液的浓度为0.1 mol/L溶液最多可以吸收标况下的SO2体积为___________ mL(不考虑SO2的溶解)。
探究活动2:SO2的溶解性和酸性
(5)若Y为石蕊溶液,可观察到的现象为___________ ,用方程式表示产生该现象的原因___________ 。
(6)若Y为1 mol/L的NaOH溶液,通入2.24 L SO2(标准状况下),得到的溶液中: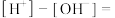
___________ (用溶液中的含硫微粒浓度表示)。
探究活动3:SO2与FeCl3溶液的反应
实验1中出现红棕色的原因,研究小组成员查阅资料得: 与
与 作用可以生成红棕色的配离子:
作用可以生成红棕色的配离子: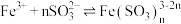 (红棕色)。
(红棕色)。
(7)实验2中,溶液由黄色变为浅绿色的离子方程式为___________ 。
(8)结合速率与平衡的知识,解释实验1颜色变化的原因___________ 。
(9)解释实验2的现象与实验1的现象不同的原因___________ 。

Ⅰ.制备干燥的SO2
(1)制备SO2反应的方程式为
(2)根据上述原理制备收集干燥SO2的实验装置连接顺序为
(3)溶液X中盛放的试剂为
Ⅱ.SO2性质的探究
研究性学校小组将纯净的SO2通100 mL溶液Y中,进行SO2性质的探究。
探究活动1:SO2的氧化性

(4)Y是Na2S溶液,可观察到的现象
探究活动2:SO2的溶解性和酸性
(5)若Y为石蕊溶液,可观察到的现象为
(6)若Y为1 mol/L的NaOH溶液,通入2.24 L SO2(标准状况下),得到的溶液中:
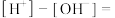
探究活动3:SO2与FeCl3溶液的反应
| 实验 | 溶液Y | 现象 |
| 1 | 1 mol/L FeCl3溶液 | 溶液由黄色变为红棕色,静置,溶液红棕色逐渐消失,1 h后变为浅绿色 |
| 2 | 1 mol/L FeCl3溶液和HCl混合溶液 | 溶液由黄色变为浅绿色 |
 与
与 作用可以生成红棕色的配离子:
作用可以生成红棕色的配离子: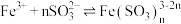 (红棕色)。
(红棕色)。(7)实验2中,溶液由黄色变为浅绿色的离子方程式为
(8)结合速率与平衡的知识,解释实验1颜色变化的原因
(9)解释实验2的现象与实验1的现象不同的原因
您最近一年使用:0次
名校
7 . 乙酸制氢具有重要意义,同时可能发生的反应如下:
热裂解反应: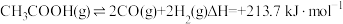
脱羧基反应:
完成下列问题:
(1)乙酸制氢时选择___________ (填“高压”或“常压”)有利于提高转化率。
(2)乙酸制直时温度与气体产率关系如图所示。
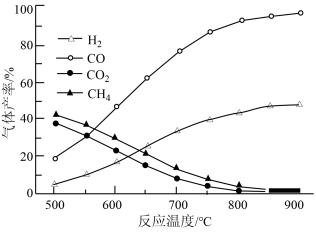
约650℃之前,脱羧基反应活化能低,速率快,故氢气产率低于甲烷;650℃之后氢气产率高于甲烷,理由是随若温度升高,热裂解反应速率加快,且___________ 。
(3)保持其他条件不变,在乙酸气中掺杂一定量水蒸气,氢气产率显著提高而CO的产率下降,请分析原因:___________ 。
热裂解反应:
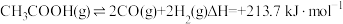
脱羧基反应:

完成下列问题:
(1)乙酸制氢时选择
(2)乙酸制直时温度与气体产率关系如图所示。

约650℃之前,脱羧基反应活化能低,速率快,故氢气产率低于甲烷;650℃之后氢气产率高于甲烷,理由是随若温度升高,热裂解反应速率加快,且
(3)保持其他条件不变,在乙酸气中掺杂一定量水蒸气,氢气产率显著提高而CO的产率下降,请分析原因:
您最近一年使用:0次
名校
8 . 在 的平衡体系中,当分离出
的平衡体系中,当分离出 时,下列说法正确
时,下列说法正确
 的平衡体系中,当分离出
的平衡体系中,当分离出 时,下列说法正确
时,下列说法正确| A.单位时间单位体积内氮气与氢气的有效碰撞次数增加 | B.平衡向逆反应方向移动 |
| C.正反应速率变化更显著 | D.逆反应速率先变小后变大 |
您最近一年使用:0次
2023-01-11更新
|
135次组卷
|
3卷引用:上海市嘉定区第二中学2022-2023学年高二下学期第一次质量检测化学试题
上海市嘉定区第二中学2022-2023学年高二下学期第一次质量检测化学试题上海市晋元高级中学2022-2023学年高二上学期1月期末考试(等级考)化学试题(已下线)专题03 化学反应进行的方向和限度-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(上海专用)
名校
9 . 某温度下,向密闭容器中充入等物质的量的 和
和 ,发生反应
,发生反应 。达到平衡后,下列说法正确的是
。达到平衡后,下列说法正确的是
 和
和 ,发生反应
,发生反应 。达到平衡后,下列说法正确的是
。达到平衡后,下列说法正确的是A.增大压强,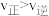 ,平衡常数增大 ,平衡常数增大 |
B.加入催化剂,平衡时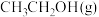 的浓度增大 的浓度增大 |
C.恒温下,移走一定量的 , , 变大, 变大, 变小 变小 |
D.恒容下,充入一定量的 ,平衡时 ,平衡时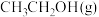 的体积分数一定降低 的体积分数一定降低 |
您最近一年使用:0次
2022-12-16更新
|
687次组卷
|
3卷引用:上海市行知中学2022-2023学年高二下学期2月月考化学试题
名校
10 . 认识化学反应的快慢和限度规律及影响因素,通过调控更好地满足工农业生产和日常生活的实际需要。
Ⅰ.根据所学知识,完成下列各题:
(1)决定化学反应速率的内在因素是_______。
(2)下列过程中,需要加快反应速率的是_______。
Ⅱ.用相同质量的锌片和铜粉跟相同浓度的足量的稀盐酸反应,得到的实验数据如下表所示:
(3)实验①和②表明_______ ,化学反应速率越快。
(4)能表明固体的表面积对反应速率有影响的实验编号是_______ 。
(5)该实验的目的是探究_______ 等因素对锌和稀盐酸反应速率的影响。
(6)请设计一个实验方案探究盐酸的浓度对反应速率的影响。_______
(7)对于2HBr(g) H2(g)+Br2(g)反应,下列四个图中可以表示该反应在一定条件下为可逆反应的是_______。
H2(g)+Br2(g)反应,下列四个图中可以表示该反应在一定条件下为可逆反应的是_______。
(8)对于平衡体系:FeCl3+3KSCN Fe(SCN)3+3KCl,下列描述正确的是_______。(多选)
Fe(SCN)3+3KCl,下列描述正确的是_______。(多选)
Ⅲ.牙齿表面被一层坚硬的名叫羟基磷酸钙的物质保护着,该物质的组成为Ca5(PO4)3OH,它在唾液中存在下列平衡:Ca5(PO4)3OH(s) 5Ca2+(aq)+3
5Ca2+(aq)+3 (aq)+OH-(aq)
(aq)+OH-(aq)
(9)口腔中的细菌和酶在消化分解食物时,会产生有机酸,从而使羟基磷酸钙溶解。若不及时处理,最终会使牙齿产生蛀洞。适用化学平衡知识解释酸使羟基磷酸钙溶解的原因。_______
Ⅰ.根据所学知识,完成下列各题:
(1)决定化学反应速率的内在因素是_______。
| A.温度和压强 | B.反应物的浓度 |
| C.反应物自身的性质 | D.催化剂 |
| A.钢铁腐蚀 | B.食物腐败 | C.炼钢 | D.塑料老化 |
Ⅱ.用相同质量的锌片和铜粉跟相同浓度的足量的稀盐酸反应,得到的实验数据如下表所示:
| 实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气所需时间/s |
| ① | 薄片 | 15 | 200 |
| ② | 薄片 | 25 | 90 |
| ③ | 粉末 | 25 | 10 |
(4)能表明固体的表面积对反应速率有影响的实验编号是
(5)该实验的目的是探究
(6)请设计一个实验方案探究盐酸的浓度对反应速率的影响。
(7)对于2HBr(g)
 H2(g)+Br2(g)反应,下列四个图中可以表示该反应在一定条件下为可逆反应的是_______。
H2(g)+Br2(g)反应,下列四个图中可以表示该反应在一定条件下为可逆反应的是_______。A. | B. | C. | D. |
 Fe(SCN)3+3KCl,下列描述正确的是_______。(多选)
Fe(SCN)3+3KCl,下列描述正确的是_______。(多选)| A.其他条件不变,增大FeCl3溶液浓度,溶液的血红色加深 |
| B.其他条件不变,增大KSCN溶液的浓度,平衡正向移动 |
| C.其他条件不变,加入一定量的KCl固体,平衡逆向移动,溶液颜色变浅 |
| D.其他条件不变,加入少量的铁粉,振荡,溶液颜色变浅 |
Ⅲ.牙齿表面被一层坚硬的名叫羟基磷酸钙的物质保护着,该物质的组成为Ca5(PO4)3OH,它在唾液中存在下列平衡:Ca5(PO4)3OH(s)
 5Ca2+(aq)+3
5Ca2+(aq)+3 (aq)+OH-(aq)
(aq)+OH-(aq)(9)口腔中的细菌和酶在消化分解食物时,会产生有机酸,从而使羟基磷酸钙溶解。若不及时处理,最终会使牙齿产生蛀洞。适用化学平衡知识解释酸使羟基磷酸钙溶解的原因。
您最近一年使用:0次



