名校
1 . 下列情况不能用勒夏特列原理解释的是
| A.新制氯水久置,会变为无色透明 | B.工业合成氨采用高温 |
| C.蒸干、灼烧氯化铝溶液得到氧化铝 | D.用热的纯碱溶液去油污 |
您最近一年使用:0次
名校
解题方法
2 . Ⅰ.高铁电池:高铁酸钾(K2FeO4)不仅是一种理想的水处理剂,并且以其为主体的高铁电池研制也在进行中。如图所示是高铁电池的模拟实验装置。___________ 。
(2)盐桥中盛有饱和 溶液,此盐桥中氯离子向
溶液,此盐桥中氯离子向___________ (填“左”或“右”)移动。
(3)下图为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有:___________ 。
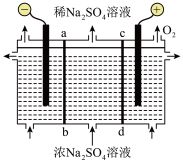
利用如图所示装置,以惰性电极进行电解,ab、cd均为离子交换膜,可进行烧碱与硫酸的制备。___________ ,ab为___________ (填“阴”或“阳”)离子交换膜。阳极对应的电极反应式:___________ 。
Ⅲ.碱性银锌二次航空电池为价格昂贵的高能电池。
该电池的总反应为: ,其电池中的基本单元示意图如下:
,其电池中的基本单元示意图如下: ___________ (填“正极”或“负极”)。
(6)以 溶液为电解液,放电时,锌电极板区域中发生的电极反应可分为两步:
溶液为电解液,放电时,锌电极板区域中发生的电极反应可分为两步:
反应(ⅰ)锌电极板的溶解:
反应(ⅱ)锌电极板上 的析出:
的析出:
放电时,析出的 会覆盖在锌电极板表面,影响电池使用效果。用浓
会覆盖在锌电极板表面,影响电池使用效果。用浓 溶液可大大改善此情况,请结合化学用语,从速率和平衡的角度说明原因:
溶液可大大改善此情况,请结合化学用语,从速率和平衡的角度说明原因:___________ 。
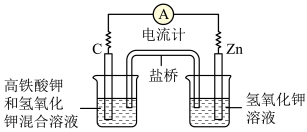
(2)盐桥中盛有饱和
 溶液,此盐桥中氯离子向
溶液,此盐桥中氯离子向(3)下图为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有:

利用如图所示装置,以惰性电极进行电解,ab、cd均为离子交换膜,可进行烧碱与硫酸的制备。
Ⅲ.碱性银锌二次航空电池为价格昂贵的高能电池。
该电池的总反应为:
 ,其电池中的基本单元示意图如下:
,其电池中的基本单元示意图如下: 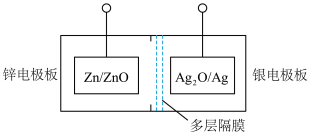
(6)以
 溶液为电解液,放电时,锌电极板区域中发生的电极反应可分为两步:
溶液为电解液,放电时,锌电极板区域中发生的电极反应可分为两步:反应(ⅰ)锌电极板的溶解:

反应(ⅱ)锌电极板上
 的析出:
的析出:
放电时,析出的
 会覆盖在锌电极板表面,影响电池使用效果。用浓
会覆盖在锌电极板表面,影响电池使用效果。用浓 溶液可大大改善此情况,请结合化学用语,从速率和平衡的角度说明原因:
溶液可大大改善此情况,请结合化学用语,从速率和平衡的角度说明原因:
您最近一年使用:0次
23-24高三上·上海浦东新·阶段练习
名校
3 . 某研究性学习小组通过亚硫酸钠固体和浓硫酸反应制备SO2并进行性质探究。
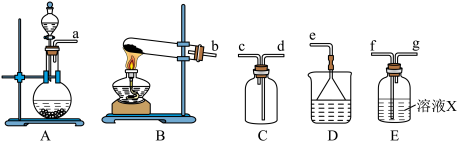
Ⅰ.制备干燥的SO2
(1)制备SO2反应的方程式为___________ 。
(2)根据上述原理制备收集干燥SO2的实验装置连接顺序为___________ (填序号)。
(3)溶液X中盛放的试剂为___________ ,装置D的作用为___________ 。
Ⅱ.SO2性质的探究
研究性学校小组将纯净的SO2通100 mL溶液Y中,进行SO2性质的探究。
探究活动1:SO2的氧化性
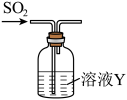
(4)Y是Na2S溶液,可观察到的现象___________ 。Na2S溶液的浓度为0.1 mol/L溶液最多可以吸收标况下的SO2体积为___________ mL(不考虑SO2的溶解)。
探究活动2:SO2的溶解性和酸性
(5)若Y为石蕊溶液,可观察到的现象为___________ ,用方程式表示产生该现象的原因___________ 。
(6)若Y为1 mol/L的NaOH溶液,通入2.24 L SO2(标准状况下),得到的溶液中: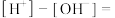
___________ (用溶液中的含硫微粒浓度表示)。
探究活动3:SO2与FeCl3溶液的反应
实验1中出现红棕色的原因,研究小组成员查阅资料得: 与
与 作用可以生成红棕色的配离子:
作用可以生成红棕色的配离子: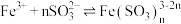 (红棕色)。
(红棕色)。
(7)实验2中,溶液由黄色变为浅绿色的离子方程式为___________ 。
(8)结合速率与平衡的知识,解释实验1颜色变化的原因___________ 。
(9)解释实验2的现象与实验1的现象不同的原因___________ 。

Ⅰ.制备干燥的SO2
(1)制备SO2反应的方程式为
(2)根据上述原理制备收集干燥SO2的实验装置连接顺序为
(3)溶液X中盛放的试剂为
Ⅱ.SO2性质的探究
研究性学校小组将纯净的SO2通100 mL溶液Y中,进行SO2性质的探究。
探究活动1:SO2的氧化性

(4)Y是Na2S溶液,可观察到的现象
探究活动2:SO2的溶解性和酸性
(5)若Y为石蕊溶液,可观察到的现象为
(6)若Y为1 mol/L的NaOH溶液,通入2.24 L SO2(标准状况下),得到的溶液中:
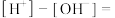
探究活动3:SO2与FeCl3溶液的反应
| 实验 | 溶液Y | 现象 |
| 1 | 1 mol/L FeCl3溶液 | 溶液由黄色变为红棕色,静置,溶液红棕色逐渐消失,1 h后变为浅绿色 |
| 2 | 1 mol/L FeCl3溶液和HCl混合溶液 | 溶液由黄色变为浅绿色 |
 与
与 作用可以生成红棕色的配离子:
作用可以生成红棕色的配离子: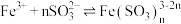 (红棕色)。
(红棕色)。(7)实验2中,溶液由黄色变为浅绿色的离子方程式为
(8)结合速率与平衡的知识,解释实验1颜色变化的原因
(9)解释实验2的现象与实验1的现象不同的原因
您最近一年使用:0次
名校
4 . 乙酸制氢具有重要意义,同时可能发生的反应如下:
热裂解反应: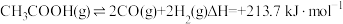
脱羧基反应:
完成下列问题:
(1)乙酸制氢时选择___________ (填“高压”或“常压”)有利于提高转化率。
(2)乙酸制直时温度与气体产率关系如图所示。
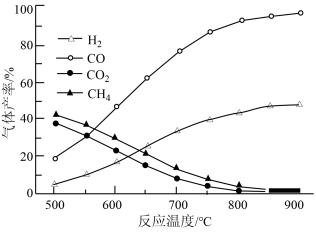
约650℃之前,脱羧基反应活化能低,速率快,故氢气产率低于甲烷;650℃之后氢气产率高于甲烷,理由是随若温度升高,热裂解反应速率加快,且___________ 。
(3)保持其他条件不变,在乙酸气中掺杂一定量水蒸气,氢气产率显著提高而CO的产率下降,请分析原因:___________ 。
热裂解反应:
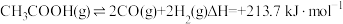
脱羧基反应:

完成下列问题:
(1)乙酸制氢时选择
(2)乙酸制直时温度与气体产率关系如图所示。

约650℃之前,脱羧基反应活化能低,速率快,故氢气产率低于甲烷;650℃之后氢气产率高于甲烷,理由是随若温度升高,热裂解反应速率加快,且
(3)保持其他条件不变,在乙酸气中掺杂一定量水蒸气,氢气产率显著提高而CO的产率下降,请分析原因:
您最近一年使用:0次
名校
5 . 在 的平衡体系中,当分离出
的平衡体系中,当分离出 时,下列说法正确
时,下列说法正确
 的平衡体系中,当分离出
的平衡体系中,当分离出 时,下列说法正确
时,下列说法正确| A.单位时间单位体积内氮气与氢气的有效碰撞次数增加 | B.平衡向逆反应方向移动 |
| C.正反应速率变化更显著 | D.逆反应速率先变小后变大 |
您最近一年使用:0次
2023-01-11更新
|
138次组卷
|
3卷引用:上海市嘉定区第二中学2022-2023学年高二下学期第一次质量检测化学试题
上海市嘉定区第二中学2022-2023学年高二下学期第一次质量检测化学试题上海市晋元高级中学2022-2023学年高二上学期1月期末考试(等级考)化学试题(已下线)专题03 化学反应进行的方向和限度-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(上海专用)
9-10高一下·辽宁大连·期末
名校
解题方法
6 . 对于任何一个化学反应平衡体系,采用以下措施,一定会使化学反应发生平衡移动的是
| A.加入一种反应物 | B.升高温度 |
| C.对平衡体系增加压强 | D.使用催化剂 |
您最近一年使用:0次
2022-11-12更新
|
105次组卷
|
77卷引用:上海市建平世纪中学2023-2024学年高二上学期阶段练习二 化学(等级)试题
上海市建平世纪中学2023-2024学年高二上学期阶段练习二 化学(等级)试题2015-2016学年辽宁师大附中高一下学期6月月考化学试卷2016-2017学年宁夏育才中学高二上第一次月考化学卷2016-2017学年陕西西藏民族学院附中高二上月考二化学卷2016-2017学年江苏省泰州中学高二上月考一化学试卷2017届宁夏银川二中高三上学期统练二化学试卷浙江省诸暨中学2019-2020学年高二上学期10月阶段性考试化学试题福建省永安市第三中学2019-2020学年高二10月月考化学试题安徽省淮北市第一中学2019-2020学年高二12月月考化学试题贵州省毕节市民族中学2019-2020学年高二上学期第二次月考化学试题河南省安阳市第一中学2020-2021学年高二上学期第一次阶段考试化学试题山西省新绛县第二中学2019-2020学年高二上学期第一次考试化学试题天津市第八中学2020-2021学年高二上学期第三次统练化学试题安徽省蚌埠田家炳中学2020-2021学年高二12月月考化学试题江苏省泰州中学2020-2021学年高二上学期第一次月度质量检测化学试题四川省成都市蒲江县蒲江中学2020-2021学年高二3月月考化学试题吉林省长春市第二十九中学2021-2022学年高二上学期第一学程考试化学试题宁夏吴忠市吴忠中学2021-2022学年高二上学期月考化学试题黑龙江省鸡西市第四中学2022-2023学年高二上学期第一次月考化学试题黑龙江省哈尔滨市第三中学校2022-2023学年高二上学期第三次验收考试化学试题云南省蒙自市第一高级中学2022-2023学年高二下学期3月月考化学试题黑龙江省鹤岗市第一中学2022-2023学年高三上学期11月月考化学试题浙江省金华市东阳市外国语学校2023-2024学年高二上学期10月月考化学试题(已下线)09~10年大连23中高一下学期期末考试化学卷(已下线)2010-2011学年广西北海市合浦县教研室高二上学期期末考试化学试卷(已下线)2011-2012学年高二上学期单元测试期中考试化学试卷(已下线)2011-2012学年陕西省咸阳市渭城中学高二上学期期中考试化学试卷(已下线)2011-2012学年甘肃省张掖中学高二上学期期中考试化学(理)试卷(已下线)2011-2012学年吉林省扶余一中高二上学期期中考试化学试卷(已下线)2011-2012学年黑龙江省绥棱县第一中学高二上学期期末考试化学试卷(已下线)2011-2012学年广东省汕头市达濠中学高二上学期期末考试化学试卷(已下线)2011-2012学年浙江省嘉兴八校高二下学期期中联考化学试卷(已下线)2011-2012学年浙江湖州菱湖中学高二下学期期中考试化学试卷(已下线)2012-2013学年广东省汕头市达濠中学高二上学期期末理科化学试卷(已下线)2012-2013学年湖北省武汉市重点中学高二上学期期中考试化学试卷(已下线)2014年化学高考总复习课时演练 7-2化学平衡状态化学平衡移动练习卷(已下线)2013-2014学年江苏省淮安市高中协作体高二下学期期中考试化学试卷(已下线)2014届海南省海南中学高二下学期期中考试化学(理)试卷(已下线)2015届江苏省泰州市姜堰区高二上学期中考试化学试卷(选修)(已下线)2014秋季甘肃省白银市一中高二第一学期期中理科化学试卷2014-2015学年重庆复旦中学高二上学期期中化学试卷2014-2015学年广东省东莞市三校高二上学期期中联考化学试卷2015-2016学年宁夏育才中学高二上学期期中测试化学试卷2015-2016学年海南省文昌中学高二上期中(理)化学试卷2017届广东省清远市清城区高三上期末B卷化学试卷2016-2017学年辽宁省大连市高二上学期期末考试(理)化学试卷天津市第一中学2017-2018学年高二上学期期末考试化学试题湖南省邵东县第十中学2018-2019学年高二上学期期中考试理科班化学试题2019年10月22日《每日一题》2019-2020学年高二化学人教选修4——化学平衡移动的判断甘肃省白银市会宁县第四中学2019-2020学年高二上学期期中考试化学试题安徽省蚌埠市第二中学2019-2020学年高二上学期期中考试化学试题浙江省东阳中学2019-2020学年高二上学期期中考试化学试题陕西省西安电子科技大学附属中学2019-2020学年高二上学期期中考试化学(理)试题湖南省永州市双牌县第二中学2019-2020学年高二上学期期中考试化学试题(选考)陕西省渭南三贤中学2019-2020学年高二上学期期中考试化学试题吉林省普通高中联合体2018-2019学年高二下学期期末联考化学试题【懂做原理题】2020届高三化学选修4二轮专题练——化学平衡移动及其影响因素【精编25题】福建省三明市2019-2020学年高二下学期期末考试化学试题(已下线)第02章 化学反应速率和化学平衡(A卷基础篇)——2020-2021学年高二化学选修四同步单元AB卷(人教版)鲁科版(2019)选择性必修1 第2章 化学反应的方向、限度与速率 第2节 化学反应的限度(已下线)2.3.2+影响化学平衡状态的因素-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)(已下线)2.3.2影响化学平衡状态的因素(基础练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)浙江省杭州市西湖高级中学2020-2021学年高二上学期期末考试化学试题陕西省眉县槐芽中学2020-2021学年高二上学期期中考试化学试题云南省丽江市第一中学2020-2021学年高二下学期期中考试化学试题广东省深圳市福田区外国语高级中学2021-2022学年高二上学期期中考试化学试题陕西省宝鸡市金台区2021-2022学年高二上学期期中考试化学(理)试题福建省南平市浦城县2021-2022学年高二上学期期中考试化学试题云南昆明师范专科学校附属中学2021-2022学年高二上学期期中考试化学试题新疆叶城县第八中学2021-2022学年高二上学期期末考试化学(理)试题 (已下线)2.2.1 化学平衡状态——同步学习必备知识云南省曲靖市富源县第一中学2021-2022学年高二下学期期中考试化学试题江西省赣州市十校协作2022-2023学年高二上学期期中联考化学试题安徽省宿州市十三所重点中学2022-2023学年高二上学期期中质量检测化学试题新疆乌鲁木齐市第八十中学2022-2023学年高二上学期期中考试化学试题四川省广安市育才学校2022-2023学年高二上学期11月期中考试化学试题黑龙江省哈尔滨市第三中学校2022-2023学年高二上学期11月期中考试化学试题
名校
解题方法
7 . 在恒压、NO和 的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为
的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为 的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是
的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是
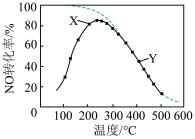
 的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为
的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为 的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是
的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是
A.反应 为吸热反应 为吸热反应 |
| B.图中X点所示条件下,延长反应时间不能提高NO转化率 |
C.图中Y点所示条件下,增加 的浓度不能提高NO转化率 的浓度不能提高NO转化率 |
D.380℃下,c起始 ,NO平衡转化率为50%,则平衡常数 ,NO平衡转化率为50%,则平衡常数 |
您最近一年使用:0次
2022-10-12更新
|
449次组卷
|
2卷引用:上海市控江中学2022-2023学年高二上学期9月阶段测化学试题
名校
8 . 下列实验现象或数据不能用勒沙特列原理解释的是
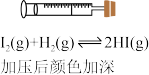 |  | ||||||
| A.观察加压对平衡体系颜色的影响 | B.探究石灰石与稀盐酸在密闭环境下的反应 | ||||||
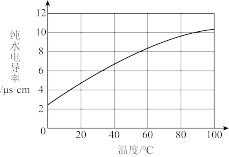 |
| ||||||
| C.测定纯水导电性 | D.测定氨水稀释过程中pH变化 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
9 . 反应mX(g) nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示。下列说法错误的是
nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示。下列说法错误的是
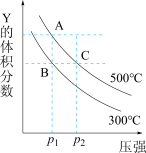
 nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示。下列说法错误的是
nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示。下列说法错误的是
| A.该反应的ΔH>0 | B.m<n+p |
| C.B、C两点化学平衡常数:KB>KC | D.A、C两点的反应速率v(A)<v(C) |
您最近一年使用:0次
2022-09-15更新
|
2039次组卷
|
47卷引用:上海市奉贤中学2022-2023学年高二上学期10月阶段测试化学试题
上海市奉贤中学2022-2023学年高二上学期10月阶段测试化学试题2015-2016学年浙江台州中学高二上第三次统练化学试卷内蒙古自治区北京八中乌兰察布分校2018-2019学年高二下学期第一次月考化学试题湖北省随州二中2019-2020学年高二上学期9月份月考化学试题河南省新野县第一高级中学2019-2020学年高二上学期第二次月考化学试题安徽省蚌埠田家炳中学2020-2021学年高二12月月考化学试题重庆市暨华中学校2021-2022学年高二上学期第一次月考化学试题四川省广安市武胜烈面中学校2021-2022学年高二10月月考化学试题天津市武清区崔黄口中学2021-2022学年高二上学期第一次练习化学试题重庆市永川景圣中学校2021-2022学年高二上学期第一次月考化学试题河南省宋基信阳实验中学2021-2022学年高三上学期12月月考化学试题吉林省长春市第六中学2021-2022学年高二上学期第三学程考试(理)化学试题天津市武清区四校2022-2023学年高二上学期第一次阶段性练习化学试题贵州省黔西南州金成实验学校2022-2023学年高二上学期9月月考化学试题重庆市江津中学2022-2023学年高二上学期10月阶段性考试化学试题山东省滕州市第一中学2022-2023学年高二上学期11月月考化学试题湖南省长沙市长郡中学2022--2023学年高二上学期第二次线上月考化学试题湖南省长沙市长郡中学2022--2023学年高二上学期第二次线上月考化学试题新疆昌吉州行知学校2022-2023学年高二上学期第一次线上月考化学试题四川省宜宾市第四中学校2023-2024学年高二上学期9月月考化学试题四川省广安市岳池县第一中学2023-2024学年高二上学期第一次月考化学试题新疆石河子第一中学2023-2024学年高二上学期11月月考化学试题陕西省咸阳市实验中学2023-2024学年高二上学期段性检测(三)化学试题甘肃省镇原县镇原中学2019-2020学年高二上学期期中考试化学(理)试题甘肃省镇原县镇原中学2019-2020学年高一上学期期中考试化学(理)试题广东省广州市2019-2020学年高二上学期期中模拟测试化学试题(二)2020年北京高二下学期 复习模拟试题二(选修4人教版)(已下线)练习7 化学平衡(二)-2020-2021学年【补习教材·寒假作业】高二化学(人教版)河南省平顶山九校联盟2021-2022学年高二上学期期中考试化学试题四川省广安市2021-2022学年高二上学期期末考试化学试题陕西省西安市西航一中2021-2022学年高二上学期期中考试化学试题黑龙江省伊春市伊美区第二中学2021-2022学年高二上学期期中考试化学试题四川省广安市育才学校2022-2023学年高二上学期11月期中考试化学试题辽宁省部分重点中学2022-2023学年高二上学期期末联考化学试题山东省泰安市宁阳县复圣中学2022-2023学年高二上学期期末考试化学试题湖南省攸县第一中学2022-2023学年高二上学期期末考试化学试题 重庆市育才中学校2022-2023学年高二上学期期中考试化学试题辽宁省丹东市第二中学 大石桥市第三高级中学2022-2023学年高二上学期期末联考化学试题重庆市荣昌中学校2023-2024学年高二上学期期中考试化学试题四川省内江市威远中学校2023-2024学年高二上学期期中考试化学试题新疆生产建设兵团第二师八一中学2023-2024学年高二上学期期中考试化学(理科)试题四川省内江市威远中学校2023-2024学年高二上学期第二次月考(期中)化学试卷陕西省宝鸡市渭滨区2023-2024学年高二上学期期末考试化学试题河南省焦作市博爱县第一中学2023-2024学年高三上学期1月期末化学试题 贵州省遵义市仁怀市第六中学2023-2024学年高二上学期期中考试化学试题河南省驻马店市环际大联考2023-2024学年高二上学期11月期中考试化学试题福建省泉州市泉州中远学校2023-2024学年高二上学期11月期中化学试题
名校
10 . 下列事实能用勒夏特列原理来解释的是
A.实验室采用排饱和食盐水的方法收集氯气Cl2+H2O H++Cl-+HClO H++Cl-+HClO |
B.工业上合成氨反应N2(g)+3H2(g) 2NH3(g) △H<0选择500℃ 2NH3(g) △H<0选择500℃ |
C.H2、I2、HI平衡混合气体加压后颜色加深H2(g)+I2(g) 2HI(g) 2HI(g) |
D.SO2氧化成SO3,往往需要使用催化剂2SO2(g)+O2(g) 2SO3(g) 2SO3(g) |
您最近一年使用:0次
2022-08-25更新
|
420次组卷
|
10卷引用:上海市奉贤中学2022-2023学年高二上学期10月阶段测试化学试题
上海市奉贤中学2022-2023学年高二上学期10月阶段测试化学试题吉林省洮南市第一中学2021-2022学年高二上学期第一次月考化学试题吉林省长春市第二十中学2021-2022学年高二上学期第一次质量检测化学试题江西省宜春市万载中学2021-2022学年高二上学期第二次月考化学试题重庆市九校联盟2017-2018学年高二上学期期中考试化学试题【区级联考】天津市武清区2018-2019学年高二上学期期中质量调查化学试题湖南省永州市双牌县第二中学2019-2020学年高二上学期期中考试化学试题(选考)辽宁省辽河油田第二高级中学2021-2022学年高二上学期开学考试化学试题新疆昌吉州2021-2022学年高二上学期期中质量检测化学试题重庆市渝东六校共同体2022-2023学年高二上学期联合诊断考试化学试题



