名校
1 . 为了探究浓度和温度对平衡的影响,设计如下方案:
已知:

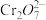 (橙色)+H2O
(橙色)+H2O 2
2 (黄色)+2H+ △H1
(黄色)+2H+ △H1
 (蓝色)+4Cl-
(蓝色)+4Cl-
 (黄色)+4H2O △H2
(黄色)+4H2O △H2
下列叙述正确的是
| 实验 | 操作 | 现象 |
| ① | 向1mL 0.05 mol∙L-1 FeCl3溶液中滴加1滴0.15 mol∙L-1 KSCN溶液 | 溶液变红色 |
| ② | 向1mL 0.05 mol∙L-1 FeCl3溶液中滴加1mL 0.5 mol∙L-1 NaF溶液,再滴1滴0.15 mol∙L-1 KSCN溶液 | 溶液不变红色 |
| ③ | 向1mL 0.1 mol∙L-1 K2Cr2O7溶液中滴加几滴浓硫酸 | 溶液橙色加深 |
| ④ | 将盛有1mL 0.5 mol∙L-1 CuCl2溶液的两支试管,分别置于热水浴和冷水浴中 | 前者溶液显黄色,后者溶液显蓝色 |

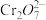 (橙色)+H2O
(橙色)+H2O 2
2 (黄色)+2H+ △H1
(黄色)+2H+ △H1 (蓝色)+4Cl-
(蓝色)+4Cl-
 (黄色)+4H2O △H2
(黄色)+4H2O △H2下列叙述正确的是
A.由①和②可知,Fe(SCN)3比 稳定 稳定 |
B.由③可知,c(H+)增大,平衡向生成 的方向移动 的方向移动 |
| C.由④可知,△H2<0 |
| D.由上述实验可知,向CuCl2溶液持续通入HCl,溶液蓝色加深 |
您最近一年使用:0次
2022-11-05更新
|
158次组卷
|
4卷引用:湖南省河南省湘豫名校联考2022- 2023学年高二上学期阶段考试(一)化学试题
解题方法
2 . 氨是重要的无机化工产品之一,在国民经济中占有重要的地位。液氨可直接作为氮肥外,以氨为原料可生产尿素、硝酸铁、磷酸铵等氨肥,可生产硝酸、丙烯腈等无机和有机化工产品,氨还可用作冷冻、塑料、冶金、医药、国防等工业的原料。
(1)已知N2(g)+3H2(g) 2NH3(g),平衡时NH3的物质的量分数(NH3的物质的量与全部气体物质的量的比值) n(NH3)%与氢氮比
2NH3(g),平衡时NH3的物质的量分数(NH3的物质的量与全部气体物质的量的比值) n(NH3)%与氢氮比 的关系如下图所示,图中T1>T2.。回答下列相关问题:
的关系如下图所示,图中T1>T2.。回答下列相关问题:

①合成氨的反应为___________ (填“吸热”或“放热”)反应。
②实验测得一定条件下合成氨反应速率方程为v=kc(N2)∙c1.5(H2)∙c-1(NH3),以下措施既能加快反应速率,又能提高H2平衡转化率的是________ (填序号)。
a.加压 b.使用催化剂 c.增大氢氮比 d.分离出NH3
③图中P点的 是
是___________ 。
④若反应容器体积为1L,测得P点反应混合气体中NH3的物质的量是 mol,T2时反应的平衡常数是
mol,T2时反应的平衡常数是___________ (保留1位小数)。
(2)氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生如下反应:
①4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ∆H= -905kJ/mol
4NO(g)+6H2O(g) ∆H= -905kJ/mol
②4NH3(g)+3O2(g) 2N2(g)+6H2O(g) ∆H=- 1268kJ/ mol
2N2(g)+6H2O(g) ∆H=- 1268kJ/ mol
则氮气被氧气氧化为NO的热化学方程式为___________ 。
(3)硝酸工业的尾气用NaOH溶液吸收,其中一个反应的化学方程式为NO2+NO+2NaOH=2NaNO2+H2O。常温下,该反应所得NaNO2溶液中 的水解平衡常数Kh=
的水解平衡常数Kh=___________ (将数据列入算式,不用算出结果),溶液中离子浓度从大到小的顺序为_______ 。(已知: HNO2的电离常数Ka=7.1×10-4)
(4)以氨为原料生产硝酸铵,根据所发生的反应,理论上用于生产硝酸的氨占总氨的___________ %。
(1)已知N2(g)+3H2(g)
 2NH3(g),平衡时NH3的物质的量分数(NH3的物质的量与全部气体物质的量的比值) n(NH3)%与氢氮比
2NH3(g),平衡时NH3的物质的量分数(NH3的物质的量与全部气体物质的量的比值) n(NH3)%与氢氮比 的关系如下图所示,图中T1>T2.。回答下列相关问题:
的关系如下图所示,图中T1>T2.。回答下列相关问题:
①合成氨的反应为
②实验测得一定条件下合成氨反应速率方程为v=kc(N2)∙c1.5(H2)∙c-1(NH3),以下措施既能加快反应速率,又能提高H2平衡转化率的是
a.加压 b.使用催化剂 c.增大氢氮比 d.分离出NH3
③图中P点的
 是
是④若反应容器体积为1L,测得P点反应混合气体中NH3的物质的量是
 mol,T2时反应的平衡常数是
mol,T2时反应的平衡常数是(2)氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生如下反应:
①4NH3(g)+5O2(g)
 4NO(g)+6H2O(g) ∆H= -905kJ/mol
4NO(g)+6H2O(g) ∆H= -905kJ/mol②4NH3(g)+3O2(g)
 2N2(g)+6H2O(g) ∆H=- 1268kJ/ mol
2N2(g)+6H2O(g) ∆H=- 1268kJ/ mol则氮气被氧气氧化为NO的热化学方程式为
(3)硝酸工业的尾气用NaOH溶液吸收,其中一个反应的化学方程式为NO2+NO+2NaOH=2NaNO2+H2O。常温下,该反应所得NaNO2溶液中
 的水解平衡常数Kh=
的水解平衡常数Kh=(4)以氨为原料生产硝酸铵,根据所发生的反应,理论上用于生产硝酸的氨占总氨的
您最近一年使用:0次
名校
3 . 一定条件下在密闭烧瓶内发生反应:2NO2(g) N2O4(g) △H<0。下列说法正确的是
N2O4(g) △H<0。下列说法正确的是
 N2O4(g) △H<0。下列说法正确的是
N2O4(g) △H<0。下列说法正确的是| A.测定NO2的相对分子质量时,选择高温、高压条件时误差较小 |
| B.将烧瓶放入热水中,正逆反应速率均加快,烧瓶内气体颜色加深 |
| C.若向烧瓶内充入NO2,平衡向右移动,烧瓶内气体颜色比原来的浅 |
| D.若向烧瓶内充入N2,烧瓶内压强增大,反应速率加快 |
您最近一年使用:0次
2020-10-20更新
|
160次组卷
|
4卷引用:“皖豫名校联盟体”2021届高三上学期第一次考试化学试题
4 . 二甲醚(CH3OCH3)是制冷剂、局部麻醉药和燃料。工业上可利用CO2催化加氢合成二甲醚,其过程中主要发生下列反应:
反应I:CO2(g)+H2(g) CO(g)+H2O(g) △H1>0
CO(g)+H2O(g) △H1>0
反应II:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H2<0
CH3OCH3(g)+3H2O(g) △H2<0
一定条件下,于密闭容器中投入一定量CO2和H2发生上述反应。下列说法正确的是
反应I:CO2(g)+H2(g)
 CO(g)+H2O(g) △H1>0
CO(g)+H2O(g) △H1>0反应II:2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g) △H2<0
CH3OCH3(g)+3H2O(g) △H2<0一定条件下,于密闭容器中投入一定量CO2和H2发生上述反应。下列说法正确的是
| A.其他条件不变,升高温度CO2的平衡转化率降低 |
| B.其他条件不变,缩小容器体积能提高CH3OCH3平衡产率 |
| C.其他条件不变,增大H2投入量一定能提高CH3OCH3平衡产率 |
| D.其他条件不变,使用不同催化剂对CH3OCH3的平衡产率不产生影响 |
您最近一年使用:0次
解题方法
5 . 随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点。甲胺铅碘(CH3NH3PbI3)用作全固态钙钛矿敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g) CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
则该反应的ΔH=_______ 。
(2)上述反应中所需的甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g) CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
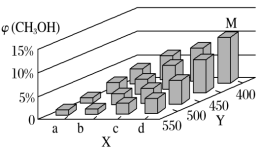
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为________ 。
②X轴上a点的数值比b点________ (填“大”或“小”)。某同学认为上图中Y轴表示温度,你认为他判断的理由是_____________________ 。
(3)实验室可由四氧化三铅和氢碘酸反应制备难溶的PbI2,则每生成3 mol PbI2的反应中,转移电子的物质的量为__________ 。
(4)常温下,PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3mol·L-1,则Ksp(PbI2)=_________ ;已知Ksp(PbCl2)=1.6×10-5,则转化反应PbCl2(s)+2I-(aq)  PbI2(s)+2Cl-(aq)的平衡常数K=
PbI2(s)+2Cl-(aq)的平衡常数K=_________ 。
(5)分解HI曲线和液相法制备HI反应曲线分别如图1和图2所示:
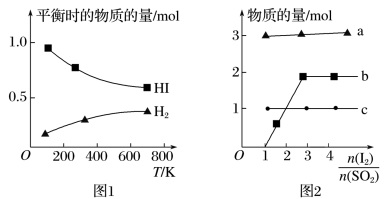
①反应H2(g)+I2(g) =2HI(g) 的ΔH__________ (填大于或小于)0。
②将二氧化硫通入碘水中会发生反应:SO2+I2+2H2O=3H++HSO4-+2I-,I2+I- I3-,图2中曲线a、b分别代表的微粒是
I3-,图2中曲线a、b分别代表的微粒是________ 、_________ (填微粒符号);由图2 知要提高碘的还原率,除控制温度外,还可以采取的措施是___________________________________ 。
(1)制取甲胺的反应为CH3OH(g)+NH3(g)
 CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:| 共价键 | C-O | H-O | N-H | C-N |
| 键能/kJ·mol-1 | 351 | 463 | 393 | 293 |
则该反应的ΔH=
(2)上述反应中所需的甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g)
 CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为
②X轴上a点的数值比b点
(3)实验室可由四氧化三铅和氢碘酸反应制备难溶的PbI2,则每生成3 mol PbI2的反应中,转移电子的物质的量为
(4)常温下,PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3mol·L-1,则Ksp(PbI2)=
 PbI2(s)+2Cl-(aq)的平衡常数K=
PbI2(s)+2Cl-(aq)的平衡常数K=(5)分解HI曲线和液相法制备HI反应曲线分别如图1和图2所示:

①反应H2(g)+I2(g) =2HI(g) 的ΔH
②将二氧化硫通入碘水中会发生反应:SO2+I2+2H2O=3H++HSO4-+2I-,I2+I-
 I3-,图2中曲线a、b分别代表的微粒是
I3-,图2中曲线a、b分别代表的微粒是
您最近一年使用:0次



