1 . 硫酸是重要的化工原料,它的年产量可以用来衡量一个国家的化工生产水平,以黄铁矿为原
料进行接触法制硫酸的流程如下:___________ (填设备名称)中与氧气反应的方程式,每生成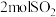 转移
转移___________ mol电子。
(2)在转化阶段,下列条件能使平衡向生成 的方向移动的是_________。
的方向移动的是_________。
(3)硫酸工业生产中 吸收率与进入吸收塔的硫酸浓度和温度关系如图,由图可知吸收
吸收率与进入吸收塔的硫酸浓度和温度关系如图,由图可知吸收 所用硫酸的适宜浓度为98.3%,适宜温度为
所用硫酸的适宜浓度为98.3%,适宜温度为___________ ,而工业生产中一般采用60℃的可能原因是___________ 。
料进行接触法制硫酸的流程如下:

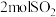 转移
转移(2)在转化阶段,下列条件能使平衡向生成
 的方向移动的是_________。
的方向移动的是_________。| A.不采用常温而加热至400℃-500℃ | B.使用 作为催化剂 作为催化剂 |
| C.向容器中通入过量空气 | D.进入接触室前的混合气体需要先净化 |
(3)硫酸工业生产中
 吸收率与进入吸收塔的硫酸浓度和温度关系如图,由图可知吸收
吸收率与进入吸收塔的硫酸浓度和温度关系如图,由图可知吸收 所用硫酸的适宜浓度为98.3%,适宜温度为
所用硫酸的适宜浓度为98.3%,适宜温度为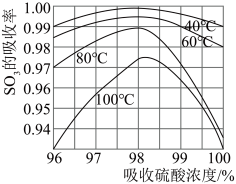
您最近一年使用:0次
名校
2 . Ⅰ.传统的“哈伯法”合成氨原理为: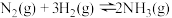
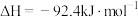
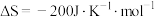
(1)上述反应在常温下___________ (填“能”或“不能”)自发进行。
(2)工业合成氨选择的催化剂是___________ 。
(3)恒温、恒容密闭容器中进行上述反应,一定能说明该反应达到平衡状态的是___________ 。
a. 、
、 、
、 的浓度之比为
的浓度之比为 b.容器内气体压强保持不变
b.容器内气体压强保持不变
c.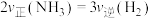 d.混合气体的密度保持不变
d.混合气体的密度保持不变
(4)改变下列条件能加快反应速率,且单位体积内反应物活化分子百分数不变的是___________ 。
a.增大浓度 b.增大压强 c.升高温度 d.使用催化剂
(5)工业合成氨中,下列措施不符合绿色化学理念的是___________ 。
a.将氨气及时液化,分离出反应体系
b.将从反应体系中分离出的 和
和 重新输送到反应器中予以循环利用
重新输送到反应器中予以循环利用
c.氨合成塔中内置热交换器用来预热后续通入的冷的氮气和氢气
d.可采用1000℃的高温使得反应速率更快
Ⅱ.科研小组模拟不同条件下的合成氨反应,向体积可变的密闭容器中充入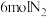 和
和 ,不同温度下平衡时氨气的体积分数与总压强(p)的关系如图所示。
,不同温度下平衡时氨气的体积分数与总压强(p)的关系如图所示。

(6) 、
、 、
、 由小到大的顺序为
由小到大的顺序为___________ 。
(7)在 、
、 条件下,若此时容器体积为
条件下,若此时容器体积为 ,
, 后反应达到平衡,则
后反应达到平衡,则 内
内 的平均反应速率为
的平均反应速率为___________ ,平衡常数
___________ (保留两位有效数字)。
Ⅲ.东南大学王金兰课题组提出合成氨的“表面氢化机理”,在较低的电压下实现氮气的还原合成氨。
已知:第一步: (快)(吸附在催化剂表面的物种用*表示)
(快)(吸附在催化剂表面的物种用*表示)
第二步: (慢)(吸附在催化剂表面)
(慢)(吸附在催化剂表面)
第三步: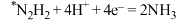 (快)
(快)
(8)较传统工业合成氨法,该方法具有的优点___________ 。
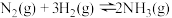
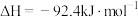
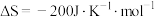
(1)上述反应在常温下
(2)工业合成氨选择的催化剂是
(3)恒温、恒容密闭容器中进行上述反应,一定能说明该反应达到平衡状态的是
a.
 、
、 、
、 的浓度之比为
的浓度之比为 b.容器内气体压强保持不变
b.容器内气体压强保持不变c.
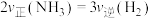 d.混合气体的密度保持不变
d.混合气体的密度保持不变(4)改变下列条件能加快反应速率,且单位体积内反应物活化分子百分数不变的是
a.增大浓度 b.增大压强 c.升高温度 d.使用催化剂
(5)工业合成氨中,下列措施不符合绿色化学理念的是
a.将氨气及时液化,分离出反应体系
b.将从反应体系中分离出的
 和
和 重新输送到反应器中予以循环利用
重新输送到反应器中予以循环利用c.氨合成塔中内置热交换器用来预热后续通入的冷的氮气和氢气
d.可采用1000℃的高温使得反应速率更快
Ⅱ.科研小组模拟不同条件下的合成氨反应,向体积可变的密闭容器中充入
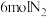 和
和 ,不同温度下平衡时氨气的体积分数与总压强(p)的关系如图所示。
,不同温度下平衡时氨气的体积分数与总压强(p)的关系如图所示。
(6)
 、
、 、
、 由小到大的顺序为
由小到大的顺序为(7)在
 、
、 条件下,若此时容器体积为
条件下,若此时容器体积为 ,
, 后反应达到平衡,则
后反应达到平衡,则 内
内 的平均反应速率为
的平均反应速率为
Ⅲ.东南大学王金兰课题组提出合成氨的“表面氢化机理”,在较低的电压下实现氮气的还原合成氨。
已知:第一步:
 (快)(吸附在催化剂表面的物种用*表示)
(快)(吸附在催化剂表面的物种用*表示)第二步:
 (慢)(吸附在催化剂表面)
(慢)(吸附在催化剂表面)第三步:
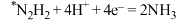 (快)
(快)(8)较传统工业合成氨法,该方法具有的优点
您最近一年使用:0次
名校
3 . 向 的含硫废水中加入适量
的含硫废水中加入适量 溶液,产生黑色沉淀且溶液的pH降低。
溶液,产生黑色沉淀且溶液的pH降低。 、
、 、
、 在水溶液中的物质的量含物分数随pH的分布曲线如图
在水溶液中的物质的量含物分数随pH的分布曲线如图

(1) 水溶液中存在电离平衡
水溶液中存在电离平衡 和
和 。下列关于
。下列关于 溶液的说法正确的是_____
溶液的说法正确的是_____
(2) 时,溶液中硫元素的主要存在形态为
时,溶液中硫元素的主要存在形态为_____
(3)用化学平衡移动原理解释向 的含硫废水中加入
的含硫废水中加入 溶液后pH降低的原因:
溶液后pH降低的原因:_____ 。
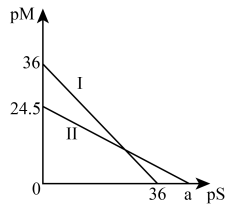
(4)某温度下,CuS和 饱和溶液中pS和pM的关系如图所示,其中
饱和溶液中pS和pM的关系如图所示,其中 ,
,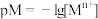 ,
, 为
为 或
或 ,下列说法错误的是____
,下列说法错误的是____
 的含硫废水中加入适量
的含硫废水中加入适量 溶液,产生黑色沉淀且溶液的pH降低。
溶液,产生黑色沉淀且溶液的pH降低。 、
、 、
、 在水溶液中的物质的量含物分数随pH的分布曲线如图
在水溶液中的物质的量含物分数随pH的分布曲线如图
(1)
 水溶液中存在电离平衡
水溶液中存在电离平衡 和
和 。下列关于
。下列关于 溶液的说法正确的是_____
溶液的说法正确的是_____| A.滴加新制氯水,平衡向左移动,溶液pH减小 |
| B.加水,平衡向右移动,溶液中氢离子浓度增大 |
C.通入过量 气体,平衡向左移动,溶液pH增大 气体,平衡向左移动,溶液pH增大 |
| D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子的浓度都减小 |
 时,溶液中硫元素的主要存在形态为
时,溶液中硫元素的主要存在形态为(3)用化学平衡移动原理解释向
 的含硫废水中加入
的含硫废水中加入 溶液后pH降低的原因:
溶液后pH降低的原因:(4)某温度下,CuS和
 饱和溶液中pS和pM的关系如图所示,其中
饱和溶液中pS和pM的关系如图所示,其中 ,
,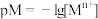 ,
, 为
为 或
或 ,下列说法错误的是____
,下列说法错误的是____
A.曲线Ⅱ代表的是 | B. |
C.此温度下CuS的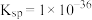 | D.此温度下的饱和溶液中 |
您最近一年使用:0次
名校
4 . 硫酸亚铁晶体(FeSO4●7H2O)在医药上作补血剂。工业上用废铁生产FeSO4●7H2O的一种流程如图所示:
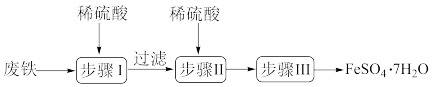
(1)步骤Ⅰ中除铁和硫酸、铁锈和硫酸反应外,还有一个反应的化学方程式为:___________ 。
(2)证明步骤I滤液中只含有 的方法:取样,先滴加
的方法:取样,先滴加___________ ,再滴加___________ (填试剂,名称),该过程的现象___________ 。
(3)步骤Ⅲ从硫酸亚铁溶液中获得硫酸亚铁晶体( )的实验操作为蒸发浓缩、冷却结晶、
)的实验操作为蒸发浓缩、冷却结晶、___________ 、冰水洗涤、烘干。烘干操作需在低温条件下进行,原因是:___________ 。
(4)将FeCl3和KSCN溶液混合,发生可逆反应: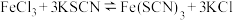 ,已知反应处于平衡状态中,现改变条件请回答下列问题:
,已知反应处于平衡状态中,现改变条件请回答下列问题:
向上述混合液中,若加入少量 固体后,混合溶液红色
固体后,混合溶液红色___________ ;若加入少量 粉后,混合溶液红色
粉后,混合溶液红色___________ ;若加入少量 固体后,混合溶液红色
固体后,混合溶液红色___________ ;若加入 溶液后,混合溶液红色
溶液后,混合溶液红色___________ 。(填“变深”、“变浅”或“不变”;注意,溶液中加入少量固体可以忽略体积变化)

(1)步骤Ⅰ中除铁和硫酸、铁锈和硫酸反应外,还有一个反应的化学方程式为:
(2)证明步骤I滤液中只含有
 的方法:取样,先滴加
的方法:取样,先滴加(3)步骤Ⅲ从硫酸亚铁溶液中获得硫酸亚铁晶体(
 )的实验操作为蒸发浓缩、冷却结晶、
)的实验操作为蒸发浓缩、冷却结晶、(4)将FeCl3和KSCN溶液混合,发生可逆反应:
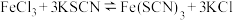 ,已知反应处于平衡状态中,现改变条件请回答下列问题:
,已知反应处于平衡状态中,现改变条件请回答下列问题:向上述混合液中,若加入少量
 固体后,混合溶液红色
固体后,混合溶液红色 粉后,混合溶液红色
粉后,混合溶液红色 固体后,混合溶液红色
固体后,混合溶液红色 溶液后,混合溶液红色
溶液后,混合溶液红色
您最近一年使用:0次
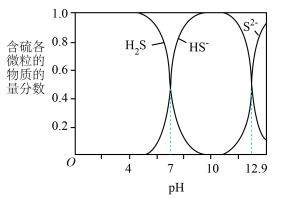
5 . 向pH≈10的含硫废水中加入适量 溶液,产生黑色沉淀且溶液的pH降低。
溶液,产生黑色沉淀且溶液的pH降低。 、
、 、
、 在水溶液中的物质的量含物分数随pH的分布曲线如图
在水溶液中的物质的量含物分数随pH的分布曲线如图
(1) 水溶液中存在电离平衡
水溶液中存在电离平衡 和
和 。下列关于
。下列关于 溶液的说法正确的是___________。
溶液的说法正确的是___________。
(2)pH≈10时,溶液中硫元素的主要存在形态为___________ 。
(3)用化学平衡移动原理解释向pH≈10的含硫废水中加入 溶液后pH降低的原因:
溶液后pH降低的原因:___________ 。
 溶液,产生黑色沉淀且溶液的pH降低。
溶液,产生黑色沉淀且溶液的pH降低。 、
、 、
、 在水溶液中的物质的量含物分数随pH的分布曲线如图
在水溶液中的物质的量含物分数随pH的分布曲线如图
(1)
 水溶液中存在电离平衡
水溶液中存在电离平衡 和
和 。下列关于
。下列关于 溶液的说法正确的是___________。
溶液的说法正确的是___________。| A.滴加新制氯水,平衡向左移动,溶液pH减小 |
| B.加水,平衡向右移动,溶液中氢离子浓度增大 |
C.通入过量 气体,平衡向左移动,溶液pH增大 气体,平衡向左移动,溶液pH增大 |
| D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子的浓度都减小 |
(3)用化学平衡移动原理解释向pH≈10的含硫废水中加入
 溶液后pH降低的原因:
溶液后pH降低的原因:
您最近一年使用:0次
名校
6 . 从平衡移动的角度解释实验室用饱和食盐水收集Cl2的原因___________ 。
您最近一年使用:0次
7 . CO、NO均能够与血红蛋白(Hb)中Fe2+形成稳定的配合物使血红蛋白失去携氧能力,因而具有毒性。CO进入血液后有如下平衡: 。
。
(1)C、N、O三种元素,第一电离能由大到小的顺序为___________ 。
(2)在CO、NO结构中,C、N、O原子均含有孤电子对,与Fe2+配位时,配位原子均不是O原子,理由是___________ 。
(3)高压氧舱可用于治疗CO中毒,结合平衡移动原理解释其原因:___________ 。
 。
。(1)C、N、O三种元素,第一电离能由大到小的顺序为
(2)在CO、NO结构中,C、N、O原子均含有孤电子对,与Fe2+配位时,配位原子均不是O原子,理由是
(3)高压氧舱可用于治疗CO中毒,结合平衡移动原理解释其原因:
您最近一年使用:0次
名校
解题方法
8 . 1913年德国化学家哈伯发明了以低成本制造大量氨的方法,从而大大满足了当时日益增长的人口对粮食的需求。下图是哈伯法的流程图。图中沿X路线到压缩机的物质是
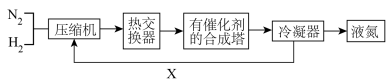

| A.N2和H2 | B.催化剂 | C.N2 | D.H2 |
您最近一年使用:0次
22-23高一下·上海·期末
9 . 工业合成氨
(1)合成氨的适宜条件探究:N2(g)+3H2(g) 2NH3(g) + Q(Q>0)
2NH3(g) + Q(Q>0)
∴合成氨的合理生产条件:① 使用___________ 为催化剂 ②一定程度的加压 ③温度控制在催化剂的活性温度(500℃) ④及时分离___________
(1)合成氨的适宜条件探究:N2(g)+3H2(g)
 2NH3(g) + Q(Q>0)
2NH3(g) + Q(Q>0)| 反应条件 | 对化学反应速率的影响 | 对平衡混合物中NH3含量的影响 | 化学反应速率与化学平衡综合考虑 |
| 增大压强 | 影响一致,应 | ||
| 升高温度 | 影响 | ||
| 使用催化剂 | 用合适催化剂有利于加快反应速率 | ||
| 增加反应物浓度 | 平衡向 | 影响一致应 |
您最近一年使用:0次
22-23高二上·广西玉林·期末
10 . 下列说法正确的是
A.某温度下,反应 ,在密闭容器中达到平衡,恒容下,充入一定量的 ,在密闭容器中达到平衡,恒容下,充入一定量的 , , 的平衡转化率增大 的平衡转化率增大 |
B.恒温恒容情况下,发生反应: ,当混合气体密度保持不变时,说明反应已达到平衡 ,当混合气体密度保持不变时,说明反应已达到平衡 |
C.合成氨工业中,恒温恒容情况下,充入惰性气体 ,体系压强增大,反应速率增大 ,体系压强增大,反应速率增大 |
D.某温度下,可逆反应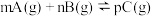 的平衡常数为 的平衡常数为 ,若缩小反应器的容积,能使平衡正向移动,则 ,若缩小反应器的容积,能使平衡正向移动,则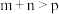 ,并且 ,并且 增大 增大 |
您最近一年使用:0次



