1 . 回答下列问题。
(1)已知下列热化学方程式:
Ⅰ.
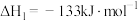
Ⅱ.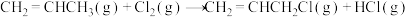
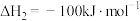
在相同条件下, 的正反应的活化能
的正反应的活化能 为
为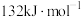 ,则逆反应的活化能
,则逆反应的活化能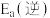 为
为___________  。
。
(2)查阅资料得知,反应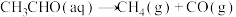 在含有少量I2的溶液中分两步进行:
在含有少量I2的溶液中分两步进行:
第Ⅰ步反应为 (慢反应);
(慢反应);
第Ⅱ步为快反应。
增大I2的浓度___________ (填“能”或“不能”)明显增大总反应的平均速率,理由为___________ 。
(3)氯化铜晶体( )常用作玻璃、陶瓷着色剂和饲料添加剂等。工业上用粗氧化铜粉(含杂质FeO和SiO2)制备无水氯化铜,制取流程如下:
)常用作玻璃、陶瓷着色剂和饲料添加剂等。工业上用粗氧化铜粉(含杂质FeO和SiO2)制备无水氯化铜,制取流程如下:
___________ (填字母,下同)。
a.KMnO4溶液 b.氯水 c.溴水 d.H2O2溶液
②溶液C中加入试剂y可以调节溶液pH,从而除去 而不引入杂质。试剂y可选用下列物质中的
而不引入杂质。试剂y可选用下列物质中的___________ 。
a.Cu b.CuO c. d.NaOH
d.NaOH
③SOCl2与水反应的化学方程式为___________ 。
④SOCl2与 混合并加热,可得到无水CuCl2的原因是
混合并加热,可得到无水CuCl2的原因是___________ 。
(1)已知下列热化学方程式:
Ⅰ.

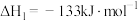
Ⅱ.
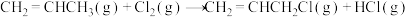
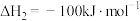
在相同条件下,
 的正反应的活化能
的正反应的活化能 为
为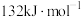 ,则逆反应的活化能
,则逆反应的活化能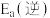 为
为 。
。(2)查阅资料得知,反应
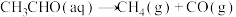 在含有少量I2的溶液中分两步进行:
在含有少量I2的溶液中分两步进行:第Ⅰ步反应为
 (慢反应);
(慢反应);第Ⅱ步为快反应。
增大I2的浓度
(3)氯化铜晶体(
 )常用作玻璃、陶瓷着色剂和饲料添加剂等。工业上用粗氧化铜粉(含杂质FeO和SiO2)制备无水氯化铜,制取流程如下:
)常用作玻璃、陶瓷着色剂和饲料添加剂等。工业上用粗氧化铜粉(含杂质FeO和SiO2)制备无水氯化铜,制取流程如下: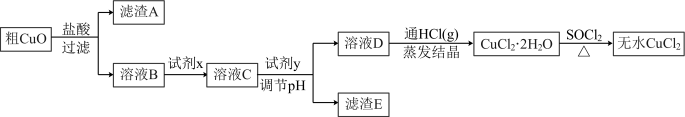
 |  |  | |
| 开始沉淀的pH | 1.9 | 7.0 | 4.7 |
| 沉淀完全的pH | 3.2 | 9.0 | 6.7 |
已知:氯化亚砜(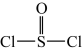 )熔点-105℃,沸点78.8℃,易水解。
)熔点-105℃,沸点78.8℃,易水解。
a.KMnO4溶液 b.氯水 c.溴水 d.H2O2溶液
②溶液C中加入试剂y可以调节溶液pH,从而除去
 而不引入杂质。试剂y可选用下列物质中的
而不引入杂质。试剂y可选用下列物质中的a.Cu b.CuO c.
 d.NaOH
d.NaOH③SOCl2与水反应的化学方程式为
④SOCl2与
 混合并加热,可得到无水CuCl2的原因是
混合并加热,可得到无水CuCl2的原因是
您最近半年使用:0次
解题方法
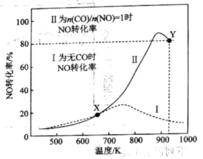
2 . 已知:无CO时反应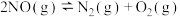 、有CO时反应
、有CO时反应 。在容积为
。在容积为 的容器中,相同时间下测得
的容器中,相同时间下测得 转化为
转化为 的转化率随温度变化如图所示。下列说法不正确的是
的转化率随温度变化如图所示。下列说法不正确的是
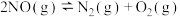 、有CO时反应
、有CO时反应 。在容积为
。在容积为 的容器中,相同时间下测得
的容器中,相同时间下测得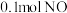 转化为
转化为 的转化率随温度变化如图所示。下列说法不正确的是
的转化率随温度变化如图所示。下列说法不正确的是
A.反应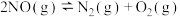 的 的 |
| B.有CO时,该反应在低温条件下自发进行 |
C.Y点再通入CO、 各 各 ,此时v(CO,正)<v(CO,逆) ,此时v(CO,正)<v(CO,逆) |
D.达平衡后,其他条件不变改变物料使 ,CO转化率下降 ,CO转化率下降 |
您最近半年使用:0次
名校
3 . 下列叙述正确的是
A.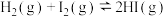  ,在平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变 ,在平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变 |
| B.合成氨工业中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| C.硫酸工业中,催化氧化SO2时常通入稍过量氧气,目的是提高SO2的转化率 |
| D.向BaCO3的悬浊液中加入饱和的硫酸钠溶液,若BaCO3转换成BaSO4,则可证明Ksp:BaSO4<BaCO3 |
您最近半年使用:0次
名校
4 . CuCl2溶液中存在如下平衡:[Cu(H2O)4]2+(蓝色)+4Cl- [CuCl4]2-(黄色)+4H2O △H>0。取相同浓度的CuCl2溶液,分别进行下列实验,下列对实验现象的分析中错误的是
[CuCl4]2-(黄色)+4H2O △H>0。取相同浓度的CuCl2溶液,分别进行下列实验,下列对实验现象的分析中错误的是
 [CuCl4]2-(黄色)+4H2O △H>0。取相同浓度的CuCl2溶液,分别进行下列实验,下列对实验现象的分析中错误的是
[CuCl4]2-(黄色)+4H2O △H>0。取相同浓度的CuCl2溶液,分别进行下列实验,下列对实验现象的分析中错误的是| 操作和现象 | 分析 | |
| A | 观察溶液为绿色 | [Cu(H2O)4]2+和[CuCl4]2-同时存在 |
| B | 升高温度,溶液变为黄绿色 | 平衡正移,[CuCl4]2-的浓度增大 |
| C | 加水稀释,振荡后静置,溶液变为蓝色 | 平衡逆移,[Cu(H2O)4]2+的浓度增大 |
| D | 加几滳AgNO3溶液,静置,上层清液为蓝色 | 平衡逆移,[CuCl4]2-的浓度减小 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2023-02-11更新
|
140次组卷
|
2卷引用:山西省运城市2022-2023学年高二上学期期末调研测试化学试题
5 . 变化观念与平衡思想是化学学科核心素养之一,下列实验事实不能用勒夏特列原理解释的是
| A.久置的氯水黄绿色会褪去 |
| B.工业合成氨过程中及时分离出氨气,有利于提高原料转化率 |
C.木炭粉碎后与 反应,速率更快 反应,速率更快 |
| D.热的纯碱溶液除油污效果好 |
您最近半年使用:0次
名校
解题方法
6 . 硫酸锌是一种重要的工业原料,ZnSO4∙H2O可用于制造印染用的媒染剂,木材及皮革保存剂等。以炼锌厂锌渣为原料,含ZnO、FeO、CuO、CdO等,生产ZnSO4∙H2O的流程如下:
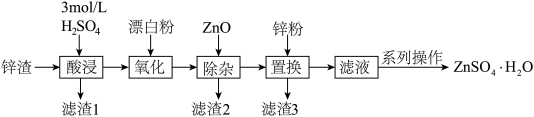
已知:①当溶液中剩余离子浓度小于1×10-5 mol∙L-1时,认为生成沉淀的反应进行完全;
②常温下,Ksp[Fe(OH)3]= 4.0×10-38,Ksp[Fe(OH)2]= 4.9×10-17,Ksp[Cu(OH)2]= 2.2×10-20,Ksp[Zn(OH)2]=1×10-17。
(1)“酸浸”时,需不断通入高温水蒸气,其目的是___________ (填字母)。用18 mol∙L-1的浓硫酸配制3 mol∙L-1H2SO4溶液,下列操作会使所配溶液浓度偏小的是___________ (填字母)。
(2)结合必要的化学反应方程式,从平衡角度解释加入ZnO得到滤渣2的原理:___________ 。除杂过程中,若控制pH=4,溶液中c(Fe3+)=___________ mol∙L-1。结合实际生产情况一般取pH4.5~5.0,pH不宜过大的原因是___________ 。
(3)滤渣3含有Zn和___________ (写化学式)。
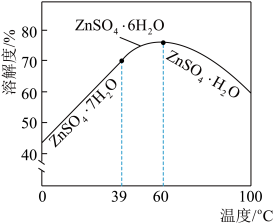
(4)硫酸锌晶体的溶解度与温度的变化如图所示。“系列操作”是:___________ ,洗涤、干燥。

已知:①当溶液中剩余离子浓度小于1×10-5 mol∙L-1时,认为生成沉淀的反应进行完全;
②常温下,Ksp[Fe(OH)3]= 4.0×10-38,Ksp[Fe(OH)2]= 4.9×10-17,Ksp[Cu(OH)2]= 2.2×10-20,Ksp[Zn(OH)2]=1×10-17。
(1)“酸浸”时,需不断通入高温水蒸气,其目的是

(2)结合必要的化学反应方程式,从平衡角度解释加入ZnO得到滤渣2的原理:
(3)滤渣3含有Zn和
(4)硫酸锌晶体的溶解度与温度的变化如图所示。“系列操作”是:

您最近半年使用:0次
2023-01-08更新
|
285次组卷
|
3卷引用:山西省名校联考2022-2023学年高二上学期期末考试化学试题
山西省名校联考2022-2023学年高二上学期期末考试化学试题福建省宁德市2022-2023学年高二上学期期末居家检测化学试题(已下线)黑龙江省牡丹江市第一高级中学2022-2023学年高三上学期期末考试变式汇编(21-24)
名校
解题方法
7 . 下列事实能用勒夏特列原理来解释的是
A.SO2被氧化为SO3,往往需要使用催化剂:2SO2(g)+O2(g)  2SO3(g) 2SO3(g) |
B.500 ℃温度比室温更有利于合成氨反应:N2(g)+3H2(g)  2NH3(g)△H<0 2NH3(g)△H<0 |
C.H2、I2、HI平衡混合气体加压后颜色加深:H2(g)+I2(g)  2HI(g) 2HI(g) |
D.实验室采用排饱和食盐水的方法收集氯气:Cl2+H2O  H++Cl-+HClO H++Cl-+HClO |
您最近半年使用:0次
2022-10-06更新
|
841次组卷
|
40卷引用:山西省怀仁市重点中学2019-2020学年高二上学期期末考试化学试题
山西省怀仁市重点中学2019-2020学年高二上学期期末考试化学试题2015-2016学年湖北省黄冈市高二上学期期末考试化学试卷2015-2016学年内蒙古包头九中高一下期末化学试题【校级联考】福建省晋江市(安溪一中、养正中学、惠安一中、泉州实验中学四校)2018-2019学年高二上学期期中考试化学试题江西省赣州市南康中学2019-2020学年高二上学期第一次月考化学试题山东省师范大学附属中学2019-2020学年高二上学期第五次学分认定考试化学试题山东省实验中学2019-2020学年高二上学期期中考试化学试题(已下线)考点12 化学反应速率化学平衡——《备战2020年高考精选考点专项突破题集》吉林省白城市洮南市第一中学2020-2021学年高二上学期第一次月考化学试题江西省南昌市第十中学2020-2021学年高二上学期第一次月考化学试题(已下线)【南昌新东方】7. 南昌十中 徐钢 刘惠文.(已下线)第七章 能力提升检测卷-2021年高考化学一轮复习讲练测山东省临沂市第四中学2020-2021学年高二11月份阶段检测化学试题新疆生产建设兵团第四师第一中学2020-2021学年高二上学期期中考试化学试题四川省成都新津为明学校2020-2021学年高二上学期期中测试化学试题陕西省咸阳市实验中学2020-2021学年高二上学期第二次月考化学试题湖南省湘潭市第一中学2020-2021学年高二下学期期中考试(水平测试)化学试卷天津市滨海新区大港油田第三中学2020-2021学年高二上学期期中考试化学试题重庆市第七中学2020-2021学年高二上学期第一次月考化学试题河北省张家口市宣化一中2020-2021学年高二下学期期初考试化学试题湖南省长沙宁乡市第十高级中学2020-2021学年高二上学期10月月考化学试题(已下线)课时36 化学平衡及平衡移动-2022年高考化学一轮复习小题多维练(全国通用)(已下线)专题七 能力提升检测卷 (测) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)专题23 化学平衡的移动和化学反应进行的方向(热点讲义)-2022年高三毕业班化学常考点归纳与变式演练重庆市育才中学校2021-2022学年高二上学期第一次月考化学试题四川省广安市武胜烈面中学校2021-2022学年高二10月月考化学试题新疆伊犁市奎屯市第一高级中学2019-2020学年高二上学期期中考试化学试题湖北省石首市第一中学2021-2022学年高二上学期10月月考化学试题(已下线)卷11 化学反应速率和平衡选择题-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)第21讲 化学平衡状态 化学平衡的移动(讲)-2023年高考化学一轮复习讲练测(全国通用)天津市咸水沽第二中学2021-2022学年高二上学期期中化学试题河北省邯郸市大名县第一中学2022-2023学年高二上学期第一次月考化学试题甘肃省张掖市高台县第一中学2022-2023学年高三上学期期中检测化学试题河北省石家庄市第十八中学2022-2023学年高二上学期10月月考化学试题广东省佛山市顺德区第一中学2022-2023学年高二上学期期中考试化学试题广东省佛山市三水中学2022-2023学年高二上学期11月第二次统测化学试题(已下线)第2讲 化学平衡状态及化学平衡的移动广东省肇庆市封开县广信中学、四会中学2023-2024学年高二上学期第一次联考化学试题天津市实验中学滨海学校2022-2023学年高二上学期期中质量调查化学试题广东省湛江市第二十一中学2023-2024学年高二上学期期中考试化学试题
名校
8 . 一定量的混合气体在密闭容器中发生反应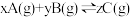 ,达到平衡后测得A的浓度为
,达到平衡后测得A的浓度为 ,保持温度不变,将密闭容器的容积压缩为原来的一半,再次达到平衡后,测得A的浓度为
,保持温度不变,将密闭容器的容积压缩为原来的一半,再次达到平衡后,测得A的浓度为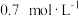 ,则下列叙述正确的是
,则下列叙述正确的是
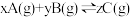 ,达到平衡后测得A的浓度为
,达到平衡后测得A的浓度为 ,保持温度不变,将密闭容器的容积压缩为原来的一半,再次达到平衡后,测得A的浓度为
,保持温度不变,将密闭容器的容积压缩为原来的一半,再次达到平衡后,测得A的浓度为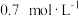 ,则下列叙述正确的是
,则下列叙述正确的是| A.C的体积分数降低 | B.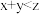 |
| C.B的物质的量浓度减小 | D.平衡向正反应方向移动 |
您最近半年使用:0次
名校
9 . 下列解释现象或事实的离子方程式书写错误的是
A.向K2Cr2O 溶液中滴加几滴浓硫酸,溶液橙色变深:Cr2O 溶液中滴加几滴浓硫酸,溶液橙色变深:Cr2O +H2O +H2O 2CrO 2CrO +2H+ +2H+ |
B.用稀硫酸除去Na2SO4溶液中的Na2S2O3:S2O +2SO +2SO +6H+=4SO2↑+3H2O +6H+=4SO2↑+3H2O |
C.用酸性KMnO4溶液滴定草酸溶液:2MnO +6H++5H2C2O4=2Mn2++10CO2↑+8H2O +6H++5H2C2O4=2Mn2++10CO2↑+8H2O |
D.洪水过后用明矾净水:Al3++3H2O Al(OH)3(胶体)+3H+ Al(OH)3(胶体)+3H+ |
您最近半年使用:0次
2022-01-18更新
|
91次组卷
|
2卷引用:山西省大同市2021-2022学年高二上学期期末质量检测化学试题
10 . H2O2(已知:H2O2 H++HO
H++HO ;)是一种重要的化学品,在医学、军事、工业上应用广泛,其早期制备原理为:
;)是一种重要的化学品,在医学、军事、工业上应用广泛,其早期制备原理为:
Ⅰ.2Ba(NO3)2 2BaO+4NO2↑+O2↑
2BaO+4NO2↑+O2↑
Ⅱ.2BaO(s)+O2(g) 2BaO2(s)
2BaO2(s)
Ⅲ.
下列叙述错误的是
 H++HO
H++HO ;)是一种重要的化学品,在医学、军事、工业上应用广泛,其早期制备原理为:
;)是一种重要的化学品,在医学、军事、工业上应用广泛,其早期制备原理为:Ⅰ.2Ba(NO3)2
 2BaO+4NO2↑+O2↑
2BaO+4NO2↑+O2↑Ⅱ.2BaO(s)+O2(g)
 2BaO2(s)
2BaO2(s)Ⅲ.

下列叙述错误的是
| A.H2O2属于弱电解质 |
| B.其他条件不变,增大氧气的浓度能提高反应II中BaO的平衡转化率 |
| C.其他条件不变,增大氧气的浓度,反应II中氧气的平衡浓度也将增大 |
| D.反应III属于复分解反应 |
您最近半年使用:0次



