名校
1 . I2O5是白色粉末状固体,在合成氨工业中常用I2O5来定量测量CO的含量。
已知:(I)2I2(s)+5O2(g)=2I2O5(s)
(Π)I2O5(s)+5CO(g) 5CO2(g)+I2(s)
5CO2(g)+I2(s)
(1)结合反应I和反应II分析,I2在CO转化为CO2的反应中所起的作用是______ 。20℃时向装有足量I2O5的2L恒容密闭容器中充入2molCO,发生反应II,反应达到平衡后固体质量减小8g,该温度下反应的平衡常数K=______ (写出计算过程,结果用分数表示)。
(2)若在恒温恒容的密闭体系中进行上述反应II,下列不能说明反应II达到平衡状态的是______ 。
(3)10℃时,某恒容密闭容器中充有足量的I2O5,向该容器中充入CO,发生反应II,平衡时CO2与充入CO的物质的量关系如图所示。
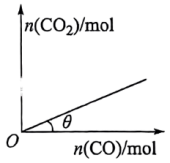
若压缩容器体积;θ值______ (填“增大”“减小”或“不变”),理由是______ 。
已知:(I)2I2(s)+5O2(g)=2I2O5(s)
(Π)I2O5(s)+5CO(g)
 5CO2(g)+I2(s)
5CO2(g)+I2(s)(1)结合反应I和反应II分析,I2在CO转化为CO2的反应中所起的作用是
(2)若在恒温恒容的密闭体系中进行上述反应II,下列不能说明反应II达到平衡状态的是
| A.混合气体的密度保持不变 | B.CO和CO2的物质的量相等 |
| C.v(CO)=v(CO2) | D.混合气体的平均分子量不变 |
(3)10℃时,某恒容密闭容器中充有足量的I2O5,向该容器中充入CO,发生反应II,平衡时CO2与充入CO的物质的量关系如图所示。

若压缩容器体积;θ值
您最近一年使用:0次
23-24高三上·上海浦东新·阶段练习
名校
2 . 某研究性学习小组通过亚硫酸钠固体和浓硫酸反应制备SO2并进行性质探究。
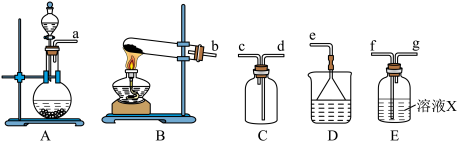
Ⅰ.制备干燥的SO2
(1)制备SO2反应的方程式为___________ 。
(2)根据上述原理制备收集干燥SO2的实验装置连接顺序为___________ (填序号)。
(3)溶液X中盛放的试剂为___________ ,装置D的作用为___________ 。
Ⅱ.SO2性质的探究
研究性学校小组将纯净的SO2通100 mL溶液Y中,进行SO2性质的探究。
探究活动1:SO2的氧化性
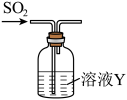
(4)Y是Na2S溶液,可观察到的现象___________ 。Na2S溶液的浓度为0.1 mol/L溶液最多可以吸收标况下的SO2体积为___________ mL(不考虑SO2的溶解)。
探究活动2:SO2的溶解性和酸性
(5)若Y为石蕊溶液,可观察到的现象为___________ ,用方程式表示产生该现象的原因___________ 。
(6)若Y为1 mol/L的NaOH溶液,通入2.24 L SO2(标准状况下),得到的溶液中: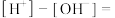
___________ (用溶液中的含硫微粒浓度表示)。
探究活动3:SO2与FeCl3溶液的反应
实验1中出现红棕色的原因,研究小组成员查阅资料得: 与
与 作用可以生成红棕色的配离子:
作用可以生成红棕色的配离子: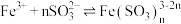 (红棕色)。
(红棕色)。
(7)实验2中,溶液由黄色变为浅绿色的离子方程式为___________ 。
(8)结合速率与平衡的知识,解释实验1颜色变化的原因___________ 。
(9)解释实验2的现象与实验1的现象不同的原因___________ 。

Ⅰ.制备干燥的SO2
(1)制备SO2反应的方程式为
(2)根据上述原理制备收集干燥SO2的实验装置连接顺序为
(3)溶液X中盛放的试剂为
Ⅱ.SO2性质的探究
研究性学校小组将纯净的SO2通100 mL溶液Y中,进行SO2性质的探究。
探究活动1:SO2的氧化性

(4)Y是Na2S溶液,可观察到的现象
探究活动2:SO2的溶解性和酸性
(5)若Y为石蕊溶液,可观察到的现象为
(6)若Y为1 mol/L的NaOH溶液,通入2.24 L SO2(标准状况下),得到的溶液中:
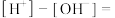
探究活动3:SO2与FeCl3溶液的反应
| 实验 | 溶液Y | 现象 |
| 1 | 1 mol/L FeCl3溶液 | 溶液由黄色变为红棕色,静置,溶液红棕色逐渐消失,1 h后变为浅绿色 |
| 2 | 1 mol/L FeCl3溶液和HCl混合溶液 | 溶液由黄色变为浅绿色 |
 与
与 作用可以生成红棕色的配离子:
作用可以生成红棕色的配离子: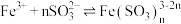 (红棕色)。
(红棕色)。(7)实验2中,溶液由黄色变为浅绿色的离子方程式为
(8)结合速率与平衡的知识,解释实验1颜色变化的原因
(9)解释实验2的现象与实验1的现象不同的原因
您最近一年使用:0次
名校
3 . 乙酸制氢具有重要意义,同时可能发生的反应如下:
热裂解反应: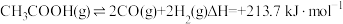
脱羧基反应:
完成下列问题:
(1)乙酸制氢时选择___________ (填“高压”或“常压”)有利于提高转化率。
(2)乙酸制直时温度与气体产率关系如图所示。
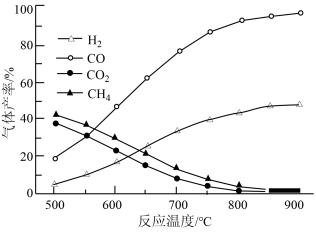
约650℃之前,脱羧基反应活化能低,速率快,故氢气产率低于甲烷;650℃之后氢气产率高于甲烷,理由是随若温度升高,热裂解反应速率加快,且___________ 。
(3)保持其他条件不变,在乙酸气中掺杂一定量水蒸气,氢气产率显著提高而CO的产率下降,请分析原因:___________ 。
热裂解反应:
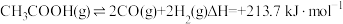
脱羧基反应:

完成下列问题:
(1)乙酸制氢时选择
(2)乙酸制直时温度与气体产率关系如图所示。

约650℃之前,脱羧基反应活化能低,速率快,故氢气产率低于甲烷;650℃之后氢气产率高于甲烷,理由是随若温度升高,热裂解反应速率加快,且
(3)保持其他条件不变,在乙酸气中掺杂一定量水蒸气,氢气产率显著提高而CO的产率下降,请分析原因:
您最近一年使用:0次
名校
4 . 下列化学工业所采取的措施中,能用勒夏特列原理解释的是
| A.接触法制硫酸:温度控制在450℃左右 |
| B.氧化法制硝酸:使用铂铑合金催化氧化氨气 |
| C.石油化工:将分馏得到的重油在高温下裂化 |
| D.合成氨工业:将合成的氨气液化分离,氮气、氢气循环利用 |
您最近一年使用:0次
2022-10-27更新
|
81次组卷
|
3卷引用:上海市建平中学2022-2023学年高三上学期10月月考化学试题
名校
5 . 实验室配制碘水时,通常将I2溶于KI溶液:I2(aq)+I-(aq) I
I (aq)。关于该溶液,下列说法正确的是
(aq)。关于该溶液,下列说法正确的是
 I
I (aq)。关于该溶液,下列说法正确的是
(aq)。关于该溶液,下列说法正确的是| A.滴入淀粉溶液,不变蓝 | B.KI增大了I2的溶解度 |
| C.加少量AgNO3固体平衡正向移动 | D.加水稀释,平衡正向移动 |
您最近一年使用:0次
6 . NO2和N2O4存在平衡: 2NO2(g) N2O4(g)+Q (Q>0)。下列说法正确的是
N2O4(g)+Q (Q>0)。下列说法正确的是
 N2O4(g)+Q (Q>0)。下列说法正确的是
N2O4(g)+Q (Q>0)。下列说法正确的是| A.1 mol平衡混合气体中含1 molN原子 |
| B.恒容时,温度升高,则平衡逆向移动,正反应速率减小 |
| C.恒温时,缩小容器体积,气体颜色变深,这是平衡正向移动导致的 |
| D.若要测定NO2的相对分子质量,应采用“高温低压”条件 |
您最近一年使用:0次
21-22高三下·上海浦东新·阶段练习
名校
解题方法
7 . 在恒温恒容的容器中发生反应X(g)+nY(g)⇌2M(g)+N(?),下列说法正确的是
| A.若n≠1,X,Y的转化率一定不相等 |
| B.转移走部分N,X的转化率一定增大 |
| C.增大压强,X的转化率减小,N一定为气体 |
| D.增加M的量,M的百分含量一定增大 |
您最近一年使用:0次
2022-04-01更新
|
302次组卷
|
3卷引用:上海市华东师范大学第二附属中学2021-2022年高三下学期3月等级考化学试题
(已下线)上海市华东师范大学第二附属中学2021-2022年高三下学期3月等级考化学试题上海市七宝中学2022-2023学年高二下学期期末考试化学试题四川省遂宁市射洪中学校2021-2022学年高二下学期期中考试化学试题
名校
解题方法
8 . 10mL0.1mol•L-1KI溶液与5mL0.1mol•L-1FeCl3溶液发生反应:2Fe3+(aq)+2I-(aq)⇌2Fe2+(aq)+I2(aq),达到平衡。下列说法不正确的是
| A.加入少量氯化钾固体,平衡不移动 |
| B.加适量水稀释,平衡正向移动 |
| C.经过CCl4多次萃取分离后,向水溶液中滴加KSCN溶液,若溶液出现血红色,证明该反应是可逆反应 |
D.该反应的平衡常数K=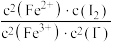 |
您最近一年使用:0次
2022-04-01更新
|
494次组卷
|
12卷引用:上海市华东师范大学第二附属中学2021-2022年高三下学期3月等级考化学试题
(已下线)上海市华东师范大学第二附属中学2021-2022年高三下学期3月等级考化学试题(已下线)浙江省“超级全能生”2021年3月高考选考科目联考化学试题浙江省2021届高三下学期3月联考化学试题(已下线)第21讲 化学平衡状态 化学平衡的移动(精练)-2022年高考化学一轮复习讲练测(已下线)考点18 化学平衡状态 化学平衡移动-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点18 化学平衡状态 化学平衡移动-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题10 化学反应速率与化学平衡-备战2022年高考化学学霸纠错(全国通用)(已下线)考点22 化学平衡状态与化学平衡移动-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第27练 化学平衡-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第21讲 化学平衡状态 化学平衡的移动(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)2019年高考浙江卷化学试题变式题(单选题21-25)课时3影响化学平衡的因素随堂练习
名校
9 . 合成氨反应,达到平衡后,改变下列条件后,对正反应速率影响大于逆反应速率的是
| A.减小生成物浓度 | B.减小压强 |
| C.升高温度 | D.加入催化剂 |
您最近一年使用:0次
2021-12-11更新
|
2015次组卷
|
8卷引用:上海市控江中学2021-2022学年高三上学期12月月考化学试题
10 . 锶(Sr)位于元素周期表的第5周期IIA族。碳酸锶(SrCO3)是制取锶的原料,用天青石固体(主要成分SrSO4,难溶于水)和Na2CO3溶液混合浸泡可制取碳酸锶。完成下列填空:
(1)在上述反应体系中出现的几种短周期元素,原子半径最大的是______ 。非金属性最强的是______ 。
(2)反应体系中出现的非金属元素可形成二硫化碳(CS2),其分子构型是直线型分子,写出该分子的电子式______ ,该分子为______ (选填“极性”、“非极性”)分子。
(3)已知:锶的原子序数为38,某锶原子的质量数为88,写出能包含这些信息的一种化学符号______ 。写出锶原子的最外层电子排布式______ 。下列关于锶及其化合物的叙述中,错误的是______ 。
a.锶的金属性比镁强 b.氢氧化锶呈两性
c.锶在化合物中呈+2价 d.锶在自然界中以游离态存在
(4)请用溶解平衡移动原理解释工业上可以天青石制取碳酸锶的原因______ 。
钡位于元素周期表第六周期IIA族。工业上制备单质钡的原理如下:2Al+4BaO 3Ba↑+BaO+Al2O3。
3Ba↑+BaO+Al2O3。
(5)常温下Al的金属性比Ba的金属性______ (选填“强”“弱”)。利用上述方法可制取Ba的主要原因是______ 。
a.高温时Al的活泼性大于Ba b.高温有利于BaO分解
c.高温时BaO·Al2O3比Al2O3稳定 d.Ba的沸点比Al的低
(1)在上述反应体系中出现的几种短周期元素,原子半径最大的是
(2)反应体系中出现的非金属元素可形成二硫化碳(CS2),其分子构型是直线型分子,写出该分子的电子式
(3)已知:锶的原子序数为38,某锶原子的质量数为88,写出能包含这些信息的一种化学符号
a.锶的金属性比镁强 b.氢氧化锶呈两性
c.锶在化合物中呈+2价 d.锶在自然界中以游离态存在
(4)请用溶解平衡移动原理解释工业上可以天青石制取碳酸锶的原因
钡位于元素周期表第六周期IIA族。工业上制备单质钡的原理如下:2Al+4BaO
 3Ba↑+BaO+Al2O3。
3Ba↑+BaO+Al2O3。(5)常温下Al的金属性比Ba的金属性
a.高温时Al的活泼性大于Ba b.高温有利于BaO分解
c.高温时BaO·Al2O3比Al2O3稳定 d.Ba的沸点比Al的低
您最近一年使用:0次



