名校
1 . 氯化钠应用广泛,下列说法正确的是
A.侯氏制碱法是将足量 通入氨化的氯化钠饱和溶液中,析出 通入氨化的氯化钠饱和溶液中,析出 晶体 晶体 |
| B.氯碱工业采用阴离子交换膜电解槽电解饱和食盐水获得氯气和氢氧化钠 |
| C.用洗净的铂丝蘸取某样品在酒精灯上灼烧,火焰呈黄色,该样品一定是钠盐 |
| D.向饱和氯化钠溶液中滴加浓盐酸能观察到固体析出 |
您最近一年使用:0次
2023-12-16更新
|
225次组卷
|
3卷引用:浙江省诸暨市2024届高三12月适应性考试化学试题
浙江省诸暨市2024届高三12月适应性考试化学试题(已下线)专题02 元素化合物(2大题型)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)浙江省杭州市西湖高级中学2024届高三下学期5月模拟预测化学试题
2 .  是一种重要的盐,其水溶液中存在平衡:
是一种重要的盐,其水溶液中存在平衡: 。下列说法
。下列说法不正确 的是
 是一种重要的盐,其水溶液中存在平衡:
是一种重要的盐,其水溶液中存在平衡: 。下列说法
。下列说法A. 溶液中加入淀粉溶液,溶液显蓝色 溶液中加入淀粉溶液,溶液显蓝色 |
B. 溶液呈棕褐色溶液,加入 溶液呈棕褐色溶液,加入 后,振荡,上层溶液显紫红色 后,振荡,上层溶液显紫红色 |
C. 溶液中滴加少量 溶液中滴加少量 溶液,溶液酸性增强 溶液,溶液酸性增强 |
D.利用 溶液可以除去硫粉中的少量碘单质 溶液可以除去硫粉中的少量碘单质 |
您最近一年使用:0次
名校
解题方法
3 . 丙烯是一种重要的化工原料,在催化剂作用下,可以由丙烷直接脱氢或氧化脱氢制备。
反应Ⅰ(直接脱氢):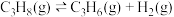

反应Ⅱ(氧化脱氢):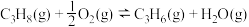

反应Ⅲ(氢气燃烧):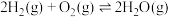
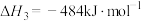
(1)
_____ kJ/mol。
(2)对于反应Ⅰ,总压恒定为100kPa,在密闭容器中通入 和Ar的混合气体。在温度为
和Ar的混合气体。在温度为 时,
时, 的平衡转化率与通入气体中
的平衡转化率与通入气体中 的物质的量分数的关系如图1
的物质的量分数的关系如图1
①结合图1,从平衡移动的角度分析,“通入Ar”的作用是_____ 。
②若要将 的平衡转化率提高到60%,则
的平衡转化率提高到60%,则
_____ 。
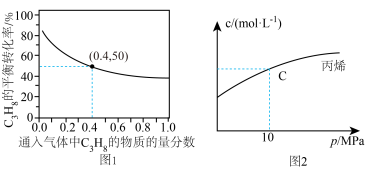
(3)恒温条件下,测得反应Ⅰ平衡时 的物质的量浓度与平衡总压的关系如图2.请在图上画出平衡时
的物质的量浓度与平衡总压的关系如图2.请在图上画出平衡时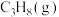 的物质的量浓度随平衡总压变化的曲线
的物质的量浓度随平衡总压变化的曲线_____ 。(在图中C点平衡总压为10Mpa时,丙烷和丙烯的物质的浓度相等)。
(4)①关于反应Ⅲ,下列说法正确的是_____ 。
A.该反应在任何温度下都能自发进行
B.升高温度,反应Ⅱ的平衡常数增大
C.通入的氧气越多,越有利于丙烷的氧化脱氢
D.将水液化分离出来,既可以加快反应速率,又能提高 的转化率
的转化率
②与直接脱氢反应相比,氧化脱氢制备丙烯的优点是_____ 。
(5)研究表明, 可催化氧化
可催化氧化 脱氢制丙烯。在p=0.1MPa,
脱氢制丙烯。在p=0.1MPa, ,催化剂X的催化下,气体按一定流速通过反应器,丙烷转化率和产物选择性(丙烯的选择性=丙烯的产率÷丙烷的转化率×100%)随温度变化如下表:
,催化剂X的催化下,气体按一定流速通过反应器,丙烷转化率和产物选择性(丙烯的选择性=丙烯的产率÷丙烷的转化率×100%)随温度变化如下表:
下列说法不正确的是_____。
反应Ⅰ(直接脱氢):
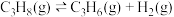

反应Ⅱ(氧化脱氢):
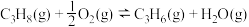

反应Ⅲ(氢气燃烧):
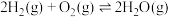
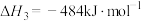
(1)

(2)对于反应Ⅰ,总压恒定为100kPa,在密闭容器中通入
 和Ar的混合气体。在温度为
和Ar的混合气体。在温度为 时,
时, 的平衡转化率与通入气体中
的平衡转化率与通入气体中 的物质的量分数的关系如图1
的物质的量分数的关系如图1①结合图1,从平衡移动的角度分析,“通入Ar”的作用是
②若要将
 的平衡转化率提高到60%,则
的平衡转化率提高到60%,则
(3)恒温条件下,测得反应Ⅰ平衡时
 的物质的量浓度与平衡总压的关系如图2.请在图上画出平衡时
的物质的量浓度与平衡总压的关系如图2.请在图上画出平衡时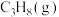 的物质的量浓度随平衡总压变化的曲线
的物质的量浓度随平衡总压变化的曲线(4)①关于反应Ⅲ,下列说法正确的是
A.该反应在任何温度下都能自发进行
B.升高温度,反应Ⅱ的平衡常数增大
C.通入的氧气越多,越有利于丙烷的氧化脱氢
D.将水液化分离出来,既可以加快反应速率,又能提高
 的转化率
的转化率②与直接脱氢反应相比,氧化脱氢制备丙烯的优点是
(5)研究表明,
 可催化氧化
可催化氧化 脱氢制丙烯。在p=0.1MPa,
脱氢制丙烯。在p=0.1MPa, ,催化剂X的催化下,气体按一定流速通过反应器,丙烷转化率和产物选择性(丙烯的选择性=丙烯的产率÷丙烷的转化率×100%)随温度变化如下表:
,催化剂X的催化下,气体按一定流速通过反应器,丙烷转化率和产物选择性(丙烯的选择性=丙烯的产率÷丙烷的转化率×100%)随温度变化如下表:| t℃ | 丙烷转化率 | 产物的选择性 | ||
 |  | CO | ||
| 400 | 4.06 | 93.12 | 2.20 | 4.68 |
| 500 | 12.32 | 91.23 | 3.16 | 5.61 |
| 600 | 35.22 | 85.44 | 7.73 | 6.83 |
| A.在较高温度下,催化剂X可提高产生丙烯反应的速率 |
B. 催化氧化 催化氧化 脱氢制丙烯的反应是放热反应 脱氢制丙烯的反应是放热反应 |
| C.相同条件下,使用不同的催化剂,丙烷的平衡转化率相同 |
| D.温度升高,催化剂X的活性下降,丙烯的产率降低 |
您最近一年使用:0次
2023-12-05更新
|
218次组卷
|
4卷引用:浙江省稽阳联谊学校2023-2024学年高三上学期联考化学试题
浙江省稽阳联谊学校2023-2024学年高三上学期联考化学试题(已下线)专题10 化学反应原理综合题(浙江专用)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)浙江省宁波市2023-2024学年高二上学期九校联考化学试题河南省焦作市博爱县第一中学2023-2024学年高二上学期1月期末化学试题
4 . 某兴趣小组用淀粉水解液和浓 为原料制取草酸晶体
为原料制取草酸晶体 ,进而制备纳米草酸钙
,进而制备纳米草酸钙 ,按如下流程开展了实验(夹持仪器已省略):
,按如下流程开展了实验(夹持仪器已省略):
②纳米草酸钙难溶于水,高温易分解;
③淀粉水解液与混酸反应的方程式: (
( 作催化剂)。
作催化剂)。
请回答:
(1)图1装置中仪器乙的名称___________ 。若C烧杯中盛放足量氢氧化钠溶液,写出C中发生反应的离子方程式___________ (假设气体全部被吸收),除了氢氧化钠溶液,还可以选用___________ (至少写出两种溶液)。
(2)下列有关操作说法不正确 的是___________。
(3)步骤Ⅳ中离心分离后得到的滤液中加入氨水还会析出产品沉淀,请结合离子方程式和平衡移动原理加以解释___________ 。
(4)草酸晶体 含有结晶水,某同学通过如下实验测定其组成:
含有结晶水,某同学通过如下实验测定其组成:
①配制标准氢氧化钠溶液:称取一定质量氢氧化钠固体,用适量水溶解后,选择合适的操作并排序(步骤可重复使用),配制溶液:___________
a→b→(___________)→(___________)→f→d→(___________)→(___________)→h
a.检查容量瓶玻璃塞处是否漏水b.将烧杯中的液体全部转移到容量瓶中
c.用蒸馏水洗涤烧杯和玻璃棒2-3次d.加蒸馏水至容量瓶接近标线
e.盖好瓶塞,反复上下颠倒容量瓶f.轻轻摇动容量瓶
g.离刻度线 时,改用胶头滴管加水至凹液面与刻度线相切h.装瓶贴标签
时,改用胶头滴管加水至凹液面与刻度线相切h.装瓶贴标签
②标定氢氧化钠溶液的浓度。
③滴定:准确称取一定质量草酸晶体于锥形瓶中,用蒸馏水溶解,以酚酞作指示剂,用上述 标准溶液滴定。若草酸晶体中混有
标准溶液滴定。若草酸晶体中混有 ,则该滴定法测得产品中
,则该滴定法测得产品中 的值
的值___________ (填“偏大”“偏小”“无影响”)。
 为原料制取草酸晶体
为原料制取草酸晶体 ,进而制备纳米草酸钙
,进而制备纳米草酸钙 ,按如下流程开展了实验(夹持仪器已省略):
,按如下流程开展了实验(夹持仪器已省略):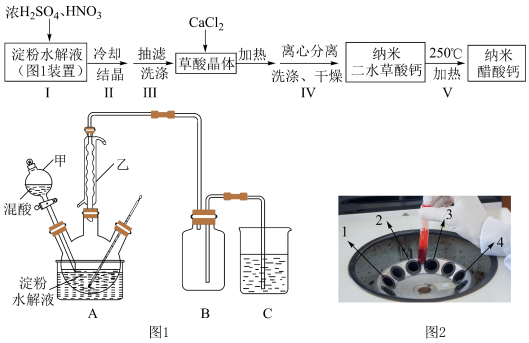
②纳米草酸钙难溶于水,高温易分解;
③淀粉水解液与混酸反应的方程式:
 (
( 作催化剂)。
作催化剂)。请回答:
(1)图1装置中仪器乙的名称
(2)下列有关操作说法
| A.步骤Ⅱ采取冷却结晶,以防止草酸晶体失水 |
| B.步骤Ⅲ洗涤可用乙醇水溶液,步骤IV洗涤可用蒸馏水洗涤 |
C.步骤Ⅴ采用 加热,为提高反应速率,也可采用更高温度加热 加热,为提高反应速率,也可采用更高温度加热 |
| D.步骤Ⅳ采用离心分离,装置如图2所示,操作时应将两支离心管放置于1、4处 |
(3)步骤Ⅳ中离心分离后得到的滤液中加入氨水还会析出产品沉淀,请结合离子方程式和平衡移动原理加以解释
(4)草酸晶体
 含有结晶水,某同学通过如下实验测定其组成:
含有结晶水,某同学通过如下实验测定其组成:①配制标准氢氧化钠溶液:称取一定质量氢氧化钠固体,用适量水溶解后,选择合适的操作并排序(步骤可重复使用),配制溶液:
a→b→(___________)→(___________)→f→d→(___________)→(___________)→h
a.检查容量瓶玻璃塞处是否漏水b.将烧杯中的液体全部转移到容量瓶中
c.用蒸馏水洗涤烧杯和玻璃棒2-3次d.加蒸馏水至容量瓶接近标线
e.盖好瓶塞,反复上下颠倒容量瓶f.轻轻摇动容量瓶
g.离刻度线
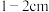 时,改用胶头滴管加水至凹液面与刻度线相切h.装瓶贴标签
时,改用胶头滴管加水至凹液面与刻度线相切h.装瓶贴标签②标定氢氧化钠溶液的浓度。
③滴定:准确称取一定质量草酸晶体于锥形瓶中,用蒸馏水溶解,以酚酞作指示剂,用上述
 标准溶液滴定。若草酸晶体中混有
标准溶液滴定。若草酸晶体中混有 ,则该滴定法测得产品中
,则该滴定法测得产品中 的值
的值
您最近一年使用:0次
2023-10-09更新
|
214次组卷
|
4卷引用:浙江省强基联盟2023-2024学年高三上学期10月联考化学试题
浙江省强基联盟2023-2024学年高三上学期10月联考化学试题浙江强基联盟2023-2024学年第一学期高三年级10月联考 化学(已下线)专题09 化学实验综合题(浙江专用)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)(已下线)T20-实验综合题
解题方法
5 . 某小组设计实验探究铜被碘氧化的产物及铜元素的价态。 易溶于
易溶于 溶液,发生反应
溶液,发生反应 (红棕色);
(红棕色);
②铜元素被氧化可能存在的形式有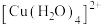 (蓝色)、
(蓝色)、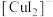 (无色);
(无色);
③ (无色),易被空气氧化。
(无色),易被空气氧化。
请回答:
(1)步骤Ⅰ中加入 萃取分液的目的是
萃取分液的目的是___________ 。
(2)用离子方程式表示步骤Ⅱ中发生的反应___________ 。
(3)已知 为白色不溶于水的固体,向
为白色不溶于水的固体,向 中加入浓
中加入浓 溶液,现象为
溶液,现象为___________ 。
(4)向深蓝色溶液中滴加浓盐酸,溶液呈黄绿色,写出该转化能进行的可能原因___________ 。
(已知: 稳定性远大于
稳定性远大于 (黄色),
(黄色), 稳定指的是不易发生解离反应
稳定指的是不易发生解离反应 )
)
(5) 层呈
层呈___________ 色。如何设计实验将 层中的碘元素分离得到碘单质,请补充完具体实验操作步骤:将
层中的碘元素分离得到碘单质,请补充完具体实验操作步骤:将 层溶液转移入分液漏斗中,加入足量浓氢氧化钠溶液,
层溶液转移入分液漏斗中,加入足量浓氢氧化钠溶液,___________ 。请补充完实验操作中涉及的离子方程式: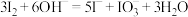 ,
,___________ 。
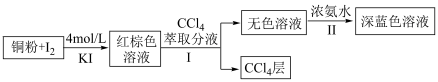
 易溶于
易溶于 溶液,发生反应
溶液,发生反应 (红棕色);
(红棕色);②铜元素被氧化可能存在的形式有
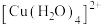 (蓝色)、
(蓝色)、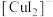 (无色);
(无色);③
 (无色),易被空气氧化。
(无色),易被空气氧化。请回答:
(1)步骤Ⅰ中加入
 萃取分液的目的是
萃取分液的目的是(2)用离子方程式表示步骤Ⅱ中发生的反应
(3)已知
 为白色不溶于水的固体,向
为白色不溶于水的固体,向 中加入浓
中加入浓 溶液,现象为
溶液,现象为(4)向深蓝色溶液中滴加浓盐酸,溶液呈黄绿色,写出该转化能进行的可能原因
(已知:
 稳定性远大于
稳定性远大于 (黄色),
(黄色), 稳定指的是不易发生解离反应
稳定指的是不易发生解离反应 )
)(5)
 层呈
层呈 层中的碘元素分离得到碘单质,请补充完具体实验操作步骤:将
层中的碘元素分离得到碘单质,请补充完具体实验操作步骤:将 层溶液转移入分液漏斗中,加入足量浓氢氧化钠溶液,
层溶液转移入分液漏斗中,加入足量浓氢氧化钠溶液, ,
,
您最近一年使用:0次
2023-10-09更新
|
231次组卷
|
4卷引用:浙江省强基联盟2023-2024学年高三上学期10月联考化学试题
浙江省强基联盟2023-2024学年高三上学期10月联考化学试题浙江强基联盟2023-2024学年第一学期高三年级10月联考 化学(已下线)专题08 工艺流程综合题(浙江专用)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)(已下线)压轴题11 无机化工流程综合分析(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)
名校
解题方法
6 . 下列说法不正确 的是
| A.棉短绒中的纤维素可在铜氨溶液中溶解,将形成的溶液压入酸中可得到质量更高的纤维 |
| B.用纸层析法分离Fe3+和Cu2+,将滤纸上的试样点完全浸入展开剂可提高分离效果 |
| C.实验室制备阿司匹林过程中加入饱和NaHCO3溶液的主要目的是除去水杨酸 |
| D.将CoCl2•6H2O晶体溶于95%乙醇,逐滴滴加蒸馏水,溶液颜色由蓝色逐渐转变为粉红色 |
您最近一年使用:0次
2022-06-25更新
|
1090次组卷
|
3卷引用:浙江省金华市义乌市2022届高三下学期5月适应性考试化学试题
7 . 某物质A由三种常见的元素组成,某兴趣小组进行了如下实验:
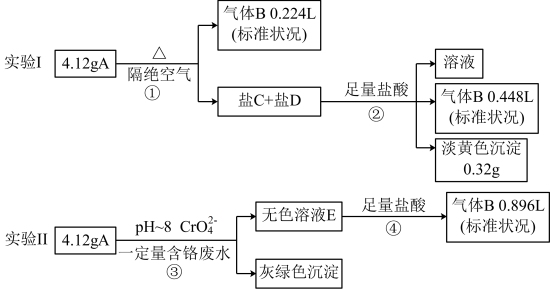
已知:A的摩尔质量在200~300g/mol之间,焰色为紫色;盐C和盐D的组成元素和A相同,①②④处气体体积均在充分加热挥发后经干燥测定。
(1)组成A的元素有_______ ;A的化学式_______ ;
(2)无色溶液E中所有阴离子结合H+的能力由强到弱的顺序_______ ;
(3)一种生产A的方法:在35~45℃下气体B与锌粉—水悬浮液反应生成中间产物;然后加入相应的碱溶液,充分反应,压滤分离得A溶液。写出该过程的总反应方程式_______ ;
(4)A可除去废水(pH~8)中的Cr(VI),且处理后pH变化不大,则反应③的离子方程式_______ ;
(5)设计实验确定溶液E中所含溶质的阴离子_______ ;

已知:A的摩尔质量在200~300g/mol之间,焰色为紫色;盐C和盐D的组成元素和A相同,①②④处气体体积均在充分加热挥发后经干燥测定。
(1)组成A的元素有
(2)无色溶液E中所有阴离子结合H+的能力由强到弱的顺序
(3)一种生产A的方法:在35~45℃下气体B与锌粉—水悬浮液反应生成中间产物;然后加入相应的碱溶液,充分反应,压滤分离得A溶液。写出该过程的总反应方程式
(4)A可除去废水(pH~8)中的Cr(VI),且处理后pH变化不大,则反应③的离子方程式
(5)设计实验确定溶液E中所含溶质的阴离子
您最近一年使用:0次
2021·浙江·模拟预测
名校
解题方法
8 . 10mL0.1mol•L-1KI溶液与5mL0.1mol•L-1FeCl3溶液发生反应:2Fe3+(aq)+2I-(aq)⇌2Fe2+(aq)+I2(aq),达到平衡。下列说法不正确的是
| A.加入少量氯化钾固体,平衡不移动 |
| B.加适量水稀释,平衡正向移动 |
| C.经过CCl4多次萃取分离后,向水溶液中滴加KSCN溶液,若溶液出现血红色,证明该反应是可逆反应 |
D.该反应的平衡常数K=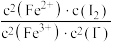 |
您最近一年使用:0次
2022-04-01更新
|
494次组卷
|
12卷引用:浙江省“超级全能生”2021年3月高考选考科目联考化学试题
(已下线)浙江省“超级全能生”2021年3月高考选考科目联考化学试题浙江省2021届高三下学期3月联考化学试题(已下线)考点18 化学平衡状态 化学平衡移动-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)上海市华东师范大学第二附属中学2021-2022年高三下学期3月等级考化学试题(已下线)2019年高考浙江卷化学试题变式题(单选题21-25)(已下线)第21讲 化学平衡状态 化学平衡的移动(精练)-2022年高考化学一轮复习讲练测(已下线)考点18 化学平衡状态 化学平衡移动-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)专题10 化学反应速率与化学平衡-备战2022年高考化学学霸纠错(全国通用)(已下线)考点22 化学平衡状态与化学平衡移动-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第27练 化学平衡-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第21讲 化学平衡状态 化学平衡的移动(练)-2023年高考化学一轮复习讲练测(全国通用)课时3影响化学平衡的因素随堂练习
名校
9 . 1100℃,在恒容密闭容器中加入一定量FeO(s)与CO(g),发生反应 ,一段时间后达到平衡。下列说法
,一段时间后达到平衡。下列说法不正确 的是
 ,一段时间后达到平衡。下列说法
,一段时间后达到平衡。下列说法A.升高温度,若 减小,则 减小,则 |
B.加入一定量CO(g),平衡正向移动, 的体积分数增大 的体积分数增大 |
C.改变浓度使 ,平衡将逆向移动 ,平衡将逆向移动 |
| D.若减小容器体积,平衡不移动 |
您最近一年使用:0次
2022-01-23更新
|
324次组卷
|
6卷引用:浙江省舟山市南海实验高中2021-2022学年高三下学期3月学科素养检测化学试题
名校
10 . 一定温度下,反应MgCl2(l) Mg(l)+Cl2(g)达到平衡时,下列说法
Mg(l)+Cl2(g)达到平衡时,下列说法不正确 的是
 Mg(l)+Cl2(g)达到平衡时,下列说法
Mg(l)+Cl2(g)达到平衡时,下列说法| A.恒容装置中,若Cl2(g)浓度不再改变,则该反应达到平衡状态 |
| B.恒压装置中,若减小装置体积为原来的一半,与原平衡相比,Cl2(g)的浓度不变 |
| C.及时移除反应体系中的Mg(l),可以增大MgCl2(l)的转化率 |
| D.温度升高可以增大MgCl2(l)的转化率 |
您最近一年使用:0次



