含铬化合物在生产生活中有着广泛的用途。利用含铬废液(主要含Cr3+、Cl-、K+、 等)可制备强氧化剂K2Cr2O7。
等)可制备强氧化剂K2Cr2O7。

已知:pH>6.5时Cr(Ⅵ)主要以 的形式存在,pH<6.5时Cr(Ⅵ)主要以
的形式存在,pH<6.5时Cr(Ⅵ)主要以 的形式存在。
的形式存在。
(1)含铬废液中存在Cr3+,该微粒的核外电子排布式为___________ 。
(2)写出调节pH的为12时Cr3+被氧化为Cr(Ⅵ)的离子方程式:___________ 。
(3)加稀硫酸至溶液pH约为1,若“酸化”前不将溶液煮沸,则K2Cr2O7产率明显偏低,原因是___________ 。
(4)利用K2Cr2O7制备Cr2O3。向密闭反应釜中加入1L1mol/L K2Cr2O7溶液,再加入蔗糖(C12H22O11)充分反应生成Cr(OH)3、K2CO3和CO2。焙烧Cr(OH)3得到Cr2O3。理论上需要向反应釜中加入蔗糖的物质的量为___________ 。
(5)利用K2Cr2O7滴定法测定钢渣(主要含有Fe、Fe2O3、FeO及少量惰性杂质)中Fe的含量的方法如下:取钢渣样品0.2500g,加入足量FeCl3溶液充分反应(Fe2O3、FeO及惰性杂质不反应)后过滤,洗涤滤渣。将洗涤液与滤液合并,用0.1000mol/L K2Cr2O7溶液滴定至终点,消耗K2Cr2O7溶液20.00mL。计算钢渣中Fe的质量分数_______ (写出计算过程,结果保留1位小数)。
 等)可制备强氧化剂K2Cr2O7。
等)可制备强氧化剂K2Cr2O7。
已知:pH>6.5时Cr(Ⅵ)主要以
 的形式存在,pH<6.5时Cr(Ⅵ)主要以
的形式存在,pH<6.5时Cr(Ⅵ)主要以 的形式存在。
的形式存在。(1)含铬废液中存在Cr3+,该微粒的核外电子排布式为
(2)写出调节pH的为12时Cr3+被氧化为Cr(Ⅵ)的离子方程式:
(3)加稀硫酸至溶液pH约为1,若“酸化”前不将溶液煮沸,则K2Cr2O7产率明显偏低,原因是
(4)利用K2Cr2O7制备Cr2O3。向密闭反应釜中加入1L1mol/L K2Cr2O7溶液,再加入蔗糖(C12H22O11)充分反应生成Cr(OH)3、K2CO3和CO2。焙烧Cr(OH)3得到Cr2O3。理论上需要向反应釜中加入蔗糖的物质的量为
(5)利用K2Cr2O7滴定法测定钢渣(主要含有Fe、Fe2O3、FeO及少量惰性杂质)中Fe的含量的方法如下:取钢渣样品0.2500g,加入足量FeCl3溶液充分反应(Fe2O3、FeO及惰性杂质不反应)后过滤,洗涤滤渣。将洗涤液与滤液合并,用0.1000mol/L K2Cr2O7溶液滴定至终点,消耗K2Cr2O7溶液20.00mL。计算钢渣中Fe的质量分数
更新时间:2024-04-06 15:42:14
|
相似题推荐
【推荐1】化石能源的脱硫处理是环保热点问题。 用臭氧处理燃煤烟气脱硫的主要反应如下:
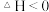 ,向1L反应装置充入
,向1L反应装置充入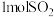 和
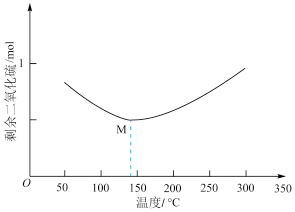
和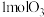 ,经过相同反应时间t后剩余
,经过相同反应时间t后剩余 的物质的量与温度关系如图所示:
的物质的量与温度关系如图所示:
已知臭氧会转化成氧气: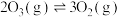 ,在上述反应条件下臭氧分解率与温度关系如下:
,在上述反应条件下臭氧分解率与温度关系如下:
(1)关于脱硫的主要反应,下列说法错误的是______________ 。
A. 50℃时,缩小反应装置的体积可以提高相同时间t内SO2的转化率
B.M点该反应处于平衡状态
C.温度越高,该反应的平衡常数越小
D.随温度的升高,正反应速率变大,逆反应速率减小
(2)200℃以后随着温度升高,SO2的物质的量增多的原因可能是______________________ 。
(3)已知250℃时 的平衡常数
的平衡常数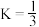 ,求该温度下反应
,求该温度下反应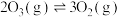 的平衡常数
的平衡常数
__________ 。
(4)其他条件不变,经过相同反应时间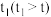 ,在图中画出剩余SO2的物质的量在
,在图中画出剩余SO2的物质的量在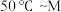 点温度范围内的关系趋势图
点温度范围内的关系趋势图____________ 。
(5)烟气脱硫后续还需用碱液吸收 形成
形成 ,溶液pH为
,溶液pH为 之间时
之间时 在电解池阴极上被还原成连二硫酸根
在电解池阴极上被还原成连二硫酸根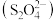 ,写出该电极反应式:
,写出该电极反应式:____________ 。

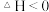 ,向1L反应装置充入
,向1L反应装置充入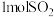 和
和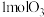 ,经过相同反应时间t后剩余
,经过相同反应时间t后剩余 的物质的量与温度关系如图所示:
的物质的量与温度关系如图所示:
已知臭氧会转化成氧气:
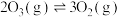 ,在上述反应条件下臭氧分解率与温度关系如下:
,在上述反应条件下臭氧分解率与温度关系如下:温度 | 50 | 100 | 150 | 200 | 250 | 300 |
 分解率 分解率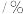 | 0 | 0 | 0 | 4 | 20 | 81 |
A. 50℃时,缩小反应装置的体积可以提高相同时间t内SO2的转化率
B.M点该反应处于平衡状态
C.温度越高,该反应的平衡常数越小
D.随温度的升高,正反应速率变大,逆反应速率减小
(2)200℃以后随着温度升高,SO2的物质的量增多的原因可能是
(3)已知250℃时
 的平衡常数
的平衡常数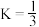 ,求该温度下反应
,求该温度下反应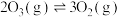 的平衡常数
的平衡常数
(4)其他条件不变,经过相同反应时间
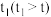 ,在图中画出剩余SO2的物质的量在
,在图中画出剩余SO2的物质的量在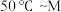 点温度范围内的关系趋势图
点温度范围内的关系趋势图(5)烟气脱硫后续还需用碱液吸收
 形成
形成 ,溶液pH为
,溶液pH为 之间时
之间时 在电解池阴极上被还原成连二硫酸根
在电解池阴极上被还原成连二硫酸根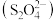 ,写出该电极反应式:
,写出该电极反应式:
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某学习小组探究稀HNO3、浓HNO3与铜的反应。 已知NO2溶于Cu(NO3)2溶液使体系呈绿色。对于稀HNO3与铜生成NO、浓HNO3与铜生成NO2的原因,提出两种解释:
解释1.
(1)HNO3浓度越稀,溶液中NO 的数目越少,被还原时,每个NO
的数目越少,被还原时,每个NO 从还原剂处获得较多电子的机会
从还原剂处获得较多电子的机会_______ (填“增多”或“减少”),因此被还原为更低价态。
解释2.推测下列平衡导致了产物的不同,并通过如下实验证实了推测的合理性。
3NO2+H2O 2HNO3+NO
2HNO3+NO

(2)B中盛放的试剂(足量)是_______ 。
(3)C中盛放Cu(NO3)2和_______ 。
(4)该小组证实推测的合理性所依据的实验现象是_______ 。
解释1.
(1)HNO3浓度越稀,溶液中NO
 的数目越少,被还原时,每个NO
的数目越少,被还原时,每个NO 从还原剂处获得较多电子的机会
从还原剂处获得较多电子的机会解释2.推测下列平衡导致了产物的不同,并通过如下实验证实了推测的合理性。
3NO2+H2O
 2HNO3+NO
2HNO3+NO
(2)B中盛放的试剂(足量)是
(3)C中盛放Cu(NO3)2和
(4)该小组证实推测的合理性所依据的实验现象是
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】回答下列问题
Ⅰ.一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示。

(1)a、b、c三点溶液的pH大小关系:___________ 。
(2)a、b、C三点 的电离程度大小关系:
的电离程度大小关系:___________ 。
(3)a.b、c三点溶液用 NaOH溶液中和,消耗NaOH溶液体积大小关系:
NaOH溶液中和,消耗NaOH溶液体积大小关系:___________ 。
Ⅱ.锌粉与稀硫酸反应产生氢气的体积时间关系如下图所示,选择正确的选项填空。
A.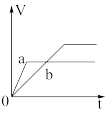 B.
B. 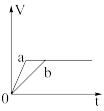 C.
C. 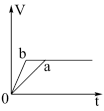 D.
D. 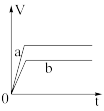
(4)将等质量的两份锌粉a、b分别加入过量的稀硫酸中,同时向a中加入少量的 溶液,产生
溶液,产生 的体积V(L)与时间t(min)的关系是
的体积V(L)与时间t(min)的关系是___________ 。
(5)将过量的两份锌粉a、b分别加入定量的稀硫酸,同时向a中加入少量的 溶液,产生
溶液,产生 的体积V(L)与时间t(min)的关系是
的体积V(L)与时间t(min)的关系是___________ 。
(6)将(5)中的 溶液改成
溶液改成 溶液,其他条件不变,则图象是
溶液,其他条件不变,则图象是___________ 。
Ⅲ.工业废水中常含有一定量的 和
和 ,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种,其中一种是还原沉淀法,该法的工艺流程为:
,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种,其中一种是还原沉淀法,该法的工艺流程为:
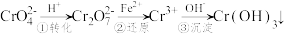
其中第①步存在平衡: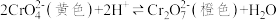
(7)向平衡体系滴加少量浓 ,则溶液显
,则溶液显___________ 色。
(8)能说明第①步反应达平衡状态的是___________ 。
a. 和
和 的浓度相同 b.
的浓度相同 b. c.溶液的颜色不变
c.溶液的颜色不变
(9)第②步中,还原1mol 离子,需要
离子,需要___________ mol的 。
。
Ⅰ.一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示。

(1)a、b、c三点溶液的pH大小关系:
(2)a、b、C三点
 的电离程度大小关系:
的电离程度大小关系:(3)a.b、c三点溶液用
 NaOH溶液中和,消耗NaOH溶液体积大小关系:
NaOH溶液中和,消耗NaOH溶液体积大小关系:Ⅱ.锌粉与稀硫酸反应产生氢气的体积时间关系如下图所示,选择正确的选项填空。
A.
 B.
B.  C.
C.  D.
D. 
(4)将等质量的两份锌粉a、b分别加入过量的稀硫酸中,同时向a中加入少量的
 溶液,产生
溶液,产生 的体积V(L)与时间t(min)的关系是
的体积V(L)与时间t(min)的关系是(5)将过量的两份锌粉a、b分别加入定量的稀硫酸,同时向a中加入少量的
 溶液,产生
溶液,产生 的体积V(L)与时间t(min)的关系是
的体积V(L)与时间t(min)的关系是(6)将(5)中的
 溶液改成
溶液改成 溶液,其他条件不变,则图象是
溶液,其他条件不变,则图象是Ⅲ.工业废水中常含有一定量的
 和
和 ,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种,其中一种是还原沉淀法,该法的工艺流程为:
,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种,其中一种是还原沉淀法,该法的工艺流程为: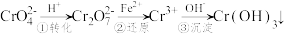
其中第①步存在平衡:
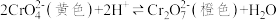
(7)向平衡体系滴加少量浓
 ,则溶液显
,则溶液显(8)能说明第①步反应达平衡状态的是
a.
 和
和 的浓度相同 b.
的浓度相同 b. c.溶液的颜色不变
c.溶液的颜色不变(9)第②步中,还原1mol
 离子,需要
离子,需要 。
。
您最近半年使用:0次
【推荐1】Ⅰ.滴定是一种重要的定量实验方法。
常温下,用0.1000mol/LNaOH溶液分别滴定20.00mL等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如图所示:

(1)滴定盐酸的曲线是图___________ (填“1”或“2”)。
(2)达到B、D状态时,反应消耗的NaOH溶液的体积a___________ b(填“>”“<”或“=”)。
(3)图2中,应选用指示剂为___________
(4)下列操作会使测定结果偏大的是___________(填标号)。
Ⅱ.工业上制取 的生产流程如下:
的生产流程如下:
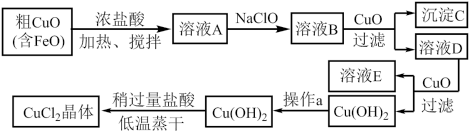
请结合下表数据,回答问题:
(5)在溶液A中加入NaClO的目的是___________ 。
(6)在溶液B中加入CuO的作用是___________ 。
(7)在 中加入盐酸使
中加入盐酸使 转化为
转化为 ,采用稍过量盐酸和低温蒸干的目的是
,采用稍过量盐酸和低温蒸干的目的是___________ 。
常温下,用0.1000mol/LNaOH溶液分别滴定20.00mL等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如图所示:

(1)滴定盐酸的曲线是图
(2)达到B、D状态时,反应消耗的NaOH溶液的体积a
(3)图2中,应选用指示剂为
(4)下列操作会使测定结果偏大的是___________(填标号)。
| A.装待测液的锥形瓶未润洗 |
| B.装标准液的仪器水洗后直接装液 |
| C.滴定过程中,部分标准液滴到锥形瓶外 |
| D.滴定终点读数时俯视刻度线 |
Ⅱ.工业上制取
 的生产流程如下:
的生产流程如下:
请结合下表数据,回答问题:
| 物质 |  |  |  |
| 溶度积(25℃) |  | 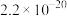 |  |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
(5)在溶液A中加入NaClO的目的是
(6)在溶液B中加入CuO的作用是
(7)在
 中加入盐酸使
中加入盐酸使 转化为
转化为 ,采用稍过量盐酸和低温蒸干的目的是
,采用稍过量盐酸和低温蒸干的目的是
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下。

回答下列问题:
(1)步骤①中得到的氧化产物是___________ 。
(2)步骤②过滤中需要用到的玻璃仪器有___________ 。
(3)步骤③中主要反应的离子方程式为___________ 。
(4)步骤⑤包括用pH=2的酸洗、水洗两步操作,其中酸洗采用的试剂是___________ (写名称)。
(5)上述工艺中,步骤⑥醇洗的目的是___________ 。
(6)准确称取所制备的CuCl样品m g,将其置于过量的 溶液中,待样品完全溶解后,加入适量稀硫酸,用a mol/L的
溶液中,待样品完全溶解后,加入适量稀硫酸,用a mol/L的 溶液滴定到终点,消耗
溶液滴定到终点,消耗 溶液b mL,反应中
溶液b mL,反应中 被还原为
被还原为 。
。
①用 溶液滴定时发生反应的离子方程式为
溶液滴定时发生反应的离子方程式为___________ 。
②样品中CuCl的质量分数为___________ 。
③若滴定至终点时,仰视读数,则测定的结果___________ (填“偏高”、“偏低”、“无影响”)。

回答下列问题:
(1)步骤①中得到的氧化产物是
(2)步骤②过滤中需要用到的玻璃仪器有
(3)步骤③中主要反应的离子方程式为
(4)步骤⑤包括用pH=2的酸洗、水洗两步操作,其中酸洗采用的试剂是
(5)上述工艺中,步骤⑥醇洗的目的是
(6)准确称取所制备的CuCl样品m g,将其置于过量的
 溶液中,待样品完全溶解后,加入适量稀硫酸,用a mol/L的
溶液中,待样品完全溶解后,加入适量稀硫酸,用a mol/L的 溶液滴定到终点,消耗
溶液滴定到终点,消耗 溶液b mL,反应中
溶液b mL,反应中 被还原为
被还原为 。
。①用
 溶液滴定时发生反应的离子方程式为
溶液滴定时发生反应的离子方程式为②样品中CuCl的质量分数为
③若滴定至终点时,仰视读数,则测定的结果
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】甲、乙、丙三位同学分别进行“Na2CO3和NaCl混合物中Na2CO3质量分数测定”的实验:
(1)甲同学实验的主要步骤有:①过滤②加入足量的CaCl2溶液③将沉淀小心烘干、称量,测得固体质量为ng④称取mg样品溶于适量蒸馏水⑤洗涤沉淀2-3次。该同学正确的操作步骤为_______ (填序号);混合物中碳酸钠的质量分数为_______ (只需列出计算式)。
(2)乙同学把一定量的混合物与足量盐酸反应,然后用如图所示装置测定产生的气体体积。实验室中只有如下试剂:样品、6mol/L盐酸、Na2CO3溶液、CaCl2溶液、饱和NaHCO3溶液。

回答下列问题:
①广口瓶中盛放的溶液是_______ 。
②该装置测定的气体体积往往不准确(不考虑导管中水的体积),理由是_______ 。
(3)丙同学准确称取wg固体混合物放入锥形瓶中,加入V1mL。0.1000mol/L盐酸,充分反应,用0.1000mol/L的氢氧化钠溶液滴定过量盐酸,消耗氢氧化钠溶液V2mL。请回答下列问题:
①实验室现有1.000mol/L的盐酸。为了精确配制100mL0.1000mol/L的盐酸,需要的仪器有:烧杯、100mL容量瓶、玻璃棒、_______ 。
②滴定时选择。_______ 作指示剂,滴定终点溶液的颜色变化为_______ 。
③混合物中碳酸钠的质量分数为_______ (只需列出计算式)。
(1)甲同学实验的主要步骤有:①过滤②加入足量的CaCl2溶液③将沉淀小心烘干、称量,测得固体质量为ng④称取mg样品溶于适量蒸馏水⑤洗涤沉淀2-3次。该同学正确的操作步骤为
(2)乙同学把一定量的混合物与足量盐酸反应,然后用如图所示装置测定产生的气体体积。实验室中只有如下试剂:样品、6mol/L盐酸、Na2CO3溶液、CaCl2溶液、饱和NaHCO3溶液。

回答下列问题:
①广口瓶中盛放的溶液是
②该装置测定的气体体积往往不准确(不考虑导管中水的体积),理由是
(3)丙同学准确称取wg固体混合物放入锥形瓶中,加入V1mL。0.1000mol/L盐酸,充分反应,用0.1000mol/L的氢氧化钠溶液滴定过量盐酸,消耗氢氧化钠溶液V2mL。请回答下列问题:
①实验室现有1.000mol/L的盐酸。为了精确配制100mL0.1000mol/L的盐酸,需要的仪器有:烧杯、100mL容量瓶、玻璃棒、
②滴定时选择。
③混合物中碳酸钠的质量分数为
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】铁铬废泥是FeCl3蚀刻废液经还原、碱沉淀后产生的固体废泥(铁质量分数约为15%,铬质量分数约为2%,不溶物含量为5%~10%,含水率为40%~50%),可用酸洗废液(所含酸主要是盐酸)酸溶后,再经过下列方式处理获得FeCl3和PbCrO4两种产品,变废为宝。
Ⅱ.几种金属离子开始沉淀和完全沉淀的pH如表所示:
回答下列问题:
(1)基态Cr原子的价层电子排布式为________ 。
(2)铁铬废泥中铁元素和铬元素的存在形式是________ (填化学式)。
(3)用酸洗废液酸溶时,反应温度为65℃,此时铁铬废泥的浸出效果较佳。但实际生产中,只需要将溶液预热到60℃左右即可,原因是________________ 。
(4)加入Ca(OH)2时,应调节的pH范围为________ 。
(5)试剂A的最佳选择是________ (填字母)。
a.酸性KMnO4溶液 b.HNO3 c.Cl2
(6)绿色溶液转化为黄色溶液过程的离子方程式是________________ 。
(7)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶;用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液;充分反应后,滴入淀粉指示剂并用cmol·L-1Na2S2O3溶液滴定用去VmL。样品中氯化铁的质量分数为________ (用字母m、c、V来表示)。已知:I2+2 =2I-+
=2I-+ 。
。
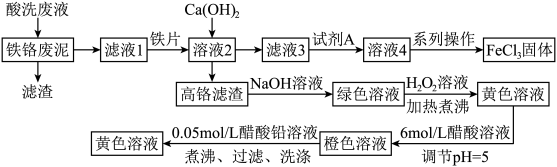
| 物质 | Cr(OH)3 |  |  |  | PbCrO4 |
| 颜色状态 | 绿色沉淀 | 绿色溶液 | 黄色溶液 | 橙色溶液 | 黄色沉淀 |
| 金属离子 | Fe3+ | Fe2+ | Cr3+ |
| 开始沉淀的pH | 2.3 | 7.6 | 4.5 |
| 完全沉淀的pH | 3.3 | 9.1 | 5.6 |
(1)基态Cr原子的价层电子排布式为
(2)铁铬废泥中铁元素和铬元素的存在形式是
(3)用酸洗废液酸溶时,反应温度为65℃,此时铁铬废泥的浸出效果较佳。但实际生产中,只需要将溶液预热到60℃左右即可,原因是
(4)加入Ca(OH)2时,应调节的pH范围为
(5)试剂A的最佳选择是
a.酸性KMnO4溶液 b.HNO3 c.Cl2
(6)绿色溶液转化为黄色溶液过程的离子方程式是
(7)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶;用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液;充分反应后,滴入淀粉指示剂并用cmol·L-1Na2S2O3溶液滴定用去VmL。样品中氯化铁的质量分数为
 =2I-+
=2I-+ 。
。
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、 D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是______ (填元素符号),其中C原子的核外电子排布式为__________ ,A元素在元素周期表中的位置是__________ ,B原子的结构示意图为__________ ,A、B、C、D四种元素的离子半径从大到小的顺序是__________ (用离子符号表示)。
(2)单质A有两种同素异形体,其中沸点高的是_____ (填分子式),原因是_______ ;A和B的氢化物所属的晶体类型分别为______ 和______ 。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为___ ,中心原子的杂化轨道类型为___ 。
(4)化合物D2A的立体构型为___ ,中心原子的价层电子对数为______
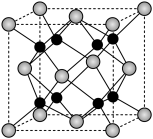
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm, F的化学式为_____ :晶胞中A 原子的配位数为______ ;列出晶体F的密度(g.cm-3)计算式_____ 。
(1)四种元素中电负性最大的是
(2)单质A有两种同素异形体,其中沸点高的是
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为
(4)化合物D2A的立体构型为
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm, F的化学式为

您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】硅烷广泛应用在现代高科技领域。制备硅烷的反应为 。
。
(1)①基态硅原子的价层电子轨道表示式为_______ 。
② 中,硅的化合价为+4价。硅显正化合价的原因是
中,硅的化合价为+4价。硅显正化合价的原因是_______ 。
③下列说法正确的是_______ (填序号)。
a. 的热稳定性比
的热稳定性比 的差
的差
b. 中4个
中4个 的键长相同,
的键长相同, 的键角为
的键角为
c. 中硅原子以4个
中硅原子以4个 杂化轨道分别与4个氢原子的
杂化轨道分别与4个氢原子的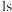 轨道重叠,形成4个
轨道重叠,形成4个
 键
键
④ 的沸点(
的沸点(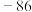 ℃)高于
℃)高于 的沸点(
的沸点( ℃),原因是
℃),原因是_______ 。
(2) 的晶胞结构如图所示,晶胞的体积为
的晶胞结构如图所示,晶胞的体积为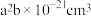 。
。
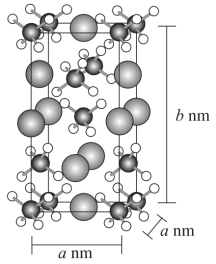
① 的VSEPR模型名称为
的VSEPR模型名称为_______ 。
②用 表示阿伏加德罗常数的值。
表示阿伏加德罗常数的值。 晶体密度为
晶体密度为_______  (用含a、b、
(用含a、b、 的代数式表示)。
的代数式表示)。
③ 是一种具有应用潜能的储氢材料,其释氢过程可用化学方程式表示为:
是一种具有应用潜能的储氢材料,其释氢过程可用化学方程式表示为: 。掺杂
。掺杂 替换晶体中部分
替换晶体中部分 ,更利于
,更利于 中H的解离,使体系更容易释放氢。从结构的角度推测其可能原因:
中H的解离,使体系更容易释放氢。从结构的角度推测其可能原因:_______ 。
 。
。(1)①基态硅原子的价层电子轨道表示式为
②
 中,硅的化合价为+4价。硅显正化合价的原因是
中,硅的化合价为+4价。硅显正化合价的原因是③下列说法正确的是
a.
 的热稳定性比
的热稳定性比 的差
的差b.
 中4个
中4个 的键长相同,
的键长相同, 的键角为
的键角为
c.
 中硅原子以4个
中硅原子以4个 杂化轨道分别与4个氢原子的
杂化轨道分别与4个氢原子的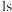 轨道重叠,形成4个
轨道重叠,形成4个
 键
键④
 的沸点(
的沸点(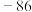 ℃)高于
℃)高于 的沸点(
的沸点( ℃),原因是
℃),原因是(2)
 的晶胞结构如图所示,晶胞的体积为
的晶胞结构如图所示,晶胞的体积为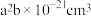 。
。
①
 的VSEPR模型名称为
的VSEPR模型名称为②用
 表示阿伏加德罗常数的值。
表示阿伏加德罗常数的值。 晶体密度为
晶体密度为 (用含a、b、
(用含a、b、 的代数式表示)。
的代数式表示)。③
 是一种具有应用潜能的储氢材料,其释氢过程可用化学方程式表示为:
是一种具有应用潜能的储氢材料,其释氢过程可用化学方程式表示为: 。掺杂
。掺杂 替换晶体中部分
替换晶体中部分 ,更利于
,更利于 中H的解离,使体系更容易释放氢。从结构的角度推测其可能原因:
中H的解离,使体系更容易释放氢。从结构的角度推测其可能原因:
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】工业废水任意排放,会造成环境污染。“协同去污,变废为宝”,为处理工业废水提供了新思路。电镀厂产生大量含 、
、 的电镀废液,皮革厂产生大量含
的电镀废液,皮革厂产生大量含 的废液。两厂联合处理废水,回收Cu并生产铁红和媒染剂
的废液。两厂联合处理废水,回收Cu并生产铁红和媒染剂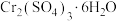 ,工艺流程如图:
,工艺流程如图:
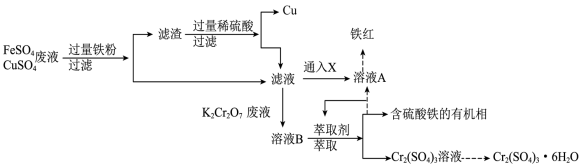
(1) 中Cr元素的化合价为
中Cr元素的化合价为__________ 。
(2)该工艺中多次用到过滤,过滤时需要的玻璃仪器除烧杯外还有__________ ,__________ 。
(3)滤液可以通入或加入X经一步转化为溶液A,X可以是下列选项中的哪些物质__________
A. B.
B. C.
C. D.
D. E.
E.
证明滤液中只含有 而不含
而不含 的实验方法是
的实验方法是__________ 。
(4)滤液与含 的废液反应的离子方程式为
的废液反应的离子方程式为__________ 。
(5)从 溶液制取
溶液制取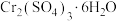 晶体的实验操作方法为
晶体的实验操作方法为__________ 、__________ 、过滤、洗涤、干燥。
(6)已知 化学性质与
化学性质与 类似,选择合适的化学试剂,先将流程中的
类似,选择合适的化学试剂,先将流程中的 溶液转化为氢氧化铬,再转化成可用于陶瓷和搪瓷的着色剂
溶液转化为氢氧化铬,再转化成可用于陶瓷和搪瓷的着色剂 。转化过程中发生的主要的方程式为:
。转化过程中发生的主要的方程式为:
离子方程式①__________ 化学方程式②__________ 。
 、
、 的电镀废液,皮革厂产生大量含
的电镀废液,皮革厂产生大量含 的废液。两厂联合处理废水,回收Cu并生产铁红和媒染剂
的废液。两厂联合处理废水,回收Cu并生产铁红和媒染剂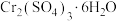 ,工艺流程如图:
,工艺流程如图:
(1)
 中Cr元素的化合价为
中Cr元素的化合价为(2)该工艺中多次用到过滤,过滤时需要的玻璃仪器除烧杯外还有
(3)滤液可以通入或加入X经一步转化为溶液A,X可以是下列选项中的哪些物质
A.
 B.
B. C.
C. D.
D. E.
E.
证明滤液中只含有
 而不含
而不含 的实验方法是
的实验方法是(4)滤液与含
 的废液反应的离子方程式为
的废液反应的离子方程式为(5)从
 溶液制取
溶液制取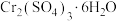 晶体的实验操作方法为
晶体的实验操作方法为(6)已知
 化学性质与
化学性质与 类似,选择合适的化学试剂,先将流程中的
类似,选择合适的化学试剂,先将流程中的 溶液转化为氢氧化铬,再转化成可用于陶瓷和搪瓷的着色剂
溶液转化为氢氧化铬,再转化成可用于陶瓷和搪瓷的着色剂 。转化过程中发生的主要的方程式为:
。转化过程中发生的主要的方程式为:离子方程式①
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
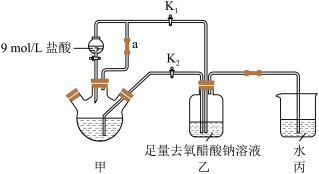
【推荐2】醋酸亚铬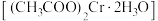 为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬.实验装置如图所示,回答下列问题:
为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬.实验装置如图所示,回答下列问题:

(1)仪器a的名称为____________________________ 。
(2)d中析出砖红色沉淀.为使沉淀充分析出并分离,需采用的操作是___________ 、___________ 、洗涤、干燥。
(3)Cr2+也可用锌粒还原K2Cr2O7制备,写出反应的离子方程式___________ 。
(4)该实验中盐酸必须适量,不能过量的原因___________ 。
(5)该制备实验能否成功的关键是排除O2的干扰,下列关于O2的存在及如何消除O2对制备的影响均正确的是___________(填编号)。
(6)某实验小组设计如下改进装置制备醋酸亚铬晶体,改进后的优点是(答一点即可)___________________________ 。
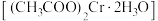 为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬.实验装置如图所示,回答下列问题:
为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬.实验装置如图所示,回答下列问题:
(1)仪器a的名称为
(2)d中析出砖红色沉淀.为使沉淀充分析出并分离,需采用的操作是
(3)Cr2+也可用锌粒还原K2Cr2O7制备,写出反应的离子方程式
(4)该实验中盐酸必须适量,不能过量的原因
(5)该制备实验能否成功的关键是排除O2的干扰,下列关于O2的存在及如何消除O2对制备的影响均正确的是___________(填编号)。
编号 | 使溶液中含O2的因素 | 消除O2的方法 |
A | 溶液中溶解的O2 | 配制溶液所使用的蒸馏水煮沸后在空气中自然冷却 |
B | 装置中的空气含有O2 | 利用生成的氢气将装置中的空气排尽 |
C | 外界空气进入制备装置 | 在装置d中加入一些四氯化碳 |
D | 外界空气进入制备装置 | 将装置d用下列装置替换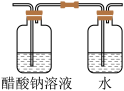 |
| A.A | B.B | C.C | D.D |
(6)某实验小组设计如下改进装置制备醋酸亚铬晶体,改进后的优点是(答一点即可)

您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】三氯化铬(CrCl3)为紫色单斜晶体,熔点为83℃,易潮解,易升华,能溶于水但不易水解,高温下能被氧气氧化,工业上主要用作媒染剂和催化剂。
(1)某化学小组用Cr2O3和CCl4在高温下制备无水三氯化铬,部分实验装置如图所示,其中锥形瓶内装有CCl4,其沸点为76.8℃。
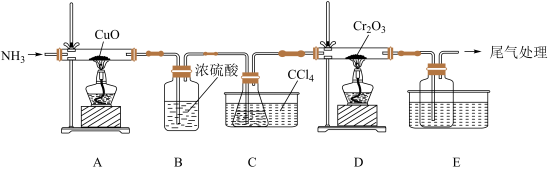
实验前先加热装置A,产生气体的化学方程式:___________ ,实验过程中需持续产生该气体,该气体的作用为___________ 。
(2)三价铬离子能形成多种配位化合物,配合物[Cr(NH3)3(H2O)2Cl]2+中元素电负性由大到小的顺序___________ 。
(3)装置D中还会生成光气(COCl2),D中反应的化学方程式为___________ 。
(4)该实验装置有设计不合理的地方,请写出改进方法:___________ (写一点即可)
(5)为进一步探究CrCl3的性质,某同学取试管若干支,分别加入10滴0.1 mol∙L−1 CrCl3溶液,并用4滴2 mol∙L−1 H2SO4酸化,再分别加入不同滴数的0.1 mol∙L−1KMnO4溶液,并在不同的温度下进行实验,反应现象记录于表中。
①浓度对反应的影响
CrCl3与KMnO4在常温下反应,观察不到Cr2O 离子的橙色,甲同学认为其中一个原因是Cr2O
离子的橙色,甲同学认为其中一个原因是Cr2O 离子的橙色被MnO
离子的橙色被MnO 离子的紫红色掩盖,另一种可能的原因是
离子的紫红色掩盖,另一种可能的原因是___________ ,所以必须将反应液加热至沸腾 后,才能观察到反应液由紫红色逐渐变为橙黄色的实验现象。
后,才能观察到反应液由紫红色逐渐变为橙黄色的实验现象。
②CrCl3与KMnO4的用量对反应的影响
对表中数据进行分析,在上述反应条件下,欲将Cr3+氧化为Cr2O ,CrCl3与KMnO4最佳用量比为
,CrCl3与KMnO4最佳用量比为___________ 。这与由反应10Cr3+ + 6MnO + 11H2O
+ 11H2O Cr2O
Cr2O + 6Mn2+ + 22H+ 所推断得到的用量比不符,你推测的原因是
+ 6Mn2+ + 22H+ 所推断得到的用量比不符,你推测的原因是___________ 。
(1)某化学小组用Cr2O3和CCl4在高温下制备无水三氯化铬,部分实验装置如图所示,其中锥形瓶内装有CCl4,其沸点为76.8℃。

实验前先加热装置A,产生气体的化学方程式:
(2)三价铬离子能形成多种配位化合物,配合物[Cr(NH3)3(H2O)2Cl]2+中元素电负性由大到小的顺序
(3)装置D中还会生成光气(COCl2),D中反应的化学方程式为
(4)该实验装置有设计不合理的地方,请写出改进方法:
(5)为进一步探究CrCl3的性质,某同学取试管若干支,分别加入10滴0.1 mol∙L−1 CrCl3溶液,并用4滴2 mol∙L−1 H2SO4酸化,再分别加入不同滴数的0.1 mol∙L−1KMnO4溶液,并在不同的温度下进行实验,反应现象记录于表中。
| KMnO4的用量 (滴数) | 在不同温度下的反应现象 | |
| 25℃ | 90~100℃ | |
| 1 | 紫红色 | 蓝绿色溶液 |
| 2~9 | 紫红色 | 黄绿色溶液,且随KMnO4滴数增加,黄色成分增多 |
| 10 | 紫红色 | 澄清的橙黄色溶液 |
| 11~23 | 紫红色 | 橙黄色溶液,有棕褐色沉淀,且随KMnO4滴数增加,沉淀增多 |
| 24~25 | 紫红色 | 紫红色溶液,有较多的棕褐色沉淀 |
CrCl3与KMnO4在常温下反应,观察不到Cr2O
 离子的橙色,甲同学认为其中一个原因是Cr2O
离子的橙色,甲同学认为其中一个原因是Cr2O 离子的橙色被MnO
离子的橙色被MnO 离子的紫红色掩盖,另一种可能的原因是
离子的紫红色掩盖,另一种可能的原因是 后,才能观察到反应液由紫红色逐渐变为橙黄色的实验现象。
后,才能观察到反应液由紫红色逐渐变为橙黄色的实验现象。②CrCl3与KMnO4的用量对反应的影响
对表中数据进行分析,在上述反应条件下,欲将Cr3+氧化为Cr2O
 ,CrCl3与KMnO4最佳用量比为
,CrCl3与KMnO4最佳用量比为 + 11H2O
+ 11H2O Cr2O
Cr2O + 6Mn2+ + 22H+ 所推断得到的用量比不符,你推测的原因是
+ 6Mn2+ + 22H+ 所推断得到的用量比不符,你推测的原因是
您最近半年使用:0次



