1 . 由实验操作和现象,可得出相应正确结论的是
| 实验操作 | 现象 | 结论 | |
| A | 向溴水中加入苯,振荡后静置 | 水层颜色变浅 | 溴与苯发生了加成反应 |
| B | 向蔗糖溶液中滴加稀硫酸,水浴加热,加入少量新制的 悬浊液 悬浊液 | 无砖红色沉淀 | 蔗糖未发生水解 |
| C | 向 溶液中缓慢滴加硫酸 溶液中缓慢滴加硫酸 | 黄色变为橙红色 | 增大氢离子浓度,转化平衡向生成 的方向移动 的方向移动 |
| D | 加热试管中的聚氯乙烯薄膜碎片 | 试管口润湿的蓝色石蕊试纸变红 | 氯乙烯加聚是可逆反应 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
解题方法
2 . 设 是阿伏加德罗常数的值,下列说法错误的是
是阿伏加德罗常数的值,下列说法错误的是
 是阿伏加德罗常数的值,下列说法错误的是
是阿伏加德罗常数的值,下列说法错误的是A.标准状况下,33.6 L HF中含有氟原子的数目为1.5 |
B.1 L   溶液中 溶液中 的数目小于0.1 的数目小于0.1 |
C.0.1 mol乙烯和乙醇的混合物完全燃烧消耗 的数目为0.3 的数目为0.3 |
D.电解精炼铜,当电路中通过 个电子时,阳极质量减少32 g 个电子时,阳极质量减少32 g |
您最近半年使用:0次
解题方法
3 . 下列方案设计、现象和结论都正确的是
| 方案设计 | 现象 | 结论 | |
| A | 在4mL0.1mol·L-1K2Cr2O7溶液中加入数滴1mol·L-1NaOH溶液 | 溶液由橙色变为黄色 | 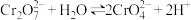 正移 正移 |
| B | 两支试管中均装有2mL0.01mol·L-1酸性KMnO4溶液,向第一支加入1mL0.01mol·L-1草酸溶液和1mL水,第二支加入2mL0.01mol·L-1草酸溶液 | 第一支试管褪色时间比第二支试管长 | 其他条件相同时,反应物浓度越大,反应速率越快 |
| C | 取少量Fe粉与HNO3反应后的溶液于试管中,依次加入H2SO4和Fe粉 | 有色气体产生 | HNO3过量 |
| D | 往2支试管中各加入1mL乙酸乙酯,再分别加入等体积等浓度的稀硫酸和NaOH溶液 | NaOH溶液中酯层消失的快 | 碱的催化效果比酸的催化效果好 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2022高二上·安徽阜阳·竞赛
解题方法
4 . 傲娇,来源日本ACGN的一个词语,指人物为了掩饰害羞腼腆而做出态度强硬高傲表里不一言行的代名词,常用来形容平常说话带刺,态度强硬高傲,但在一定的条件下害臊地黏腻在身边的人物。在化学中也有这样的原理,那就是勒夏特列原理。勒夏特列对于可逆反应平衡的移动总结出的规则在后人的二次总结下总结成了一条:平衡总是朝着能减小外界条件改变对其产生的影响的方向移动。已知相同条件下,每个产物浓度系数次幂的连乘积与每个反应物浓度系数次幂的连乘积之比是个常数。
初中的时候,我们学到的无机基本反应类型共4种:化合反应、分解反应、置换反应和复分解反应。其中,复分解反应发生的条件是:产物中必须存在沉淀、气体或H2O,那么,按照我们初中的知识,有两种物质在水溶液中混合后应该不反应,他们是我们平时吃的食盐A和波尔多液制备中属于盐的物质B。
可是,他们混合后真的不发生反应吗?
让我们来试验一下:
实验I:分别取25mL饱和A溶液与饱和B溶液,倒入小烧杯中,观察到溶液最终呈绿色;经过笔式酸度计测量可知,在此条件下测得酸度计在饱和A溶液溶液中的示数为7.01,在饱和B溶液中的示数为3.22,而在混合溶液中的示数为3.07。
实验II:将实验I中所得溶液均匀分成2份,分别标记成a、b两组,a组放入冰水中,而b组仍保存在小烧杯中。将小烧杯放在加热器上加热,一段时间后观察到a组溶液从绿色变成蓝色,b组溶液绿色加深。
实验III:向两个洁净的试管中分别加入等浓度的Cu(NO3)2溶液和CuCl2溶液,使用同一热源均匀加热,观察到加入CuCl2溶液的试管内溶液绿色逐渐加深。
下列说法正确的是
初中的时候,我们学到的无机基本反应类型共4种:化合反应、分解反应、置换反应和复分解反应。其中,复分解反应发生的条件是:产物中必须存在沉淀、气体或H2O,那么,按照我们初中的知识,有两种物质在水溶液中混合后应该不反应,他们是我们平时吃的食盐A和波尔多液制备中属于盐的物质B。
可是,他们混合后真的不发生反应吗?
让我们来试验一下:
实验I:分别取25mL饱和A溶液与饱和B溶液,倒入小烧杯中,观察到溶液最终呈绿色;经过笔式酸度计测量可知,在此条件下测得酸度计在饱和A溶液溶液中的示数为7.01,在饱和B溶液中的示数为3.22,而在混合溶液中的示数为3.07。
实验II:将实验I中所得溶液均匀分成2份,分别标记成a、b两组,a组放入冰水中,而b组仍保存在小烧杯中。将小烧杯放在加热器上加热,一段时间后观察到a组溶液从绿色变成蓝色,b组溶液绿色加深。
实验III:向两个洁净的试管中分别加入等浓度的Cu(NO3)2溶液和CuCl2溶液,使用同一热源均匀加热,观察到加入CuCl2溶液的试管内溶液绿色逐渐加深。
下列说法正确的是
| A.由实验I可知,A和B能够发生复分解反应。 |
| B.由实验II可知,从蓝色向绿色的转化可逆,且此反应是吸热反应。 |
| C.由实验III可知,反应中影响颜色的因素中有Cl-和Cu2+在溶液中的浓度。 |
| D.若已知铜盐水溶液中Cu元素以[Cu (H2O)4]2+存在,且反应后溶液中没有新离子产生,可推测产物为[CuCl4]2-和H2O。 |
您最近半年使用:0次
名校
5 . 相同温度和压强下,研究Cl2在不同溶液中的溶解度(用溶解Cl2的物质的量浓度表示)随溶液浓度的变化。在NaCl溶液和盐酸中Cl2的溶解度以及各种含氯微粒的浓度变化如图。
下列说法正确的是

下列说法正确的是
| A.由图1可知,Cl-的存在对Cl2的溶解只起到抑制作用 |
B.随NaCl溶液浓度增大,Cl2+H2O H++C1-+HC1O平衡正移,Cl2溶解度减小 H++C1-+HC1O平衡正移,Cl2溶解度减小 |
C.随盐酸浓度增加,Cl2与H2O的反应被抑制,生成 为主要反应从而促进Cl2溶解 为主要反应从而促进Cl2溶解 |
| D.由图2变化趋势可推测氯气在稀硫酸中溶解度大于在水中的溶解度 |
您最近半年使用:0次
2022-09-06更新
|
354次组卷
|
2卷引用:浙江省宁波市2021-2022学年上学期普通高二化学竞赛试题
6 . 某密闭容器中放入一定量的NO2,发生反应2NO2(g)⇌N2O4(g)+Q,在达平衡后,若分别单独改变下列条件,重新达到平衡后,能使平衡混合气体平均相对分子质量减小的是
| A.通入N2 | B.通入NO2 | C.通入N2O4 | D.降低温度 |
您最近半年使用:0次
7 . 常温下,在饱和氯水中,化学反应为:Cl2+H2O⇌HCl+HClO。下列说法正确的是
| A.当溶液pH不变时,该反应一定达到平衡状态 |
| B.向该溶液中加水,平衡向正反应移动,K一定增大 |
| C.向该溶液中通入Cl2,平衡一定向正反应方向移动 |
| D.光照条件下HCl浓度增大,平衡一定向逆反应方向移动 |
您最近半年使用:0次
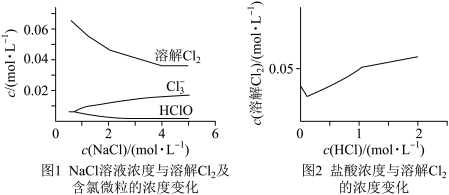
8 . 醛(Ar-C=O)和胺(R-NH2)可发生如下的反应生成席夫碱(Ar-C=N-R):Ar-C=O + H2N-R Ar-C= N-R + H2O。请回答下列问题:
Ar-C= N-R + H2O。请回答下列问题:
(1)要保证反应顺利进行,可采取的措施有__________________ 。
(2)下式表示在金属离子(M2+) 存在或不存在情况下邻氨基苯甲醛的反应,产物中金属离子和N之间的键型是_____________ ,金属离子所起的作用是_________ 。
(3)写出以下反应的产物
 + CH3CHO→
+ CH3CHO→ _________ 。
(4)描述以下反应产物的特点,并写出能生成与产物A具有类似结构的一组反应物__________ 。
 +
+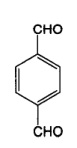 →产物A+H2O
→产物A+H2O
 Ar-C= N-R + H2O。请回答下列问题:
Ar-C= N-R + H2O。请回答下列问题:(1)要保证反应顺利进行,可采取的措施有
(2)下式表示在金属离子(M2+) 存在或不存在情况下邻氨基苯甲醛的反应,产物中金属离子和N之间的键型是

(3)写出以下反应的产物
 + CH3CHO→
+ CH3CHO→ (4)描述以下反应产物的特点,并写出能生成与产物A具有类似结构的一组反应物
 +
+ →产物A+H2O
→产物A+H2O
您最近半年使用:0次
9 . 对手由CrO 转化为Cr2O
转化为Cr2O 的下列各叙述中,正确的是
的下列各叙述中,正确的是
 转化为Cr2O
转化为Cr2O 的下列各叙述中,正确的是
的下列各叙述中,正确的是| A.这是Lewis酸碱反应 | B.这是氧化还原反应 |
| C.加酸,该反应向右移动 | D.加酸,该反应向左移动 |
您最近半年使用:0次
10 . 994 K,当H2缓慢通过过量的块状固体CoO时,部分CoO被还原为固体Co。在流出的平衡气体中H2的物质的量分数为2.50%; 在同一温度,若用CO还原固体CoO时平衡气体中CO的物质的量分数为1.92%。 如果994 K时物质的量比为1:2的一氧化碳和水蒸气的混合物在一定条件下反应,问:
(1)一氧化碳的平衡转化率大约是多少___________ ?
(2)欲获得较纯的H2,请简要说明在生产工艺上应采取的措施___________ 。
(3)994 K,当H2缓慢通过过量的纳米CoO固体粉末时,部分CoO被还原为固体Co。在相同的反应时间内,与块状固体CoO相比,采用纳米固体CoO时流出的平衡气体中H2的物质的量分数将怎样变化___________ ?为什么___________ ?
(1)一氧化碳的平衡转化率大约是多少
(2)欲获得较纯的H2,请简要说明在生产工艺上应采取的措施
(3)994 K,当H2缓慢通过过量的纳米CoO固体粉末时,部分CoO被还原为固体Co。在相同的反应时间内,与块状固体CoO相比,采用纳米固体CoO时流出的平衡气体中H2的物质的量分数将怎样变化
您最近半年使用:0次



